 图源:pixabay
图源:pixabay
编者按
2020年4月,中国科学院神经科学研究所研究员杨辉课题组在CELL上发表论文;过了三个月,原美国加州大学付向东教授举报杨辉“剽窃和涉嫌造假等学术道德不端行为”。(详见《知识分子》报道独家探争议|上海学术新星遭举报,审稿人现身称曾拒稿)
这篇CELL论文声称在某些胶质细胞中敲降Ptbp1可以将该细胞转分化为神经元,进而恢复小鼠的神经相关功能。但在2020至2022两年间,很多国内外实验室发表实验结果表明该实验无法重复。(详见《知识分子》报道真相还是假象?神经所杨辉CELL论文再遭质疑)
虽然杨辉否认了上述指控,但2022年底,杨辉课题组发了2篇研究文章,基本否定了自己在2020年Cell文章中关于Ptbp1敲降导致神经元转分化的结论。曾经发文质疑杨辉论文的约翰·霍普金斯医学院Seth Blackshaw第一时间在推特上说道:
“这很有趣。在2020年,在@CellCellPress上报告Ptbp1基因敲除可诱导胶质细胞转变为神经元的小组,现在承认这一切都是由于GFAP-AAV报告基因转录本泄漏所造成的。为什么不撤回原始论文呢?”
“This is intereting. The group that reported that Ptbp1 knockdown induced glial-to-neutron in @CellCellPress in 2020 now admits it was just leaky GFAP-AAV reporter construct all along. Why not just retract the original paper?”
是的,为什么不直接撤稿呢?也许我们可以进一步问,那篇CELL论文声称的小鼠的视觉功能行为学展现出显著恢复,小鼠帕金森病模型行为学显示明显症状缓解是如何做到的呢?
撰文|钱诚 周峰泉
责编|邸利会
大部分中枢神经系统 (如脑、脊髓、视网膜) 疾病或损伤最终导致神经元细胞 (neuron)的死亡,从而丧失各类神经相关功能 (感觉,运动,认知)。
但与神经元共存数量相当的具有损伤应激潜能的神经胶质细胞 (glia) 往往死亡较少且能分裂增生。因此近期中枢神经再生研究的一个重要研究方向,也被广为看好的一种策略是通过细胞重编程技术将胶质细胞进行原位谱系转分化成为神经元,再依赖新生的神经元恢复具有功能的神经环路。
细胞身份的本质还是由独特的转录组和表观组决定的。所以一些居于转录组调控通路上游的基因,比如与神经谱系 (cell type) 密切相关的转录因子或者对miRNA具有广泛修饰能力的分子被优先选为功能筛查的目标。
其中两个“明星”蛋白是NeuroD1和Ptbp1。
“明星”
Gong Chen团队2014年率先在Cell Stem Cell刊发报道NeuroD1高表达可以在脑外伤或者阿尔兹海默病小鼠模型中将星形胶质细胞原位转分化成为谷氨酸能投射神经元[1]。该团队2020年报道NeuroD1高表达可在缺血模型中在体实现星形胶质细胞-神经元转分化[2],同年报道指出NeuroD1高表达可实现脊髓损伤中星形胶质细胞-神经元转分化[3]。
过去十年中,围绕NeuroD1的文献发表很丰富,同时讨论也很激烈,如UPenn的Beverly L. Davidson实验室在Molecular Therapy刊文指出NeuroD1高表达未能在皮层或者海马脑区将星形胶质细胞转分化成为神经元[4]。
第二个“明星”的出现又将围绕谱系转分化-依赖的神经再生策略的争鸣推向了新高度。
2020年,有研究团队在Cell刊发报道在视网膜中的穆勒胶质细胞中敲降Ptbp1可以高效地将该细胞转分化成负责眼-脑投射的视神经节神经元,并且在NMDA兴奋性损伤造成视神经节细胞大量死亡的视网膜中高效产生新的投射神经元。
如果要恢复原有的神经功能,新生神经元需要通过许多重要步骤,包括1)轴突需要在成年视神经与大脑中重新生长与寻迹探索找到以前的控制靶点,2)与靶点神经元重建神经突触连接,3)最后还需要髓鞘重生恢复神经信号快速传导能力。在这些理论基础上该文章报道小鼠的视觉功能行为学展现出显著恢复。
同时,该Cell文章同时报道在6-羟多巴小鼠帕金森病模型纹状体区域在星形胶质细胞中敲降Ptbp1可以将其高效转分化为多巴胺神经元[5],且小鼠行为学显示明显症状缓解。其它报道也佐证了Ptbp1敲降在纹状体或者其它脑区将胶质细胞转分化成为神经细胞的功能[6][7]。
质疑
虽然这些结果令人振奋,给了很多病人康复和投资者新药开发的希望,但后续很多国内外实验室2020至2022两年间发表实验结果表明该实验无法重复。其中最主要的原因是所用的病毒载体不能特异性的在神经胶质细胞中调控Ptbp1,从而在实验中观察到的“新生神经元”其实是被病毒非特异性标记的原有的神经元。
约翰·霍普金斯医学院Seth Blackshaw实验室在Cell Reports发文指出在视网膜穆勒胶质细胞中特异性敲除Ptbp1基因未能将该类细胞转分化成为视神经节神经元[8]。文中使用单细胞测序谱系追踪和免疫组织染色展示不存在穆勒胶质细胞转分化而来的新生神经元,同时穆勒胶质细胞也没有产生显著的转录组水平的谱系迁移。
西奈山医学院Bo Chen实验室同样报道Ptbp1敲降,在应用严格的单细胞荧光追踪情况下,未成功诱导穆勒胶质细胞转分化成为视神经节神经细胞[9]。中山大学Mingtao Li和Shanshan Ma组在eLife发文报道利用Aldh1l1-CreERT2严格追踪星形胶质细胞,Ptbp1敲降未成功在6-羟多巴帕金森病模型小鼠的黑质纹状体两个区域将星形胶质细胞转分化成为多巴胺神经元[10]。类似的,厦门大学Yingjun Zhao团队在J Neurosci发文指出下调Ptbp1未成功于小鼠海马脑区将星形胶质细胞转分化成为神经元,或者缓解阿尔兹海默小鼠模型的行为学症状[11]。
自我否定?
有意思的是,上述Cell文章的研究团队2022年底于Scientific Reports刊文[12],认为将病毒血清型改为AAV9以及移除载体质粒中的WPRE原件可以显著剔除对于视网膜穆勒胶质细胞以外的旧有内源神经元的泄露造成的假阳性追踪。
在使用这种AAV9和WPRE移除病毒感染的情况下,不论是Ptbp1敲降,还是诸多经典转录因子高表达,比如NeuroD1,Math5和Brn3b,统统未成功将穆勒胶质细胞转分化成为视神经节神经元(如下图)。
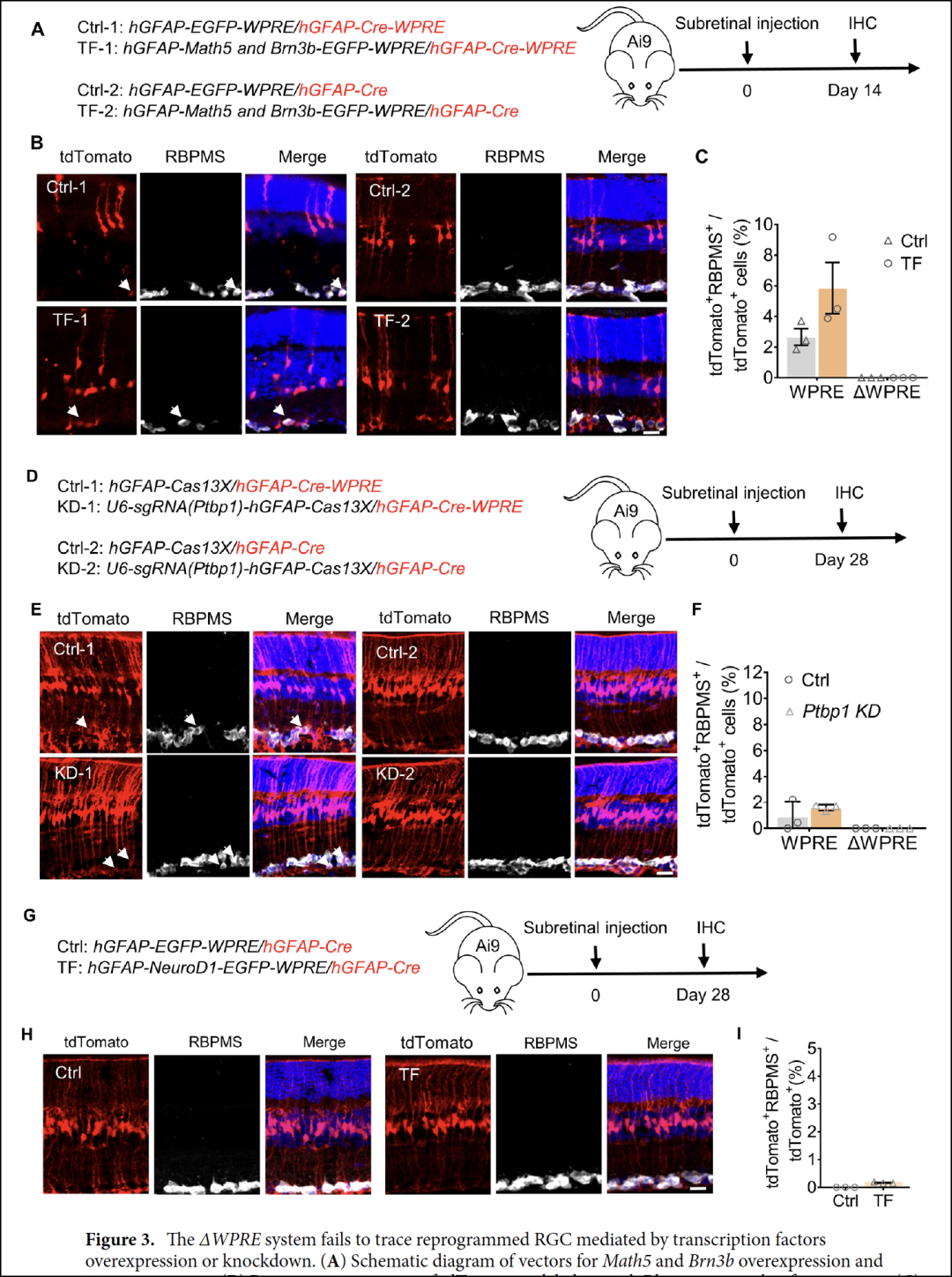
但是该团队2020年Cell文章的最大亮点是在NMDA损伤模型将视网膜神经节神经细胞杀伤到所剩无几,或者6-羟多巴对纹状体多巴胺神经元造成严重损失的情况下,Ptbp1敲降组观测到巨大数量的红色荧光追踪的“新神经元”,以及神经环路功能与行为学康复。如果不能产生新的神经元细胞,即使旧有内源神经元被泄露的荧光标记,但是它们也会被NMDA或者6-羟多巴大量杀死。那么观测到的红色荧光-阳性的神经元到底是怎么来的?神经功能怎么恢复的?是否Ptbp1 guide-RNA与荧光蛋白同时泄露到内源旧有神经细胞的情况下,Ptbp1敲降对于NMDA或者6-羟多巴损伤具有神经保护功能呢?相信很多国内外实验室后续的验证会给出答案。
同时,2022年底在预印本平台Research Square(状态为BMC Gene Therapy“修改中”),同一团队在新的研究中明确指出利用Cas13X敲降Ptbp1未能在体内实验中将纹状体区域中星形胶质细胞转分化成为神经元(如下图)。

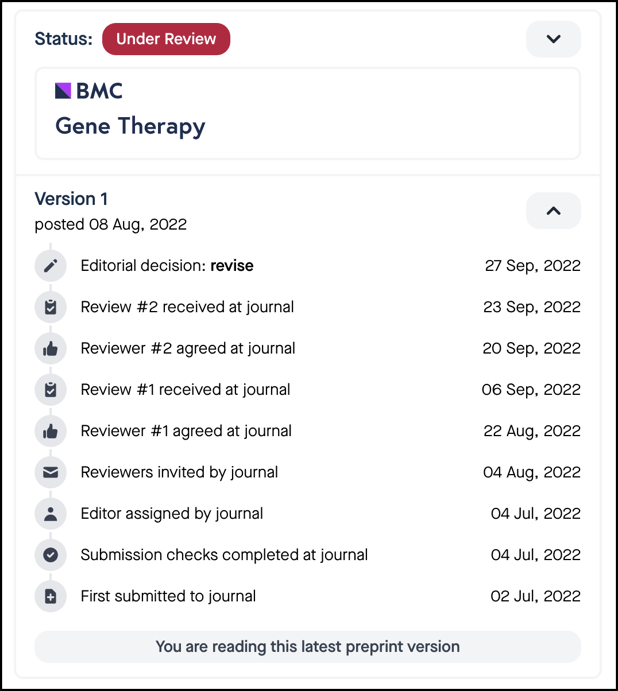
因此,来自同一研究团队的后续2篇研究文章基本完全否定了自己在2020年Cell文章中关于Ptbp1敲降导致神经元转分化的结论。
失明的老鼠怎么可能“看见了”?
作为一个研究者和文献读者的几点感悟:自然与生命的运行是自发的,动态的,复杂的。然而,科研文章的peer review流程毕竟是一个人为设计的流程,只要是制度就没有完美的。很多时候可以推荐,甚至自行指定同行评议的人选。由两到三个人决定的发表是一篇科研文献仅仅是科学发现的第一步。广大同行的审视,讨论,引用,甚至对于广大同行后续科研产生的深远积极意义才是一篇文章的真实价值。
身为科学工作者在阅读论文时,我们觉得这三个问题值得关注——
跨细分学科发表的文章,比如一篇CRISPR基因编辑应用到Neuroscience的文章,在同行评议学者公开的情况下,可以稍微留意一下这里有没有做Neuroscience的学者参与了审稿,还是三个均为基因编辑的“小同行”;
对于文章里动物行为学功能恢复的数据,应该首先寻找关注研究中确凿的分子细胞和结构基础。比如说,神经纤维如果没有“接回去”,那失明的老鼠怎么可能“看见了”,脊髓横断的瘫痪老鼠怎么可能“又跑起来了”?具体说,突触重新“接回去”,还要依赖轴突在成年神经系统中快速延伸,寻迹探索,髓鞘再生等等先决条件,更不要提阿尔兹海默和帕金森症机理更为复杂和多因素的疾病;
仔细考虑上面提到的一系列复杂的组织修复过程,是否可以仅仅通过单基因调节就能实现,还是需要多基因,多步骤协同调控?
参考文献:
1.Cell Stem Cell. 2014 Feb 6;14(2):188-202.
2.Mol Ther. 2020 Jan 8;28(1):217-234.
3.Front Cell Dev Biol. 2020 Dec 16;8:591883.
4.Molecular Therapy Vol. 30 No 3 March 2022.
5.Cell. 2020 Apr 30;181(3):590-603. e16.
6.Nature. 2020 Jun;582(7813):550-556.
7.Nat Neurosci. 2021 Aug;24(8):1089-1099.
8.Hoang et al., 2022, Cell Reports 39, 110849 June.
9.Cell Reports 39, 110960, June 14, 2022.
10.Chen, Zheng et al. eLife 2022;11:e75636.
11.J. Neurosci 42(38):7309–7317.
12.(2022) 12:22410
0
推荐



 京公网安备 11010502034662号
京公网安备 11010502034662号 