阅读:0
听报道

前言:
癌症难以治愈的原因有很多。为了能够更好地控制癌症,科学家们一方面在研发更好的抗癌药物,另一方面也在寻找增强药效的方式。给药方式的进步很可能带来癌症治疗的巨变。这篇文章描述了一种采用纳米颗粒将抗癌药物更有效地输送到病人病灶部位的新方法。纳米颗粒是一种很小的材料,能像海绵一样吸满抗癌药物。科学家们希望纳米颗粒能够提高抗癌药物靶向肿瘤组织的效率,保护身体的正常组织免受强毒性药物的影响,同时降低药物剂量。尽管这项技术还处于研究初期,有待优化,但前景颇为可观,将来或成为有效的癌症治疗策略。
撰文|Courtney Thomas(瑞士洛桑联邦理工学院瑞士实验癌症研究所)
翻译|瀚 海
责编|李 娟
● ● ●
尽管癌症治疗手段已经有了很大的提高,但是癌症仍然是一种很难治愈的疾病,原因之一就是化疗药物的治疗效果不太理想。这些药物的毒副作用通常很强,病人常常会出现严重副作用,包括疲劳、脱发、体重减轻和疼痛等。那么有没有一种特殊的药物载体能在不损伤正常细胞的情况下,只杀死癌细胞呢?这正是科学家们开发新型给药方式的目的。将药物输送到癌细胞的工具被称为药物投递载体(drug delivery vehicles,DDVs)。如果化疗药物只进入癌组织而不干扰健康细胞,就无需太大剂量的药物,副作用也就随之减轻。目前,已有一些DDVs用于临床,还有一些正在被研发和优化,以确保人体试验的安全性。
而这些科学家们面临的一个主要的问题,就是如何引导DDVs将药物只输送到癌细胞中。通过利用癌细胞与正常细胞的不同特征,或许能达到这个目的。[1]
01 癌细胞的特征
癌症是一种复杂的疾病,癌细胞生长方式与正常健康细胞不同。正常细胞会不断分裂,直到变老或者受损,最后发生细胞凋亡(程序性细胞死亡)。这是身体的正常调节过程,几乎所有机体细胞都会经历这个过程。但是,癌细胞无法接收停止分裂的信号,它们的分裂和生长不受控制,最终形成一团癌细胞(肿瘤)。肿瘤中的癌细胞具有生存优势,因为肿瘤能够长出许多血管,保证癌细胞得到足够的营养不断生长。癌细胞与正常细胞的另一个不同点,就是癌细胞表面的某些受体分子数量比正常细胞的更多。这些受体能够识别细胞外的特殊营养物质,并将它们带到细胞内部用于细胞生长。
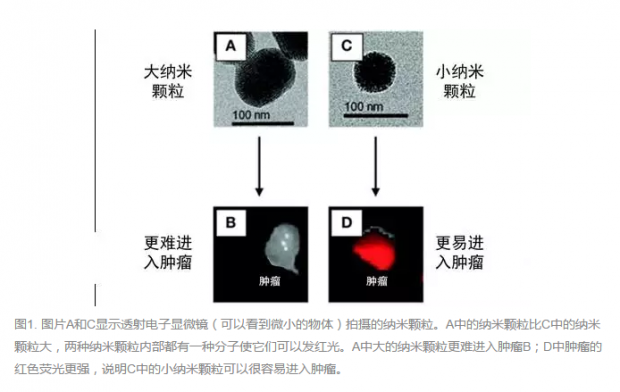
研究人员可以利用癌细胞与正常细胞之间的差别,引导DDVs只进入癌细胞。相比正常的血管壁,肿瘤部位的血管壁疏松多孔,因此小的DDVs更容易穿过并进入肿瘤组织。一旦进入肿瘤组织,DDVs可以更持久地停留在肿瘤组织中(图1)。如果DDVs在到达肿瘤之前,能将药物安全完整地保持在其内部,那么它将是癌症靶向治疗的关键。
02 纳米颗粒构成的药物投递载体
基于我们对癌细胞和肿瘤性质的了解,开发DDVs需要满足以下几个要求:首先,DDVs必须由对人体无害的材料制成;其次,DDVs需要足够小,可以通过血管和细胞表面受体进入肿瘤中;第三,DDVs本身能够携带抗癌药物,并在到达肿瘤细胞之前保证抗癌药物不泄露;第四,我们能够以某种方式追踪DDVs,这样就能知道它到达了机体的哪些部位以及是否进入了癌细胞,这点对病人而言不必要,但是对研究DDVs的科学家而言是必需的。
纳米颗粒是一种非常小的颗粒(比人体头发直径还小1000倍)。这项研究中使用的纳米颗粒DDVs由硅组成,像海绵一样有小孔,因此可以将抗癌药物保存在小孔中。纳米颗粒越小就越容易进入肿瘤组织中[2],当药物从纳米颗粒中释放,肿瘤组织中的药物就能达到足够高的浓度。但是,如果纳米颗粒在到达肿瘤之前泄露了药物,就无法保护健康细胞,也无法让更高剂量的药物直接进入肿瘤。
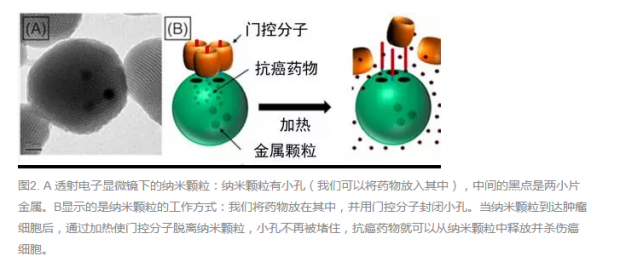
如何才能使药物更完整地保存在纳米颗粒中呢?我们通过在纳米颗粒表面键合上一些分子,能够堵住海绵的小孔,这些分子叫做“门控分子”。如果门控分子能够在不同条件下改变形状,当纳米颗粒到达肿瘤时,门控分子能够打开小孔释放药物,那么它就能特异性地将药物释放在肿瘤部位。同时,如果门控分子不能完全堵住小孔,或者在纳米颗粒到达肿瘤组织之前改变形状,药物就可能泄露。因此,设计一个性能优良的门控分子至关重要。
通过加热可以改变门控分子的状态。在这项研究中,我们使用了一种特殊的工具,叫做感应加热器。这种机器中有一个特殊的线圈,线圈通电后能够在周围产生磁场。如果此时把金属(如螺丝刀等)放进线圈中间,金属就会被加热,温度会升高。
使门控分子变形所需要的热量并不多。我们可以将一小块金属放进纳米颗粒里面,通过感应加热器对肿瘤组织进行轻微加热,改变门控分子的形状,打开纳米颗粒的小孔,让药物得以释放,但是不能过度加热,否则会损伤或者杀死健康细胞(图2)。
那么如何追踪纳米颗粒呢?我们在纳米颗粒表面接上了一个荧光分子,使纳米颗粒可以在特殊的光照下发出绿光,这样我们就可以使用荧光显微镜观察纳米颗粒的位置。
03 纳米材料投递药物的效果
完整的纳米颗粒包含抗癌药物和小金属颗粒,表面有门控分子,我们可以用感应加热器促进药物释放,那么它们在癌细胞中是如何发挥功能呢?
在这项实验中,我们并没有使用肿瘤动物模型,而是使用了可在实验室培养的乳腺癌细胞系,实验分三组:一组细胞与含有药物的纳米颗粒培养,但是不感应加热;另一组细胞与不含有药物的纳米颗粒培养,并采用感应加热器加热;第三组细胞与含有药物的纳米颗粒培养,并用感应加热器加热[3]。在图3中,我们可以看到乳腺癌细胞的轮廓(灰色),黄绿色的点是纳米颗粒,红色代表纳米颗粒中释放的抗癌药物。那么,这三组癌细胞的死亡程度如何呢?
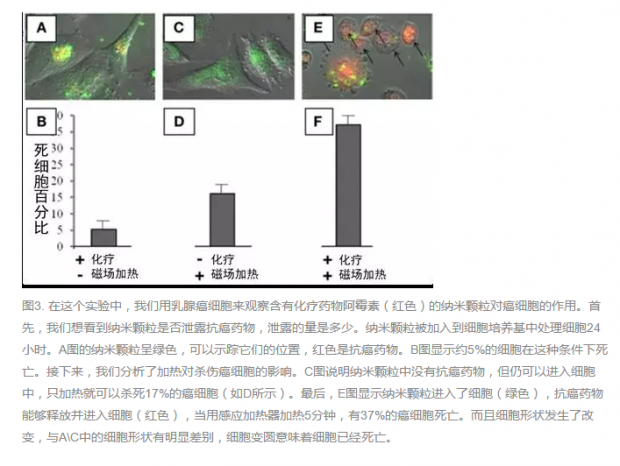
当我们只使用纳米颗粒,但是不加热时,有5%的乳腺癌细胞死亡(图3 左),这意味着可能有小部分药物从纳米颗粒中泄露;图3中间两幅图是使用不含药物的纳米颗粒时的情况,当加热5分钟时,17%的癌细胞死亡,这意味着就算没有药物,热量也可以杀死部分乳腺癌细胞。最后,我们将包含药物和金属的纳米颗粒与细胞培养并加热(图3 右),发现37%的乳腺癌细胞死亡。
04 结论
这些实验告诉我们,纳米颗粒DDVs可以有效输送抗癌药物到癌细胞,但是这个系统还有需要提高的地方:必须保证药物在纳米颗粒到达肿瘤组织进入肿瘤细胞之前不泄露,并且缩短开启机器寻找安全加热区域所需要的时间。目前,已有其他类型的纳米颗粒DDVs在人体使用。这项研究中使用的纳米颗粒DDVs经过优化,也可能在癌症病人身上使用,达到降低化疗副作用的目的。也许,不久的将来,带来肿瘤治疗药物巨变的就是这种毫不起眼的纳米级的药物制剂。
参考文献:
[1] Hanahan, D., and Weinberg, R. A. 2000. The hallmarks of cancer. Cell 100(1):57–70. doi:10.1016/S0092-8674(00)81683-9
[2] Meng, H., Xue, M., Xia, T., Ji, X., Tarn, D. Y., Zink, J. I., et al. 2011. Use of size and a copolymer design feature to improve the biodistribution and the enhanced permeability and retention effect of doxorubicin-loaded mesoporous silica nanoparticles in a murine xenograft tumor model. ACS Nano 5(5):4131–44. doi:10.1021/nn200809t
[3] Thomas, C. R., Ferris, D. P., Lee, J. H., Choi, E., Cho, M. H., Kim, E. S., et al. 2010. Non-invasive remote-controlled release of drug molecules in vitro using magnetic actuation of mechanized nanoparticles. J. Am. Chem. Soc. 132(31):10623–5. doi:10.1021/ja1022267

话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。



 京公网安备 11010502034662号
京公网安备 11010502034662号 