阅读:0
听报道

整理 | 叶水送 应可钧
责编 | 徐 可
● ● ●
人生如同一辆汽车,刚开始的时候,性能完好,即使遇到颠簸的道路也所向披靡。随着时间的流逝,新车变旧车,停停补补已成为常态,如果疏于对零部件的更替,那么旧车就可能会变成坏车,再也不能在公路上驰骋了。
同样的,人的“零部件”如果坏了,就需要进行器官移植。事实上,器官移植并不是一个新鲜话题,随着科技的进步,器官移植的成功率已经大为提高。
尽管如此,器官匮乏是当下我们仍面临的一个严重问题。每年全球大概有200多万人急需器官移植,而器官捐献的数量远低于需要的人群,这也导致很多科学家从山羊、狒狒、兔子甚至狗身上打起主意。经过无数次的尝试以及失败教训,人们才逐渐意识到,猪可能是更为理想的器官供体。在器官的功能、大小以及可及性上,猪都是人类理想的器官供体。
但猪作为供体,面临着两个主要问题:一是异种器官移植所造成的免疫排斥;二是猪自身携带有病毒,如果将其器官移植到人体,可能会造成危害。据资料显示,上世纪90年代,医学研究者曾尝试用异种器官移植的方式解决人类供体器官短缺问题,由于存在上述原因,世界卫生组织及美国政府均明确表示,在找到解决办法之前,停止一切异种器官移植的临床试验。
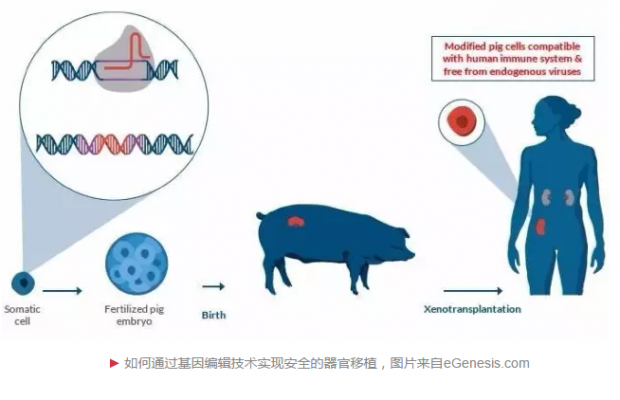
2017年8月10日,国际顶级学术杂志《科学》发表了eGenesis公司与哈佛医学院华人学者杨璐菡及其研究团队的一项重要工作:成功克隆一批内源性逆转录病毒失活的猪(PERV-inactivated pigs)。这项工作消除了猪供体所携带的病毒,同时也展示出基因编辑技术对解决器官匮乏问题的推动作用。该项目是由美国eGenesis公司主导,哈佛医学院George Church教授及云南农业大学魏红江教授课题组合作参与。
杨璐菡出生于四川,本科毕业于北京大学生命科学学院,后师从被誉为“合成生物学之父”的George Church教授,获得哈佛大学博士学位。2015年,杨璐菡与Church教授联合创建了生物技术公司eGenesis,并担任首席科学官。该公司致力于利用CRISPR/Cas9基因编辑技术为患者提供安全、有效的可供移植的组织和器官,今年3月获得3800万美元的A轮融资。
在这项研究中,杨璐菡及论文的第一作者牛冬等人发现,PERVs病毒在体外不仅会从猪细胞感染人的细胞,还可在人细胞之间进行传播。该病毒一旦侵入到人体细胞中,有可能会引起免疫缺陷、肿瘤发生等健康隐患。因此,如果用猪作为器官供体,应必须清除所有的PERVs病毒。
为了得到 PERVs失活的猪个体,研究人员首先通过 ddPCR 技术结合测序技术,在原代猪胎儿成纤维细胞系(FFF3)中共找到了25个 PERVs 基因拷贝,并根据PERVs病毒的pol基因的催化核心序列,设计了两种gRNA。研究者发现当利用CRISPR/Cas9基因编辑技术敲除掉细胞中90%的病毒时,细胞无法生长,为了防止基因编辑造成的基因损伤诱发细胞凋亡,研究人员加入了p53 抑制剂(PFTα)和碱性成纤维细胞生长因子(bFGF),从而使100%的病毒失活的细胞,仍可生长。
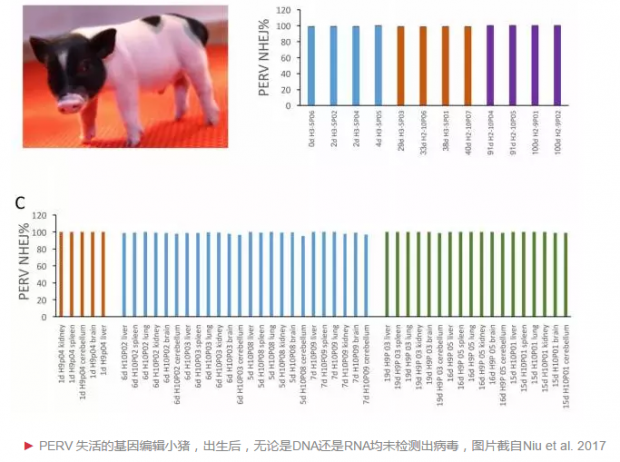
这些经过基因编辑技术高度修饰的原代猪胎儿成纤维细胞系(FFF3),再通过体细胞核移植技术(SCNT),即可让诞生的猪完全不会携带PERVs病毒。4个月后,研究者再检查猪的DNA以及RNA,均未发现病毒的存在。
杨璐菡博士表示,“第一批内源性逆转录病毒灭活猪的产生,是异种器官移植科学研究进程的标志性里程碑。我们的团队用新一代基因技术CRISPR/Cas9根除了猪细胞里面所有的内源性病毒活性,再通过核移植克隆技术,成功得到了没有病毒活性的猪。这批猪的产生和健康成长,让我们第一次从根本上解决了异种器官病毒传染的风险。在这批猪种的基础上,我们将继续改造基因组以解决免疫排斥问题。”
以下为杨璐菡博士接受《知识分子》的访谈内容:

《知识分子》:您能大致介绍这项工作的主要发现吗?
杨璐菡:2015年,我们在猪的癌症细胞系PK15上,证明了灭活所有的内源性逆转录病毒的可能性。在过去的1-2年时间里, 我们用CRISPR 和小分子药物在猪的原代纤维细胞实现了25个基因位点的同时打靶,之后像克隆羊多莉一样,我们用了核移植的方法,用被基因修饰的猪纤维细胞克隆出了猪。这项工作实现了世界首例内源性逆转录病毒灭活小猪的创造。
从临床应用来说, 我们从根本上解决了异种器官移植关于异种病毒传染的风险。这批猪将是奠基性的一批猪种,今后将被继续改造,应用到安全的异种移植临床上。
这项工作的科学探索性也很高。内源性逆转录病毒在包括人类在内的所有哺乳类动物体内都存在,该病毒元件对寄主有没有必须的生理和发育的意义,科学界对其了解也甚少。这些猪的诞生和健康成长回答了科学上一个很大的疑问,在4个月时,我们没有观测到修饰的小猪和正常小猪有生理上的区别。对这些猪的长期观察,我们将为科学领域提供前所未有的关于内源性病毒可能作用的线索。
从技术创新上来讲, 我们发明了CRISPR/Cas9 和小分子药物结合处理,实现了有史以来最大规模的一次原代细胞系的基因组修饰。这个多位点基因打靶方法将在广泛的生物制药和医疗领域得到应用。此次生产的猪是基因修饰最多的一个活体大动物,对它们的长期观察,将会对基因修饰和基因治疗领域很多未知的安全性问题,提供答案。
《知识分子》:这项研究有没有考虑到器官移植过程中的免疫排斥反应问题?
杨璐菡:内源性病毒灭活小猪的诞生,让我们从根本上解决了异种病毒传染的问题,这只是万里长征的第一步。与此同时,我们在努力尝试不同的基因编辑方法,提高猪的器官和人体的免疫兼容性。希望不久的将来,我们可以通过数据和科学界以及临床领域的研究者交流和分享免疫排斥方面的进展,一起推动整个异种器官移植领域在临床上的应用。
《知识分子》:此次很多合作机构来自中国,未来是否会考虑为中国患者提供器官来源?
杨璐菡:在猪身上进行灭活内源性病毒实验的挑战和未知性很高,但我们有一个勇于创新和拼搏的团队,在过去1-2年的时间,我们完成了别人二十多年来一直探索、但没法进行的工作。我坚信科技的力量和团队的力量,今后会稳扎稳打,继续推动异种器官移植的研究。在此,借这个机会感谢eGenesis 科研团队和合作的中外机构。
中国是一个人口大国,需要接受器官移植的患者数量众多,我们希望能做好手头的科研工作,为全世界乃至中国的千千万万患者提供器官的来源和生存的希望。
参考文章
1. Niu D et al. Inactivation of porcine endogenous retrovirus in pigs using CRISPR-Cas9. Science. 2017. 10.1126/science.aan4187.
2. She’s hellbent on solving the organ shortage with ‘designer pigs.’ Just don’t keep her waiting. APRIL 6, 2017. https://www.statnews.com/2017/04/06/crispr-pig-organs-transplant-luhan-yang/

话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。



 京公网安备 11010502034662号
京公网安备 11010502034662号 