撰文 | 周 炜
责编 | 叶水送
2月15日,浙江大学医学院和求是高等研究院胡海岚团队在著名期刊《自然》杂志同时刊发两篇研究长文(Research Article),揭示了快速抗抑郁分子的作用机制,推进了人类关于抑郁症发病机理的认知,并为研发新型抗抑郁药物提供了多个崭新的分子靶点。

根据世界卫生组织(WHO)介绍,目前全球有超过3亿人患有抑郁症,以女性居多,抑郁症已成为影响人类生活最严重的精神疾病之一,抗抑郁药物的销售额每年以百亿美金计。
过去几十年中,人们逐渐认识到,抑郁症并不是简单的心理出现问题,而是大脑发生了病理性的改变。传统的理论认为,大脑中的一些化学物质,比如和情绪、活力相关的多巴胺、5羟色胺等单胺类递质的减少引起了抑郁症。
目前的抗抑郁药物大都基于这一点来提高全脑单胺类递质的浓度。
基于科学研究的进步,人类在应对很多疾病时可以做到药到病除。比如,服用抗生素之后几小时就可以有效地抑制炎症感染。
然而,“针对精神类的疾病,尤其是抑郁症,药物起效的时间往往非常缓慢,需要几周甚至几个月。而且只在20~30%左右的病人中起效。”胡海岚指出,“这提示目前的抗抑郁药物可能只是间接地起到作用,我们对抑郁症机制的了解可能还没有触及其核心。”
一种抗抑郁领域的“新贵”——氯胺酮为科学家提供了强有力的新线索。它是一种麻醉剂,同时也是毒品“K粉”的主要成分。
近年来,科学界注意到,低剂量的氯胺酮会产生快速抗抑郁的效果,起效时间在一小时以内,并且可以在70%以上的难治性抑郁症患者中发挥作用。
氯胺酮的快速抗抑郁功效,被科学家称为“整个精神疾病领域近半个世纪最重要的发现”,它迅速引起了脑科学界的研究兴趣:
氯胺酮作用于大脑中的什么部位?在哪些细胞上起作用?它为何能快速起到抗抑郁的效果?这些疑问,将是是人类进一步认识与治疗抑郁症的关键。
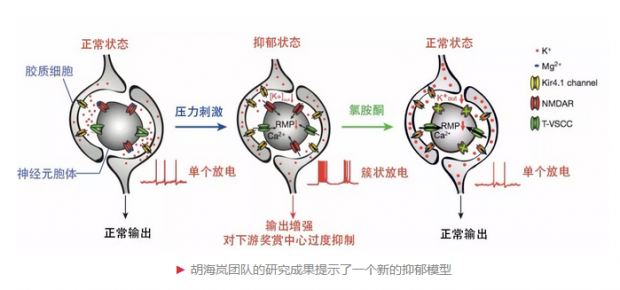
在Ketamine blocks bursting in the lateral habenula to rapidly relieve depression一文中,胡海岚团队首次揭示了外侧缰核的一种特殊放电方式——簇状放电是抑郁症发生的充分条件,而氯胺酮的起效原因正是有效阻止了这一脑区的簇状放电。
外侧缰核是大脑中海马体下方一个小小的核团,它是大脑的“反奖励中枢”,被认为介导了人的大部分负面情绪:恐惧、紧张、焦虑。它与中脑 “奖励中心”的单胺核团”相互“拮抗”,左右着我们的情绪。
众所周知,神经元通过放电向下游发送信息。胡海岚团队发现,在抑郁症小鼠模型中,缰核神经元的放电方式发生了显著的变化。“正常小鼠的放电模式是单次放电,而抑郁症小鼠的呈现出了更多的簇状放电行为,就像霰弹枪变成了机关枪,密集高效地射出子弹,发送的信息变得非常高效。”胡海岚说,这种放大的信号强化了外侧缰核对“奖励中心”的抑制,让小鼠感受不到快乐,产生了抑郁。
为了证实这一机制,课题组进行了经典的“强迫游泳”实验。当小鼠掉入“水池”中,正常小鼠会表现出积极的求生挣扎,而抑郁症小鼠则表现出“行为绝望”——瞬间放弃,进入悬浮不动的状态。在另一组“糖水偏好”实验中,抑郁小鼠不能象正常小鼠那样表现出对糖水的偏好,体现了快感的缺失。通过光遗传学技术,课题组实时诱发小鼠外侧缰核的簇状放电,结果显示,原本不抑郁的小鼠瞬时地表现出以上多种典型的抑郁行为。
这是在抑郁症领域内首次实现了只改变某个脑区的放电模式,从而诱发抑郁样行为。氯胺酮的快速起效的谜团,也在实验中得以解开。原来,外侧缰核的簇状放电依赖于大脑中最主要的兴奋性递质谷氨酸受体(NMDAR);而氯胺酮,正好是NMDAR的阻断剂,它的出现,阻断了NMDAR发挥作用,也就完全阻断了外侧缰核神经元的簇状放电,让我们能够重新获得活力、感知快乐。
“这一系列研究阐明了氯胺酮快速抗抑郁的全新脑机制——即氯胺酮可以通过阻断外侧缰核的簇状放电,进而释放对下游单胺类奖赏脑区的过度抑制,最终产生快速抗抑郁的疗效。”胡海岚说。

虽然氯胺酮的快速抗抑郁机制已真相大白,但氯胺酮作为一种毒品,在临床上作为抗抑郁药物使用还有很大局限。科学家仍然在寻找和设计更为安全有效的抗抑郁药物。胡海岚团队在研究中,发现了多个崭新的药物靶点。
胡海岚团队利用脑片电生理和数学建模的方法证明,位于外侧缰核的另一个离子通道:T型钙通道(T-VSCCs)对神经簇状放电也发挥着重要作用。
“在全身或者外侧缰核内局部阻断T型钙通道,同样产生了快速的抗抑郁效果。”胡海岚说,“这一工作告诉我们,T型钙通道是一个崭新的抗抑郁分子靶点。”
同期发表的另一篇《自然》论文Astroglial Kir4.1 in lateral habenula drives neuronal bursts in depression中,胡海岚团队又揭示了另外一个快速抗抑郁分子靶点——存在于胶质细胞中的的钾离子通道Kir4.1,对引发神经元的簇状放电至关重要。
胶质细胞和神经元细胞是我们大脑中两类不同的细胞。胶质细胞包绕于神经元细胞外,形成一个相对封闭的胞外空间。胡海岚研究团队发现,当星形胶质细胞中钾离子通道Kir4.1高表达时,神经元释放到胞外空间的离子会被加速清除,导致神经元的超极化,进而诱发簇状放电。
“钾离子通道的高表达与抑郁症形成具有因果关系,这是我们发现的大脑中神经元细胞和星形胶质细胞全新的交互机制。”胡海岚表示。
在这一系列研究中,胡海岚团队陆续指出了谷氨酸受体NMDAR、T-VSCCs 、Kir4.1作为快速抗抑郁分子靶点的有效性,“虽然药物研发的道路很漫长,但是我们已经看见了曙光,并且迈出了第一步。”胡海岚说。
《自然》杂志评审人对这一系列重大突破给予了很高评价:“关于外侧缰核NMDA受体参与介导簇状放电和氯胺酮的抗抑郁作用的发现非常重要、创新,并且具有广泛的意义”,“这篇迷人的论文发现了一种不同寻常的神经元和胶质细胞的相互作用。”
近年来,胡海岚教授在情绪和社会行为的神经生物学基础这一脑科学前沿方向取得了一系列系统性原创成果。2017年,《知识分子》介绍了胡海岚团队在小鼠大脑中发现一个与社会竞争阶层优势相关的神经回路,相关研究发表在《科学》杂志上。
2013年,胡海岚团队在《科学》杂志发表的另一文章,揭示了大脑外侧缰核“失望分子”βCaMKII在抑郁症中起着关键作用。
“本次研究是上一次研究工作的延续,我们发现了大脑中特殊部位的特殊放电模式与抑郁症的关系,并找到了可能更适合做为药物靶点的‘抑郁分子’。”胡海岚说。
胡海岚长期从事情感与社会行为的神经机制研究,先后在美国加州伯克利大学、美国冷泉港实验室、中国科学院上海生命科学研究院从事研究工作。自2015年5月起任职浙江大学,双聘于浙江大学求是高等研究院和医学院神经科学研究中心。现为浙江大学医学院教授,神经科学研究中心执行主任。本次课题的合作者包括第四军医大学武胜昔教授课题组,法国国家科学研究院的Hugues Berry实验室,及浙大医学院的李月舟和沈颖课题组。
相关文章
Yang Y, et al. Ketamine blocks bursting in the lateral habenula to rapidly relieve depression. 2018. Nature, doi:10.1038/nature25509.
Cui YH, et al. Astroglial Kir4.1 in the lateral habenula drives neuronal bursts in depression. 2018. Nature, doi:10.1038/nature25752.

0
推荐



 京公网安备 11010502034662号
京公网安备 11010502034662号 