撰文 | 林 睿
责编 | 叶水送
当需要测定样品中特定分子的含量时,通常会用到免疫化学分析方法,这是一种基于抗体和抗原间特异性结合的生物化学分析方法,在基础科研、医疗诊断、检验检疫和司法鉴定等领域中,属于最为常用的检测技术。
免疫化学分析的原理是利用带有信号分子的抗体特异性识别样品中的目标生物分子,通过测量信号强度对目标分子进行定量。在实际应用中,样品中目标分子的含量一般较低,为了提高检测灵敏度,免疫化学分析中通常会引入化学反应以增加信号强度。
传统信号放大方法主要基于酶促反应,将酶与抗体相偶联,利用酶的催化活性将无信号的底物不断转变为有信号的底物从而实现信号放大。由于酶促反应有非常强的信号放大能力,这种传统信号放大方法被广泛应用在免疫化学分析中。但是,随着近几年显微成像技术和样品制备技术的迅速发展,传统信号放大方法的缺点逐渐显露出来——主要包括降低成像分辨率、难于同时检测多个目标分子、不适用于大体积组织样品等。
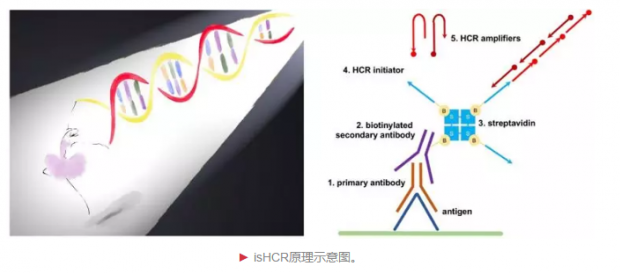
2月26日,北京生命科学研究所罗敏敏实验室在Nature Methods杂志上发文,建立了一种基于杂交链式反应(hybridization chain reaction, HCR)的新型免疫信号放大方法——isHCR。
与传统信号放大方法所采用的酶促反应不同,isHCR所采用的杂交链式反应不需要蛋白的参与,完全由DNA分子进行反应,从而规避了传统信号放大方法的弊端。
在杂交链式反应中,单链DNA分子(HCR initiator)触发一对带有荧光分子标记的单链DNA分子(HCR amplifier)的自组装,形成带有许多荧光分子的双链DNA长链。为了在免疫化学分析中引入杂交链式反应,研究人员将HCR initiator偶联到抗体蛋白上,并利用该抗体特异性地结合样品中的目标分子,形成目标分子—抗体-HCR initiator复合体。之后,再向体系中加入荧光标记的HCR amplifier。目标分子通过HCR initiator触发HCR amplifier的自组装,从而被反应形成的荧光DNA长链所标记。
研究人员在不同类型的生物样品和实验中验证了isHCR,证明相比于传统免疫组化方法,isHCR均显著提高了荧光信号。
研究人员对isHCR进行了优化:利用氧化石墨烯(graphene oxide, GO)结合并淬灭游离的HCR amplifier,降低了isHCR的背景噪音并提高信噪比。同时,在isHCR的基础上开发了多轮信号放大方法isHCRn,进一步提高了信号强度,成功地利用isHCR检测了多种蛋白在小鼠脑组织中的分布,以及细菌分泌的干扰素在宿主细胞内的分布。
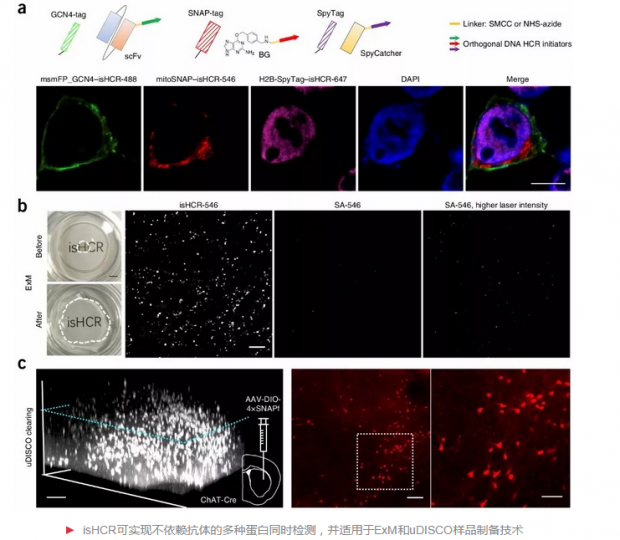
运用DNA分子进行信号放大反应的一大优势是,能够利用DNA序列的多样性对多种目标分子同时进行信号放大。研究人员将两种序列不同的HCR initiator分别偶联到两种不同的抗体上,并利用两对序列不同且互不干扰的HCR amplifier,成功实现对两种目标分子的同时检测和信号放大。进一步,研究人员将isHCR和基因编码的蛋白标签相结合,实现了不依赖于抗体的多目标蛋白同时检测。
近些年来,组织样品制备技术发展迅速,特别是用于膨胀组织样品的Expansion microscopy(ExM)和针对大体积组织样品的透明化技术。利用对HCR initiator的化学修饰,研究人员将isHCR引入ExM样品制备过程中并实现了信号放大,通过一步简单的甲醛固定,使得isHCR放大所得信号在组织透明过程中得以保留。研究人员成功利用isHCR对成年小鼠肺部进行全组织染色,以及在厚脑组织切片中实现了不依赖于抗体的细胞特异性标记。
相比于传统信号放大方法,isHCR具有放大倍数高、模块化设计和可同时放大多个目标等优势,在病理诊断和检验检疫等领域有着广泛的应用前景。考虑到DNA分子可进行多种化学修饰,未来有更多潜在的化学反应可被整合入isHCR方法中。同时,isHCR还可与多种新型成像技术相结合,以实现对生物分子的高通量原位检测。
罗敏敏实验室博士生林睿为本文第一作者,其他作者包括罗敏敏实验室冯琦茹、王睿宇,邵峰实验室李鹏博士、周平博士、邵峰博士,汤楠实验室刘哲博士、汤楠博士,以及化学中心王志强、齐湘兵博士。
相关文章
Lin R et al. A hybridization-chain-reaction-based method for amplifying immunosignals. Nature Methods. 2018. doi:10.1038/nmeth.4611.

0
推荐



 京公网安备 11010502034662号
京公网安备 11010502034662号 