阅读:0
听报道
导语
“贺建奎事件”引发了人们关于基因编辑技术的临床应用的讨论。
最近,曾在多家跨国药企负责临床肿瘤药物开发精准医学工作的陈达维博士来稿,提出人类胚胎的基因编辑并无临床价值,反而增加了胚胎发育的风险。他还认为,用基因编辑技术修正体外胚胎细胞中的遗传病基因与该技术必须依赖的体外受精和植入前遗传检测技术在理念、标准及应用过程上均不相匹配。因此,他建议在澄清基因编辑技术对修改人类胚胎基因的应用价值和适用性等疑问前,不要继续支持或进行该技术在人类体外胚胎细胞基因上的改进研究,以减低其容易被滥用的风险。
本文仅代表作者观点。欢迎投稿参与讨论。
撰文 | 陈达维
责编 | 叶水送
在贺建奎事件引发的大讨论中,有两个反复出现的批评热点:选择CCR5基因的不适当和基因编辑技术的不成熟。本文试图从医学遗传学、生殖医学和分子生物学技术的角度对这两点提供一些新的看法,也希望这些观点对伦理学的讨论有所帮助。
胚胎基因编辑所涉及的技术
在讨论之前,我们先简单说明一下贺建奎所使用的“技术”。有读者或许会说,不就是基因编辑技术吗(实际上是基因组编辑技术,更准确地说是DNA序列编辑技术)?事实上,这也不完全对。贺建奎的“实验”使用的并不仅仅是基因编辑技术,而是三项技术的联合使用。这三项技术就是:从20世纪70年代后期开始使用、生殖医学上革命性的体外受精“试管婴儿”(in vitro fertilization, IVF)技术 [1],从20世纪80年代末开始、随着分子遗传学技术发展而逐渐成熟的胚胎植入前遗传诊断(preimplantation genetic diagnosis, PGD)和遗传筛查技术(preimplantation genetic screening, PGS)[2],以及2012年底才用在哺乳动物基因编辑的CRISPR/Cas9系统技术。
需要指出的是,这些技术的发明目的不同,都有各自独立应用的外延,如基因编辑技术可改变任何物种细胞的DNA序列,并不是为了能够编辑人类胚胎细胞基因而发明的。但在编辑胚胎基因这一具体应用上,这三种技术不仅必须联合使用,而且相互之间有以下不对等的关系:IVF是在人类胚胎细胞上能够使用PGD/PGS和CRISPR/Cas9技术的基础或必要前提;IVF和PGD又是在人类胚胎细胞上能够使用CRISPR/Cas9的基础或必要前提。所以仅仅有基因编辑技术,无论多么完善,也不可能编辑人类体外胚胎细胞中的基因。IVF虽然可以单独使用,但在目前的辅助生殖临床实践中,经常和PGD或PGS联合使用。在美国,大约70%或更多的IVF产生的胚胎会经过PGD或PGS检测。但目前再“广谱”的PGS也只检测几十种常见的遗传病基因,远远不是检测已知的成千的遗传病基因 [2]。
尽管IVF和PGD的发明和应用远早于CRISPR/Cas9,而且已是被主流医学接受并广泛应用的辅助生殖技术和诊断技术,但它们也还远远没有达到完善,在使用过程中仍然有各种风险。同时,IVF和PGD本身在各种情况下的具体应用时仍有各种伦理学争议,世界各国对使用这些技术所制定的法规也有相当的差异。
对贺建奎选择编辑CCR5基因的批评主要在三个方面:1)生物学方面,比如编辑CCR5基因并不能够完全防止HIV的感染,正常的CCR5蛋白还有其它生理功能等; 2)医学实践方面,即现在已有了比编辑胚胎基因更有效、更实用的医学手段防止胎儿感染HIV,不仅根本不需要在体外胚胎中改变与感染HIV敏感性有关的任何基因,编辑基因还增加了未知的风险; 3)伦理学方面,认为两个女婴原来的CCR5基因序列是正常的,而改变人类基因组中的正常基因是不可接受的。把原来“正常”的基因改“坏”当然不行,但改得“更好”也有悖伦理,因为这样会给未来设计制造“超人”这一不堪设想的后果开了先例。另外,在人体上实验不仅没有医学需要和益处,反而增加受试者风险的临床方案也是不符合医学伦理的。
这三个对选择CCR5基因作为编辑对象的批评角度虽然不同,但有一点是共同的,即认为在人类胚胎干细胞中,至少有某些基因序列是不需要或者是不应该被编辑的。那么,能不能把这个问题反过来问:即在人类基因组的近两万个基因中,有没有可以编辑或在临床医学上需要编辑的基因呢?如果有,是些什么(或哪类)基因呢?在什么情形下才应该使用基因编辑技术呢?
胚胎基因编辑有无临床价值?
在过去的30年,医学遗传学有了飞跃性的发展,科学家已经清楚地确定了数以千计的单基因遗传病的致病基因及其序列或表达的变异,相应的遗传病诊断技术和治疗方法也因此得到迅速的发展。
在讨论使用基因编辑技术改变胚胎基因时,遗传病基因是目前被广泛提及或认可的编辑对象,修正这些基因的变异序列被认为是编辑胚胎基因最有潜力而且具体的临床医学应用。这个观点不仅反映在多个专业学会和论坛发布的指导性文件里[3-6],也反映在这个崭新的研究领域中,目前仅有的几篇已经发表的原始研究论文里(绝大多数是中国大陆科学家的论文 [7-12])。这些最早的关于编辑人类胚胎基因的研究虽然主要是探索基因编辑方法在改变体外胚胎基因应用上的技术细节,但都把改正引起遗传疾病的基因缺陷作为进行研究的主要理由。
事实上,除了广州医科大学范勇博士在2016年和贺建奎博士在2018年底公布的工作是改变CCR5基因序列外 [9],其余研究者的工作都是以改正某些单基因遗传病的致病基因缺陷为编辑对象。同样的观点在目前的讨论中也显得非常“主流”,不少评论都说,如果贺建奎不是改“坏”一个好的基因,而是“改好”一个原来就“坏”的基因,他的极端行为或许可以稍被原谅。看来编辑人类基因组中导致遗传病的变异基因序列,是普遍认为可以接受的“编辑对象”,理由是这种改变可以从根本上“消灭”遗传病基因,从而解决遗传病给人类带来的痛苦。
遗憾的是,现有的文献中并没有给这个看似合情合理的观点任何具体的医学实践或需求数据支持,一般只是随机罗列几个常见的遗传病,如囊性纤维化(CF)、亨廷顿氏舞蹈症(HD)、地中海贫血等做为例子,给人以用基因编辑技术在胚胎中修正导致遗传病的变异基因序列,使出生的孩子永远免于这些疾病是个不证自明的未来医学实践上的选择 [3-5]。
如果暂时撇开我们用来判断选择CCR5基因做为胚胎基因编辑对象是否适当的生物学和伦理学两条标准,仅仅从医学实践的角度来看,用基因编辑技术改正人类胚胎细胞中的遗传病基因真的有实际的临床需要吗?在生殖医学和医学遗传学上是否已有效果相当,甚至更好的方法呢?
编辑体外胚胎遗传病基因缺乏临床实际需求
这是本文的一个主要论点,将从以下两个方面论述,请读者同时参考示意图:
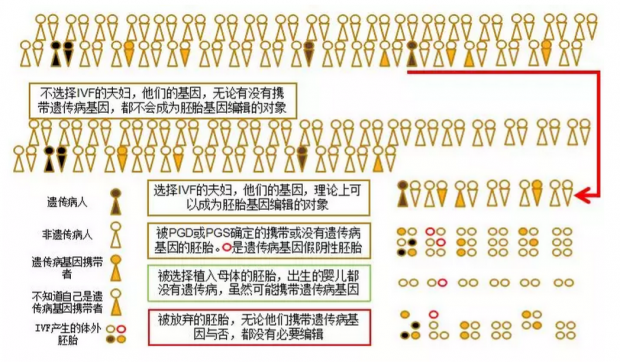
首先,大多数遗传病基因拷贝根本不会进入IVF产生的体外胚胎的“基因池”,而绝大多数进入体外胚胎“基因池”的遗传病基因也不为选择IVF的夫妇或他们的医生所知,因此人类“基因池”中的绝大多数遗传病基因实际上不可能成为基因编辑的对象或目标。
能够考虑使用胚胎基因编辑技术修正遗传病基因的夫妇要满足2个基本条件:
1)携带至少一个拷贝的遗传病基因;
2)选择IVF做为辅助生育的方法。
选择IVF的夫妇在人群中的比例很小。即使在IVF已经相当广泛接受的今天,美国每年出生的四百万婴儿中,也只有1.5%左右是IVF的结果 [1]。绝大部分选择IVF的夫妇并非因为一方或双方是遗传病患者或遗传病基因的携带者,选择IVF一般也不是出于使后代免于遗传病的考虑。当然有少数遗传病的病人,如男性囊性纤维化病人,选择IVF的比例相当高。总之,人类基因池中的遗传病基因只有很小一部分能够主动或随机地出现在由IVF形成的胚胎的基因池中,成为有可能被编辑的候选基因,而大部分遗传病基因或生殖细胞生成过程中产生的突变基因,在人类的生育实践中不会在体外胚胎中出现而有被编辑的可能。
进一步来讲,那些少数随机进入体外胚胎基因池的遗传病基因中的绝大多数虽然在理论上可以被编辑,但实际上也根本没有机会,因为医生或选择IVF的夫妇并不知道他们是这些基因的携带者。比如很多隐性遗传疾病基因的携带者或迟发的显性遗传病病人在生育前往往不知道自己携带有缺陷基因。至于那些在遗传病中相对常见的,由各种自发突变(从一个碱基位点到整条染色体)导致的,先天而非代际遗传的病症(如唐氏综合症),更不是父母们(特别是第一次做父母的夫妇)可以预知而能选择用IVF避免胚胎携带或编辑修正变异基因的了。即使随着DNA测序技术的发展,未来可以检测到每个人基因组中的所有遗传病基因,也不影响下面的结论。
其次,也是关键的一点,在生殖医学和医学遗传学的临床实践上,几乎完全没有必要编辑修正进入胚胎基因池中的遗传病基因。这与基因编辑技术的成熟程度以及是否知道胚胎携带某个遗传病基因无关。
在人类基因组中,每个基因都有两份拷贝(每条常染色体上各一个等位基因拷贝,男性的性染色体上的基因只有一份拷贝),其中一个基因拷贝的变异就可以引起的遗传病为显性遗传病,而需要同一个基因的两个拷贝都为变异序列才致病则为隐性遗传病。所以除非父母都患有同一基因变异导致的隐性遗传病,或至少父母中的一个是两个基因拷贝都有变异的显性遗传病患者这类罕见的情形[注释1],否则遗传基因携带者,无论是否有遗传病,都至少有25%的机会可生育没有该遗传病的后代(或者说,在自然生育的情况下,少数夫妇会有高达75%的几率生育有遗传病的后代)。但这样的夫妇如果选择了IVF(无论出于什么原因),与之联合使用的PDG很容易就能够确定哪些胚胎有遗传病基因,哪些只有正常基因拷贝。如果父母决定选择不会产生遗传病基胚胎,医生就可以把这样的胚胎植入母体,从而把后代患和父母同样的遗传病的风险降到极低(理论上为零),而完全没有必要大费周章地用基因编辑技术来修正一些胚胎携带的遗传病基因。至于原本生育非遗传病的正常后代的几率就高于25%的夫妇(绝大多数情况),用PGD/PDS鉴定不携带某个遗传病基因的胚胎就更容易了。更进一步讲,在体外胚胎中编辑修正遗传病基因,无论未来技术多么成熟(甚至比CRISPR/cas9技术系统更先进的方式),都会对胎儿和母亲增添风险(新增加任何一个医学技术的步骤都会有相应的新风险)。
由此很容易看出:编辑遗传病基因序列与用PGD选择不携带遗传病基因的胚胎相比,前者不仅费时费力,而且没有提供任何后者不能提供的实际优势,还会增加胚胎发育的风险,不仅完全是多此一举,更是有害无益。也就是说,编辑胚胎携带的遗传病基因,并非是基因编辑技术在体外胚胎细胞上最有临床医学需求或潜在价值的应用。
胚胎基因编辑与IVF/PGD的技术理念相悖
如果说前一个论点还偶尔被少数评论简略提及的话 [13-14],基因编辑技术在原则上不适用于编辑(修正)人类胚胎携带的遗传病基因这一观点似乎还没有人论及。下面从三个方面来阐述本文的另一个主要论点:编辑人类胚胎遗传病基因与其必须依靠的IVF/PGD在技术慨念上和应用过程不匹配。
首先,IVF虽然主要是一个辅助生育技术,但与PGD/PGS一起使用,也为人类提供了一个减少遗传病在代际传递的有效手段,使人类对后代的遗传或先天变异性状,从没有出生前选择(只能被动接受出生婴儿有或无遗传病的事实),发展到有“顺序选择”(对胎儿进行检测,决定是否保留有遗传病的胎儿,每次怀孕有一个选择的机会),到有“平行选择”(对多个IVF胚胎在体外同时用PGD/PGS进行选择,甚至可以从在自然条件下的小概率事件中,如只有25%概率生育没有遗传病的后代,也能够选出不会成为遗传病人的胚胎)。因此,PGD/PGS技术是对IVF技术的有力补充和延伸,因为它们可以使上述“平行选择”成为现实。反之,用基因编辑技术在IVF产生的体外胚胎中修正遗传病基因,则忽略了在多个植入母体前的胚胎中可以用PGD对这些胚胎进行精准筛选,并能够选择放弃某些胚胎这一行之有效的“剔除遗传病基因”的机会。也就是说,用基因编辑技术来修正遗传病基因与IVF/PGD联合使用是个技术理念上的“错配”。
对遗传病来说,基因编辑可能适用于临床“治病”应用,而IVF/PGD是“防病”的,即主动放弃会发育成遗传病的体外胚胎,根本不将其植入母体,自然也不会使其发育成婴儿出生。已经有遗传病的病人是需要治疗的,没有其它选择。而IVF产生的体外胚胎,即使携带注定致病的遗传病基因型,也不是病人,完全可以选择放弃,不需要治疗,当然更不需要用会带来额外风险的方法治疗。
我们可以举一个伦理上不恰当但原理上完全相同的例子来说明这个论点。比如一对夫妇希望要一个女孩,如果按照自然生育,他们就要靠运气。如果“运气不好”,可能会连续生几个男孩。有了产前检测,他们可以通过检测,知道胎儿的性别,在胚胎的早期决定堕掉男性胚胎,然后重复自然怀孕—鉴别胎儿性别这个过程,直到确定胎儿是女性,才继续妊娠过程,最终分娩生育。如果他们选择IVF,可以用PGD确定哪个受精卵是女性,选择把女性胚胎植入母体,完成发育生殖的过程。这样在第一次生育就可以生女孩,完全没有必要把原本是男性的胚胎先用基因编辑技术变成女性胚胎。
其次,胚胎基因编辑技术与其必须依靠的IVF/PGD技术在应用过程上也不匹配。如前所述,绝大部分携带遗传病基因的夫妇,不论他们是否为遗传病人,通过IVF产生的胚胎都有一定的概率不会发育成遗传病人。这些胚胎或不携带遗传病基因,或只有一个拷贝的隐性遗传病基因,其基因完全没有必要编辑修正。但由于胚胎基因编辑是在单细胞阶段的受精卵上进行的,无法做PDG/PDS来确定每个受精卵的基因型,医生也就不知道哪些胚胎携带了遗传病基因,哪些没有携带,所以只好“不分青红皂白”,编辑所有的胚胎,等到这些胚胎在体外发育到一百来个细胞的阶段,再取少数细胞做PGD,以确定基因编辑修正是否成功(同时由于使用基因编辑技术可能会对基因组其它序列带来影响,还需要检查预定的编辑位点之外的序列)。这么做的问题是,所有单细胞胚胎都被注射了基因编辑系统,对不携带遗传病基因或不会发育成遗传病人的“好”胚胎不仅完全没有必要,还可能对它们产生负面影响,如“脱靶”等问题带来的风险。
再次,基因编辑技术用于编辑体细胞基因和用于IVF产生的胚胎干细胞时,对技术完善程度的要求不同。对贺建奎使用不成熟的基因编辑技术的批评包括编辑后的基因序列并不都是预想的序列,出生的婴儿为修改和未变基因的嵌合体,有“脱靶”现象,并对其评估不够全面可靠等(这在目前所有的关于胚胎基因编辑的研究中都存在,并非只是贺建奎的实验才有的问题)。这些对编辑技术不成熟的批评虽然反复出现,但似乎很少有人明确指出 1)什么才算是完善或可接受的技术标准; 2)为什么需要完善的技术。
实际上,一个技术的完善与否要根据它的用途来决定。IVF并不完善,即使在已经临床使用40年的今天,单次使用仍有相当高的失败率,但这并不妨碍它的广泛接受和应用。原因之一是IVF失败的代价相对较小,而且IVF可以重复使用,即使失败也不会造成不可逆的损害。同时任何一次IVF的成功对无法自然生育的夫妇带来的益处是巨大的。在这种情形下,技术的不完善是可以被容忍的。同样,编辑体细胞的遗传病基因序列往往也不需要100%的修正,而是可以容忍由于技术原因导致的不完全修正。比如许多隐性遗传病是由于一个基因的两个拷贝的序列变异导致根据该基因转录翻译产生的酶蛋白没有活性。如果基因编辑作为一种治疗手段,只要能够将致病器官的一部分相关细胞的遗传病基因部分修正,病人就能够在关键的器官组织产生一定量的酶活性,使病症不发生或消失,达到治疗的目的。而且这种不完全的修正并非“永久”不可逆的,因为不会遗传给病人的下一代。
编辑胚胎基因的概念则完全不同,如果胚胎基因编辑不完全,或有“脱靶”现象,以后的胚胎在发育时,不仅体内不同的细胞会有不同的基因型的“嵌合现象”,产生嵌合的程度和细胞分布不可控制或预测,而且会因脱靶产生不应该有的新的“异常”DNA序列,还可能遗传给下一代(如果由编辑过的胚胎发育成的个体能够生育的话),这种不完善在编辑有遗传发育全能的胚胎干细胞的基因时就是不可接受的。换句话说,编辑胚胎细胞基因的技术完善程度,原则上应该明显高于编辑体细胞基因的技术要求。实际上,对编辑胚胎基因的高标准不仅仅限于编辑遗传病基因,而是应该适用于编辑任何胚胎基因。CRISPR/cas9基因编辑技术是否最终能在胚胎细胞达到准确无误的“高标准”,目前还不清楚 [15],但在胚胎细胞编辑基因的高技术精度要求与临床基因治疗遗传病的精度要求显然是不匹配的,把具有普遍应用性的基因编辑技术用于编辑胚胎基因这一特定情形是不适当的使用。
人类胚胎基因编辑在临床实践上有害而无益
在本文中,我们讨论了目前对基因编辑技术的一个最貌似合理的临床应用,即修正IVF胚胎携带的遗传病基因的医学价值和其是否适用于编辑胚胎基因这一具体应用。从上面的叙述可以看到,遗传病基因在绝大多数情形下并非胚胎基因编辑技术的合适候选基因,因为编辑数以千计的这类基因不仅没有临床应用的必要或需求,反而增加母亲和胎儿的风险及社会负担。同时,把基因编辑技术用于编辑胚胎遗传病基因,不仅和它必须依赖的IVF/PGD在应用理念和操作过程上冲突,也很可能达不到需要的技术完善标准。用一句话总结:用基因编辑技术在人类胚胎干细胞中修正遗传病基因缺陷是对该技术在一个特定情形中的技术上不匹配,临床医学实践上无益有害的不恰当的应用。
如果几千个单基因遗传病的致病基因不是合适的“候选编辑对象”的话,人类基因组中有没有其它的基因可以作为合适的候选者呢?选择的根据又是什么呢?是否应该真正结合临床医学的实际需要,而不是凭概念或想象,在决定研究项目前充分论证,才下结论呢?
在还没有明确的医学临床应用或理论价值之前,建议政府、科学基金、科学家应该先对是否继续允许和支持现在正在或计划中的那些以改进或完善编辑人类胚胎基因技术的实验室研究(即这一领域中的科学家称作基础或临床前的研究)达成一个共识。至今为止,在进行和人类胚胎基因编辑有关的任何研究(包括那些用捐献的,用不能存活的胚胎进行的“基础研究”,主要是由中国科学家完成的工作)[7-12],除了贺建奎的工作,无一例外都是这类研究。
有人或许会说,虽然目前还没有在医学实践上和伦理上都被认可的用途,但进行一些基础研究,改进完善技术总是没有错吧。任何一个技术或工具,原则上都可以被合理使用和滥用,但只要使用与目的相符,并能够带来明确的益处,即使有滥用带来的危害,这个技术的发展与存在就可以被社会接受。一个无益,不适合特定目的而可能有很大风险的技术是不能随意研发的,因为它越完善,就越方便被拿来做不适当的使用。贺建奎是不是第一个对胚胎基因进行不适当的编辑,并冒天下之大不韪让被编辑的胚胎发育出生的人,没有人敢百分之百肯定,但可以确定的是他不会是最后一个这样做的人。对罔顾伦理或法律的人,更有效防止他们滥用技术的方法可能是根本不给他们方便可用的技术。现在对人类胚胎基因编辑讨论的关键不是如何防止滥用,更不是如何改进技术,而是要明确这一技术应用的“利”(临床需要和基础科学意义)和“理”(技术或工具与使用目的是否相匹配),只有完成了这些方面的充分论证,才可能决定是否原谅该技术带来的“弊”,以及能否完善基因编辑这个革命性的技术对胚胎基因这一特定情形的应用。
注释1:即使出现这些或其它罕见情形,现在医学时间也可以为病人提供多种方案,编辑胚胎基因并非唯一的,普世的或最佳的选择。限于篇幅,不在此论述。
致谢:本文在撰稿过程中得到陈红,陈琦,William Gahl,李小韦,刘滨,印螺,赵海青,周丹博士的指教和帮助,特此致谢。
作者简介
陈达维,分子药理学博士,曾在多家跨国药企负责临床肿瘤药物开发精准医学工作,现居美国新泽西。
参考文献
[1] Niederberger C, Pellicer A, Cohen J. Forty years of IVF [J]. Fertility and Sterility 2018,110:185-324
[2] Harvey J. Stern HJ. Preimplantation genetic diagnosis: prenatal testing for embryos finally achieving its potential [J]. J. Clin. Med. 2014, 3, 280-309
[3] Baltimore D, Berg P, Botchan M, et al.: Biotechnology. A prudent path forward for genomic engineering and germline gene modification [J]. Science 2015, 348:36-38.
[4] Ormond KE, Mortlock DP, et al. Human germline genome editing [J]. American Journal of Human Genetics 2017, 101,167–176.
[5] ACMG Board of Directors. Genome editing in clinical genetics: points to consider—a statement of the American College of Medical Genetics and Genomics [J] Genetics in medicine 2017, 19:723-4
[6] Munsie1M, Gyngell C. Ethical issues in genetic modification and why application matters [J]. Current opinion in genetics & development. 2018, 52:7–12
[7] Liang P, Xu Y, Zhang X, Ding C, Huang R, Zhang Z, et al. CRISPR/Cas9–mediated gene editing in human tripronuclear zygotes [J]. Protein Cell 2015, 6:363–72.
[8] Liang P, Ding C, Sun H, et al.Correction of b-thalassemia mutant by base editor in human embryos. ProteinCell 2017, 8, 811–22.
[9] Kang X, He W, Huang Y, Yu Q, Chen Y, Gao X, et al. Introducing precise genetic modifications into human 3PN embryos by CRISPR/Cas–mediated genome editing [J]. J AssistReprod Genet 2016, 33:581–8.
[10] Tang L, ZengY, Du H, Gong M, Peng J, Zhang B, et al. CRISPR/Cas9–mediated gene editing in human zygotes using Cas9 protein [J]. Mol Genet Genomics 2017, 292:525–33.
[11] Zeng Y, Li J, Li G, et al. Correction of the Marfan Syndrome pathogenic FBN1 mutation by base editing in human cells and heterozygous embryos [J] Mol Therapy 2018, 26:2631-7
[12] Ma H, Marti-Gutierrez N, Park S-W, Wu J, Lee Y, Suzuki K, et al. Correction of a pathogenic gene mutation in human embryos [J].Nature 2017, 548:413–9.
[13] Vassena1 R, Heindryckx B, Peco R, et al. Genome engineering through CRISPR/Cas9 technology in the human germline and pluripotent stem cells [J]. Human Reproduction Update. 2016, 22:411–419.
[14] 杨辉团队。基因编辑技术用于临床,任重道远。知识分子 2018,11/29.
[15] Reyes AP, Lanner F. Towards a CRISPR view of early human development: applications, limitations and ethical concerns of genome editing in human embryos [J] Development 2017, 144: 3-7;
话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。




 京公网安备 11010502034662号
京公网安备 11010502034662号 