阅读:0
听报道

撰文 | 黄宇翔 责编 | 陈晓雪
许多严重的疾病来自基因突变,因此基因编辑技术的进步为脊髓性肌营养不良、地中海贫血、视网膜黄斑变性等遗传性疾病患者带来了希望。[1]
但是,在将体细胞基因编辑技术向临床推进、造福患者的道路上,研究者对技术潜在的安全性问题必须小心谨慎,在临床试验以前对风险做充分的评估。脱靶效应始终是悬挂在利用基因编辑技术进行疾病治疗头上的 “达摩克利斯之剑”。
基因编辑技术的脱靶效应又可以细分为基因组和转录组两个层面,此前的大量研究都关注于基因编辑技术在基因组层面对于DNA的脱靶效应分析。[1-3]
2019年6月10日,《自然》杂志上线的一篇论文显示,中国科学家对于单碱基编辑技术(在CRISPR/Cas9 基础上开发的一类基因编辑技术)在 mRNA 水平上的脱靶效应进行了全面细致的分析。研究者发现,即使目前领域内最先进的单碱基编辑工具 BE3 和ABE7. 10,也都存在不容忽视的 mRNA 脱靶效应。他们通过引入点突变的方法,对现有的单碱基编辑工具进行了改良,获得了 mRNA 脱靶率较低的单碱基编辑工具。这一具有更高精度的工具,将为未来单碱基编辑工具应用于临床治疗打下坚实的基础。[4]
本研究由中国科学院神经科学研究所、脑科学与智能技术卓越创新中心杨团队,四川大学华西二院、生命科学学院郭帆团队和中国科学院-马普学会计算生物学伙伴研究所研究员李亦学团队共同完成。
研究者以 HEK293T 细胞系为模型开展本项研究。通过对混合细胞和单细胞转录本进行测序分析,研究者发现表达单碱基编辑工具BE3和ABE7. 10都会显著提升 mRNA 中突变的数目。对所引发的突变序列进行分析,研究者发现这些突变在一些原癌基因和抑癌基因中富集程度比较高,这意味着未来的研究者在试图将单碱基编辑技术应用于临床时,需要对该技术诱发癌症的风险进行评估。[4]
为了降低现有工具的 mRNA 脱靶率,研究者通过突变优化和尝试人源结构域的方法,获得了具有高DNA编辑效率、低RNA脱靶率的BE3W90A、BE3 (hA3AR128A)、BE3 (hA3AY130F)、ABE7. 10F148A等优化版单碱基编辑工具。这些新工具能将检测到的RNA突变率降低到与阴性对照相近的水平,其表现超过了此领域领军科学家David Liu团队和Keith Joung团队为降低mRNA脱靶率而独立开发的优化版本。[4-6]
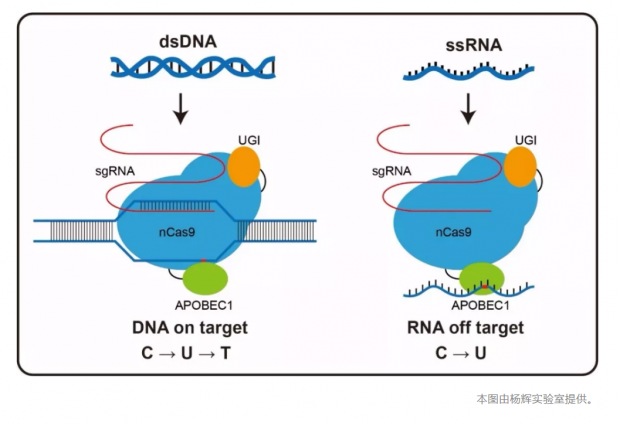
不同于构成基因组的 DNA,mRNA 在细胞中存在很多个拷贝,那为什么少数一些mRNA的异常会引起研究者如此高度的重视?“RNA的脱靶效应会影响正常细胞的功能。” 该项研究的通讯作者之一杨辉告诉《知识分子》。“如果长期造成RNA的脱靶效应,比如在AAV(腺相关病毒)介导的成体基因治疗中”,细胞内RNA的突变会影响细胞的正常生长,甚至可能会有致癌风险。[7-9]
参考文献:
[1] Reeset al., (2018) Base editing: precision chemistry on the genome and transcriptome of living cells. Nature Reviews Genetics. DOI: 10.1038/s41576-018-0059-1
[2]Zuo, E. et al., (2019) Cytosine base editor generates substantial off-target single-nucleotide variants in mouse embryos. Science, DOI:10.1126/science.aav9973
[3]Jin,S. et al., (2019) Cytosine, but not adenine, base editors induce genome-wide off-target mutations in rice. Science, DOI:10.1126/science.aaw7166
[4] Zhou et al., (2019) Off-target RNA mutation induced by DNA base editing and its elimination by mutagenesis. Nature.
[5] Grünewaldet al., (2019) Transcriptome-wide off-target RNA editing induced byCRISPR-guided DNA base editors. Nature. DOI: 10.1038/s41586-019-1161-z
[6] Reeset al., (2019) Analysis and minimization of cellular RNA editing by DNA adenine base editors. Science Advance. DOI: 10.1126/sciadv.aax5717
[7]Villiger, L. et al., (2018) Treatment of a metabolic liver disease by in vivo genome base editing in adult mice. Nat Med. DOI:10.1038/s41591-018-0209-1
[8]Rossidis, A. C. et al., (2018) In utero CRISPR-mediated therapeutic editing of metabolic genes. Nat Med. DOI:10.1038/s41591-018-0184-6
[9]Maeder, M. L. et al., (2019) Development of a gene-editing approach to restore vision loss in Leber congenital amaurosis type 10. Nat Med. DOI:10.1038/s41591-018-0327-9
话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。




 京公网安备 11010502034662号
京公网安备 11010502034662号 