阅读:0
听报道
撰文 | 计永胜 责编 | 陈晓雪
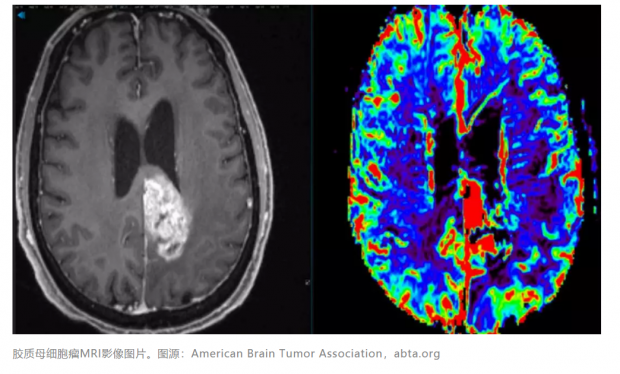
胶质母细胞瘤(Glioblastoma,GBM),是一种原发性脑部肿瘤,死亡率极高,治愈率偏低,治疗预后差,易复发,是最难治疗的肿瘤之一(图1)。
最近,德国癌症研究中心的一个研究,增进了我们对胶质母细胞瘤容易复发的机制的了解。
2019年7月11日,《细胞·干细胞》(Cell Stem Cell)杂志在线发表了德国癌症研究中心研究员刘海坤团队的研究。该团队鉴定出一种对胶质母细胞瘤复发起重要作用的特异分子标志3-磷酸甘油脱氢酶1(glycerol-3-phosphate dehydrogenase 1,GPD1)[1]。
“GPD1传统上被认为是帮助细胞抵御环境压力的蛋白。我们的研究说明休眠的癌症干细胞利用了这个细胞代谢机制来保证自己在复杂的肿瘤环境中得以生存并抵抗化疗。”文章通讯作者刘海坤接受《知识分子》采访时表示,“寻找靶向GPD1药物的工作也在顺利进行,GPD1靶向药也可能成为临床检验‘癌症干细胞’这个概念的重要工具。”
发现肿瘤复发的关键
近些年来,基因组技术的发展极大提升了胶质母细胞瘤的分子诊断能力,但这并没有因此改变临床处理胶质母细胞瘤的手段,当前治疗胶质母细胞瘤最好的方法仍然是手术切除联合术后放化疗。
不过,由于胶质母细胞瘤与正常组织界线不清晰,上述方法容易造成正常脑组织损伤。同时,胶质母细胞瘤的始作俑者脑瘤干细胞(Brain Tumor Stem Cells,BTSC)对化疗药物(如替莫唑胺)有抗性。
要想对胶质母细胞瘤“斩草除根”,我们必须将BTSC与正常的细胞(主要是神经干细胞)区分开,再设计药物专门清除BTSC。因此,寻找BTSC特异的、对BTSC的生长代谢所必需的的生物标记显得尤为重要。
之前也有研究团队发现了一些BTSC的分子标记,如CD133、OLIG2等。但这些分子缺乏特异性,在正常神经干细胞(NSCs)也有表达。
在本研究中,科研人员通过核糖体印记测序(Ribosome profiling)等方式检测了BTSC与NSCs在蛋白水平上的差异后发现,GPD1 只在 BTSC 特异表达。
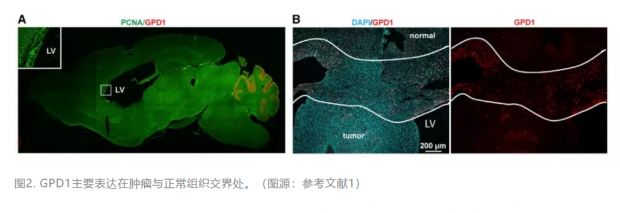
分子定位结果显示,GPD1主要表达在肿瘤与正常组织交界处的BTSC(图2)。这个部位正是BTSC与正常细胞“混搭”的区域:手术切除不彻底,放化疗又易误伤正常细胞。
追根溯源,研究人员发现,GPD1在肿瘤形成起始就开始表达,在肿瘤完全形成后GPD1阳性细胞处于休眠状态;当化疗结束,表达GPD1的细胞又一次活化分裂,使肿瘤复发。
一个有吸引力的新治疗靶点
既然GPD1表达如此特异,它的功能如何?刘海坤和同事继续追问。
科研人员通过代谢组学分析发现,GPD1的特异表达确实使BTSC拥有一种与正常神经干细胞迥异的代谢状态,BTSC缺失Gpd1基因后其蛋白翻译、细胞增殖分化以及细胞粘附信号也发生深刻变化。这些通路均与BTSC存活和保持干细胞特性相关。在动物实验中,科研人员人为将罹患肿瘤的小鼠的Gpd1基因表达水平降低后发现,肿瘤的生长速度变慢,动物的存活时间延长。
小鼠身上表现不错,GPD1在人的肿瘤组织又是怎样的表达情况呢?
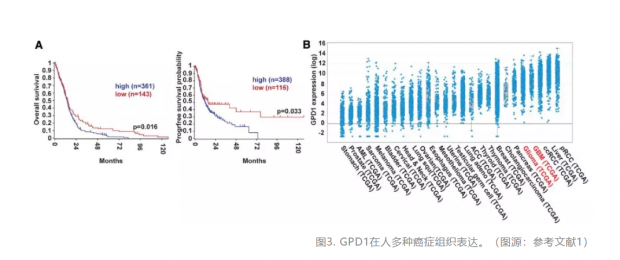
研究人员通过分析癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库的信息后发现,GPD1同样在人胶质母细胞瘤中高表达,并且其表达水平与肿瘤治疗的不良预后呈现正相关性。如果在人的脑瘤干细胞里特异抑制GPD1,人的脑瘤干细胞会失去干细胞特性,说明人的脑瘤干细胞也需要GPD1来维持。更重要的是,GPD1还在包括肾细胞癌、肝癌、肺癌、乳腺癌等多种癌症组织中表达(图3)。
值得一提的是,GPD1是人体脂类代谢过程的一个酶,在肝脏、肾脏、胰腺、结肠和肌肉等组织也高表达,但人体Gpd1基因突变只会引起短暂的婴儿高甘油三酯血症,并且症状随年龄增长逐渐消失。
文章最后指出,GPD1在BTSC的特异性表达可以降低针对该分子的药物在治疗胶质母细胞瘤过程中产生的副作用。而人GPD1的蛋白结构和底物结合位点已经被明确 [3](图4),因此,“GPD1是一个针对胶质母细胞瘤的有吸引力的新治疗靶点”。
当然,刘海坤和同事对GPD1的研究并未就此结束。刘海坤告诉《知识分子》,“我们对GDP1如何在休眠癌症干细胞里被诱导表达机制很感兴趣”,这将是他们未来研究的重点。
“刘海坤研究团队发现GPD1特异表达于神经胶质瘤干细胞,而不表达于正常神经干细胞,为开发特异针对神经胶质瘤干细胞的药物提供了非常有价值依据。”美国斯隆凯特琳纪念医院癌症研究所施裕丰博士(Yufeng Shi)评论说。
他同时表示,“本研究中的结果并不排除有不依赖GPD1的神经胶质瘤干细胞存在的可能性,这一点可以从抑制GPD1后有限地提高神经胶质瘤老鼠生存率看到端倪。”
参考文献:
[1] Patricia Rusu, Chunxuan Shao, Anna Neuerburg, et al., GPD1 specificallymarks dormant glioma stem cells with a distinct metabolic profile. Cell StemCell, (2019). https://doi.org/10.1016/j.stem.2019.06.004
[2]https://www.ebi.ac.uk/pdbe/static/entry/1wpq_deposited_chemically_distinct_molecules_side_image-800x800.png
[3] Ou, X., Ji, C., Han, X., et al,. (2006). Crystal structures of humanglycerol 3-phosphate dehydrogenase 1 (GPD1). J Mol Biol 357, 858-869.。

话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。



 京公网安备 11010502034662号
京公网安备 11010502034662号 