阅读:0
听报道
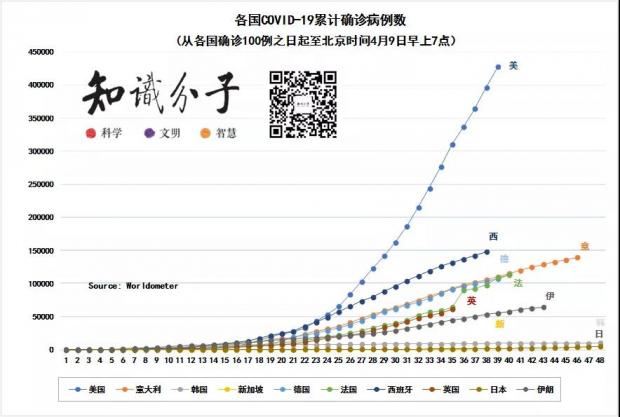
截至北京时间4月9日7时,美国新冠肺炎确诊病例数超42万,全球新冠肺炎累计确诊病例数超150万,其中死亡病例数超8万。制图:知识分子(数据来源:worldometers)
撰文 | 计永胜 责编 | 陈晓雪
新冠肺炎疫情(COVID-19)出现以来,全世界的科研机构都在筛选抗新冠病毒药物,启动相关的临床试验。不过,现在还没有任何药物经严格论证对新冠肺炎治疗效果突出,包括大家寄予厚望的瑞德西韦仍处在临床试验阶段。
当然,也有一些研究团队可能对自己的前期临床试验结果过于乐观,“迫不及待”地将其公布于众。
但有一句古话:欲速则不达。
法国艾克斯-马赛大学(Aix Marseille University)迪迪埃·拉乌尔(Didier Raoult)团队在3月16日向国际抗微生物化学治疗学会(International Society of Antimicrobial Chemotherapy,ISAC)官方期刊 International Journal of Antimicrobial Agents(IJAA)投稿一篇题目为Hydroxychloroquine and azithromycin as a treatment of COVID-19:results of an open-label non-randomized clinical trial 的文章。该文章在24小时后被接收,3月20日在线发表,堪称神速!

该文章声称,经单一羟氯喹治疗(硫酸羟氯喹,200mg/次,一日3次)6天后,70%的新冠肺炎患者体内的病毒载量明显下降;6例羟氯喹/阿奇霉素联合治疗的患者核酸检测全部转阴 [1]。
近乎完美的试验结果立刻引起了媒体的关注。美国总统特朗普也通过社交平台引用该论文力推羟氯喹。

但4月3日,ISAC主席安德雷斯·沃斯(Andreas Voss)在其官网发表声明称,ISAC委员会认为(迪迪埃·拉乌尔团队的)论文没有达到学会期待的标准,尤其是在对临床试验参与患者的纳入标准以及通过分组治疗确保患者安全方面缺乏明确的解释 [2]。“尽管学会认为通过快速发布新数据来帮助科学界很重要,但这不能以减少科学的审查和专业规范为代价。” 沃斯表示。该声明还对网络上关于对该论文评审程序的质疑进行了回应。

其实,该论文自上线发表之日起就饱受争议。该临床试验的病人纳入标准只有两点:年龄大于12岁;病毒核酸检测阳性。最终仅有42人参与,36人(治疗组20人,对照组16人)完成6天(截止到文章撰写)试验。而接受羟氯喹/阿奇霉素联合治疗的患者仅有6人。这样看来,参与试验的患者人数实在太少,统计意义不大。
致力于学术诚信的分子生物学家伊丽莎白·比克(Elisabeth Bik)也通过其博客 Science Integrity Digest 列举了论文存在的问题,主要包括[3]:
治疗组和对照组患者在年龄、病情、治疗地点等方面差异较大。
伦理学问题。该论文方法部分显示,临床试验获得伦理学认证是在3月5日和6日,试验时长14天,而论文投稿日期是3月16日。作者虽在讨论部分提到论文呈现的是前期结果,但方法部分并没有具体描述。
同行评阅速度过快。论文从投稿到接受仅24小时,并且论文共同作者Jean-Marc Rolain为IJAA杂志主编。(对此,ISAC在4月3日的声明中称,论文审稿由副主编处理,Rolain并未参与审稿,符合学术期刊同行评阅规范。)
治疗组6人“掉队”问题。治疗组起始人数本来就不多(26人),竟有约四分之一患者(6人)中途终止羟氯喹治疗,没有被纳入统计范围。
有评论在社交平台讽刺该论文,“如果把治疗期间的死亡病例和治疗无效病例去除的话,我们的试验结果看起来惊人(得好)。”
美国FDA前局长斯科特·戈特利布(Scott Gottlieb)也在社交媒体表示,如果这两种药物组合起作用的话,那么作用机制可能比较微妙,需要更大规模的临床试验才能证实 [4]。
钟南山院士在接受深圳卫视《深视新闻》采访时表示,羟氯喹+阿奇霉素从理论上,以及实践上(得到验证)都需要更多的时间。现在不太适合,还没有任何结果就把它推广使用。
目前,该论文仍处在 pre-proof(未校样)阶段,可从IJAA网站下载,该论文是否会被撤稿还不清楚。
此前有体外实验表明,氯喹具有明显的抗 SARS-CoV-2 作用,但由于缺乏确凿的临床试验数据,氯喹及其衍生物(包括羟氯喹)对 COVID-19 患者的实际治疗效果一直备受争议。除迪迪埃·拉乌尔团队前期临床结果外,武汉大学人民医院张旃团队联合中国科学院武汉病毒研究所通过预印本平台 medRxiv 公布的随机临床试验结果显示,羟氯喹可以显著缩短COVID-19 非重症患者的临床康复时间并促进肺炎的吸收 [5]。两项研究均存在一个短板:参与试验的患者人数明显不足。
为了验证羟氯喹的效果,美国明尼苏达大学的传染病家大卫·博尔韦尔(David Boulware)已经注册并开展了两项随机双盲临床试验,第一项是面向暴露于新冠病毒的医护人员和容易感染新冠病毒的高危人群招募1500人,以验证羟氯喹能否预防新冠病毒感染;第二项是在没有住院的确诊感染者中招募1500人,以验证羟氯喹能否预防住院并减轻症状的严重性。该研究预计在5月中旬结束 [6]。
目前,中国国家卫健委印发的《新型冠状病毒肺炎诊疗方案》允许使用磷酸氯喹治疗新冠肺炎。美国FDA也已经通过紧急授权(Emergency Use Authorization)的形式允许医师在必要的时刻将硫酸羟氯喹和磷酸氯喹应用于临床。但正如《科学》杂志4月7日发表的文章称,一些美国FDA前官员对该项紧急授权持批评态度。美国科学促进会(AAAS)前主席、FDA前局长玛格丽特·汉贝格(Margaret Hamburg)指出,关于氯喹和羟氯喹的实际临床治疗效果本可以在几周内评估完毕,但启用紧急授权使得这项工作更加困难,“药物的大规模使用会干扰研究人员获得必要数据的能力” [4]。
参考文献
[1]Philippe Gautret, Jean-Christophe Lagier, Philippe Parola, et al. Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open-label non-randomized clinical trial, International Journal of Antimicrobial Agents (2020), doi: https://doi.org/10.1016/j.ijantimicag.2020.105949
[2]https://www.isac.world/
[3]https://scienceintegritydigest.com/2020/03/24/thoughts-on-the-gautret-et-al-paper-about-hydroxychloroquine-and-azithromycin-treatment-of-covid-19-infections/.
[4]https://www.sciencemag.org/news/2020/04/former-fda-leaders-decry-emergency-authorization-malaria-drugs-coronavirus#
[5]Zhaowei Chen, Jijia Hu, Zongwei Zhang, et al. Efficacy of hydroxychloroquine in patients with COVID-19: results of a randomized clinical trial. https://doi.org/10.1101/2020.03.22.20040758.
[6]https://med.umn.edu/news-events/u-m-covid-19-clinical-trial-expands-participant-enrollment-opportunities

话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。



 京公网安备 11010502034662号
京公网安备 11010502034662号 