阅读:0
听报道

图源:Pixabay
撰文丨蛋炒饭
责编丨戴 威
随着生命科学与医学的发展,基因治疗逐渐走进人们的视野。基因治疗主要是针对那些难以用化学药物根治的、对人类健康存在威胁的疾病,包括遗传病(如脊肌萎缩症、地中海贫血症)、恶性肿瘤、心血管疾病、阿尔茨海默症与免疫缺陷等。
目前,许多体内基因治疗的方法都是以腺相关病毒(AAV)为载体。腺相关病毒是一种结构简单的单链DNA缺陷型病毒,通常需要辅助病毒的帮助才能复制。基因治疗通常将腺相关病毒内部编码病毒蛋白的DNA删掉,然后治疗性的转基因或基因编辑工具包装进腺相关病毒,随后通过病毒将之递送至患者靶细胞内最终进入细胞核,取而代之的是治疗性转基因,从而实现基因治疗。
虽然AAV在应用于基因治疗时具有诸多优点,但在治疗神经系统遗传疾病时有潜在的致病性,会导致新的问题。已有的研究表明,无论是将AAV载体通过静脉注射入猪的血液中 [1],还是将其通过小脑延髓池穿刺(ICM)注入非人灵长类动物的脑脊液中 [2,3],都会对动物的背根神经节(DRG)产生严重毒性,这种毒性会导致神经退行性疾病,严重时甚至可产生共济失调症。
针对此问题,来自美国宾夕法尼亚大学的詹姆斯·M·威尔森(James M·Wilson)教授开发出一种新的方法,避免在使用AAV作为载体治疗此类疾病时对背根神经节的毒性。该方法于11月11日发表在《科学-转化医学》(Science Translational Medicine)杂志上 [4]。
01 为什么AAV载体对背根神经节有毒?
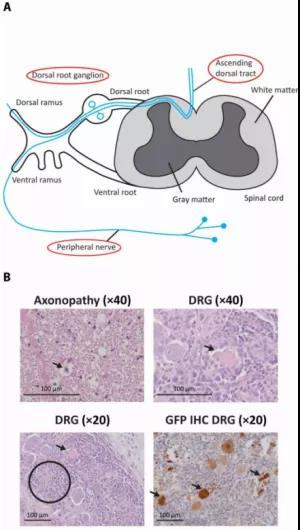
图1. 小脑延髓池穿刺注射AAV后,可在非人灵长类中引发背根神经节毒性与继发的轴突病变。图源:[4]
我们先来了解一下背根神经节为什么会因AAV载体 “中毒”。背根神经节是一种聚集在脊髓外侧的感觉神经元(图1.A),对AAV载体有着特殊的亲和力。因此,这些神经细胞被过多AAV载体转导后会进行超负荷的转录和蛋白合成,导致细胞应激,使卫星细胞反应性增殖并分泌细胞因子,继而吸引淋巴细胞,这一连串反应最终会导致细胞死亡(图2)。
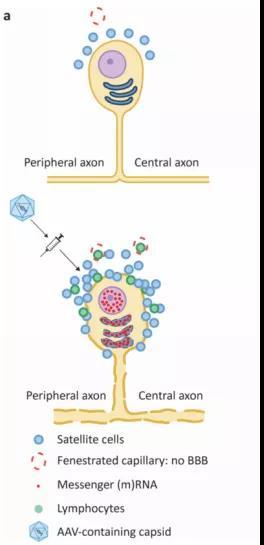
图2. AAV蛋白过表达介导的背根神经节毒性模型。图源:[4]
“随着我们在基因治疗领域的不断进步,尤其是在治疗非致命性疾病方面的进步,我们会有一些安全顾虑,而这些安全顾虑将超过通过治疗收获的益处”,本研究的通讯作者威尔森说。[5]
虽然药物可以减轻机体对AAV载体和转基因产物的免疫反应,但并无法消除其对背根神经节的毒性和轴突病变 [2,3]。那么,是否可以通过某种方法来使这种情况得到改善呢?
为此,威尔森团队设计了一种新的方法,从而大大降低AAV载体对这种神经细胞的毒性。
02 既然超负荷转录有毒,那就让AAV载体别表达了
结合早期尝试与对各种方法的评估,作者最终选定了以下方案:让背根神经节中的AAV载体沉默。
怎么才能让背根神经节精准识别出AAV载体并阻止其表达呢?研究者决定在AAV载体中插入的特殊基因片段。我们知道,当一般的编码DNA想行使其功能时,会先转录为单链mRNA(信使RNA),才能被翻译为蛋白质。不过,miRNA(微小RNA)可以与其互补配对的mRNA的特定区域特异性结合,这样一来,mRNA就形成了部分双链,而这样的mRNA会被机体降解掉,从而阻止其继续翻译成蛋白质。
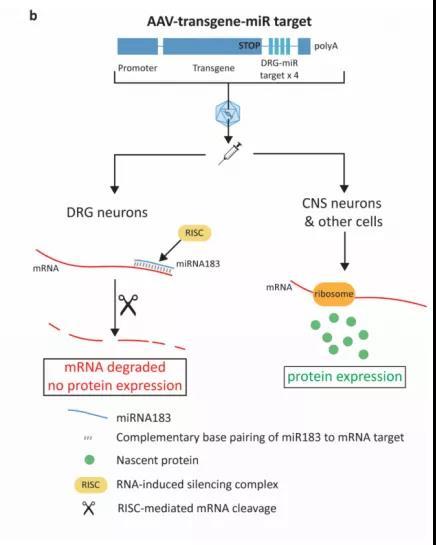
图3. 在载体中插入特异性miRNA靶序列可对蛋白过表达进行沉默。图源:[4]
因此,研究团队在转基因的终止密码子和poly-A尾之间插入与背根神经节中特有miRNA反向互补的四个重复序列(图3)。如此一来,当AAV携带的转基因转录为mRNA,如果miRNA找到链条中与其互补的序列并与之结合,基因表达就终止了。四个重复序列可以增加其与背根神经节中特异miRNA结合的概率,继而加强其抑制效率,组成一个用于在背根神经节中沉默AAV的表达盒(expression cassette)。这样的表达盒不仅可以通过miRNA的特异性识别来沉默转基因在背根神经节中的表达,而且在其它不表达特异性miRNA的细胞类型中,蛋白质合成也不会受到影响。
作者最终选择了一个在背根神经节中特异性很高的 miRNA183(简称miR183)的反向重复序列作为表达盒的插入序列。
表达盒设计好了,它的疗效如何呢?
03 插入新片段的AAV载体,基因治疗效果如何?
研究团队首先用恒河猴测试了在AAV载体加入特定片段后,是否会减轻对背根神经节的毒性。通过小脑延髓池穿刺,研究人员将表达GFP(绿色荧光蛋白)或 GFP-miR183 的AAV载体注射进成年恒河猴体内,在第14天对半数动物进行尸检,检测GFP的表达量;在第60天处死剩余动物,评估GFP的表达量与背根神经节毒性。并且,猴子们在接受AAV注射后,均没有证据表明其获得神经性头痛等临床后遗症。
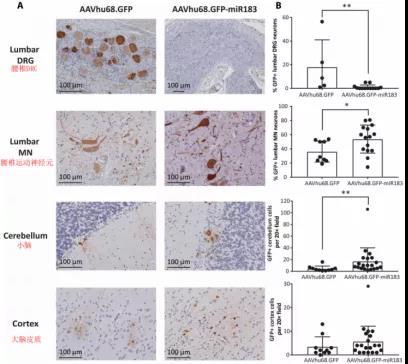
图4. miR183靶位点的插入特异性沉默了背根神经节中GFP的表达。图源:[4]
结果如图4所示,含有miR183靶标的改造载体与对照载体相比,荧光蛋白的表达量在背根神经节中显著降低,而在腰椎运动神经元和小脑中显著提高,在大脑皮质中则无明显变化。这些现象意味着,含有miR183靶序列载体的蛋白表达仅在背根神经节中受到了抑制,而在其它神经组织中并未受到抑制。并且当载体中不含有miR183靶位点时,所有区域都存在病理现象。
之后,研究团队测试了加入特定序列后,AAV载体的基因治疗效果如何。作者使用了表达hIDUA的载体进一步评估了在非人灵长类中miR183靶序列的作用。hIDUA是黏多糖病I型患者体内缺乏的酶,有关这一基因的研究首次报道了非人灵长类中的背根神经节毒性 [3]。
实验分为三组,第一组动物仅注射表达hIDUA的载体;第二组在第一组的基础上加入类固醇药物进行治疗;第三组在表达hIDUA的载体中整合入miR183靶序列。在第90天处死所有动物,评估hIDUA的表达量与背根神经节毒性。
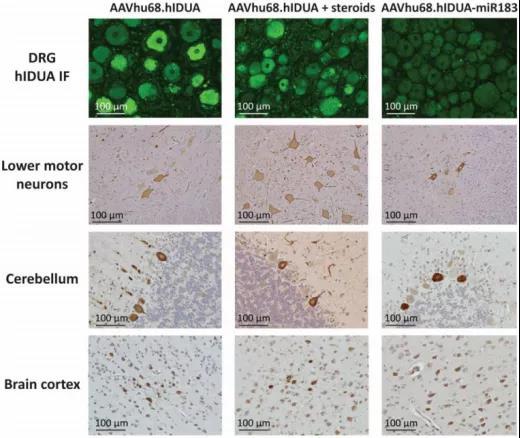
图5. miR183靶位点的插入特异性沉默了背根神经节中hIDUA的表达。图源:[4]
结果显示,在第一组和第二组的背根神经节中检测到hIDUA的高表达量,在其中枢神经系统的其它区域检测到低至中度的hIDUA表达。而在第三组中,将miR183靶序列整合入载体后,不仅阻断了背根神经节中hIDUA蛋白的表达,且中枢神经系统中hIDUA蛋白的表达量没有降低。第三组动物在背根神经节、脊柱和周围神经区域完全没有出现病理现象,而第一组和第二组动物则恰恰相反、存在病理现象。
以上数据与现象共同说明,研究团队开发的方法可以在非人灵长类中减轻基因治疗过程中AAV载体诱导的背根神经节毒性,并且在此基础上不会降低基因治疗的效果。
04 技术已授权,或有助于临床治疗
“我们能够在保证病毒载体效力的情况下降低或消除其背根神经节毒性”,威尔森说,“基因治疗目前正在对21种不同的疾病进行临床试验,另有122种疾病正在进行临床前研究。在这21种正在进行临床试验的治疗中,有14种可能具有背根神经节毒性,而这种改良的AAV载体可能会使该现象有所改善。” [5]
威尔森的研究小组已经同意将这项技术授权给五家基因治疗公司,并正在与另外五家公司进行谈判。这种改良技术目前并未应用于临床,但作者说他希望明年就能实现对此技术的临床应用。
“这项研究使AAV基因治疗向临床应用迈出重要的一步。” 来自南安普顿大学神经再生领域的科学家梅利莎·安德鲁斯(Melissa Andrews)这样评论该研究,“这种方法看起来并不会降低基因治疗的疗效,而且作为一种更为安全的治疗措施,它将受到临床治疗的欢迎。” [5]
参考资料:
[1]C. Hinderer, N. Katz, E. L. Buza, C. Dyer, T. Goode, P. Bell, L. K. Richman, J. M. Wilson.(2018).Severe toxicity in nonhuman primates and piglets following high-dose intravenous administration of an adeno-associated virus vector expressing human SMN. Hum. Gene Ther. 29, 285–298.
[2]J. Hordeaux, C. Hinderer, T. Goode, E. L. Buza, P. Bell, R. Calcedo, L. K. Richman, J. M. Wilson.(2018).Toxicology study of intra-cisterna magna adeno-associated virus 9 expressing iduronate-2-sulfatase in rhesus macaques. Mol. Ther. Methods Clin. Dev. 10, 68–78.
[3]J. Hordeaux, C. Hinderer, T. Goode, N. Katz, E. L. Buza, P. Bell, R. Calcedo, L. K. Richman, J. M. Wilson.(2018).Toxicology study of intra-cisterna magna adeno-associated virus 9 expressing human alpha-L-iduronidase in rhesus macaques. Mol. Ther. Methods Clin. Dev.10, 79–88.
[4]Juliette Hordeaux, Elizabeth L. Buza, Brianne Jeffrey, Chunjuan Song, Tahsin Jahan, Yuan Yuan, Yanqing Zhu, Peter Bell, Mingyao Li, Jessica A. Chichester, Roberto Calcedo, James M. Wilson.(2020).MicroRNA-mediated inhibition of transgene expression reduces dorsal root ganglion toxicity by AAV vectors in primates. Sci. Transl. Med.12, eaba9188
[5]https://www.statnews.com/2020/11/11/gene-therapy-james-wilson-nerve-aav/
话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。



 京公网安备 11010502034662号
京公网安备 11010502034662号 