阅读:0
听报道
pixabay.com
撰文 | 戴 威 汤佩兰
责编 | 陈晓雪
当地时间12月11日,美国食品药品监督管理局(FDA)批准授权辉瑞-BioNTech新冠疫苗在16岁及以上人群中紧急使用。[1] 预计下周开始接种。
新冠疫苗的审批,对于缓解美国当前的疫情无疑是个极大的好消息。“我们可能会看到人们在下周一、周二开始接种疫苗。”美国卫生部长阿里克斯·阿扎尔(Alex Azar)表示,到明年1月底,有5000万美国人能打上疫苗。[2]
在美国监管机构作出决定前一天,12月10日,FDA召开了外部专家会议,对是否给与辉瑞-BioNTech疫苗紧急使用授权开会讨论,该讨论过程在网上进行了直播。最终,22名专家以17人同意、4人反对、1人弃权的投票结果,建议辉瑞疫苗在16岁及以上人群中紧急使用。[3]
这款mRNA新冠疫苗,由美国医药巨头辉瑞与德国生物公司BioNTech联合研发。该疫苗使用的是在体外合成的编码新冠病毒突刺蛋白的mRNA。这个mRNA被导入人体细胞后将被翻译成蛋白,进而激活人体的免疫反应,产生针对新冠病毒刺突蛋白的抗体和T 细胞。该疫苗分两次注射,第一针和第二针之间间隔三周。
相较于传统疫苗,mRNA疫苗可在实验室合成,无需在鸡蛋中培养病毒的时间和厂房,但保存条件严苛。mRNA是人体内指导蛋白质合成的临时性产物,因此并不稳定,这款辉瑞疫苗需储存于-70℃超低温下,且在使用前只能在冷链内移动四次。[5] 一旦解冻,疫苗可以在2到8℃的普通冰箱中保存5天。[10]
根据辉瑞在其官网发布的分析数据,在受试者超过43000人的三期临床试验中,辉瑞-BioNTech疫苗整体有效率达到95%,其中对65岁以上老人的有效率也高达94%。[4]
11月20日,辉瑞和BioNTech向美国FDA申请了紧急使用授权(Emergency Use Authorization,EUA)。
1 紧急使用后 安全性和适用人群问题将持续受关注
需要注意的是,对于辉瑞和BioNTech联合研发的这款疫苗,美国监管机构审批的是紧急使用授权。
FDA紧急使用授权是对诊断试剂、医疗设备、药物等其他医疗用品在公共卫生紧急情况下的使用许可。出于需求紧迫,FDA在没有时间等待足够充分的证据且没有其他选择的情况下,会根据现有材料衡量该医疗用品的已知和潜在的风险及益处,并给出“紧急使用授权”。[8]
“这是人们快速获得疫苗和药物的一种途径,通过这种途径可以更快地做出这些决定。”约翰霍普金斯健康安全中心的传染病专家阿米什·奥德加(Amesh A. Adalja)在接受美国媒体《健康生活》(Healthy Living )采访时表示。他介绍,在早前应对H1N1流感、寨卡病毒、埃博拉病毒等疫情时,美国FDA也批准了大量紧急使用授权。[6]
与完全批准(full approve)不同的是,在给与紧急使用授权后,FDA会继续关注该产品的有效性和安全性证据。
北京大学药学院院长周德敏告诉《知识分子》,目前对于辉瑞疫苗的关注重点可能在安全性和适用人群。“因为这是第一次用这种mRNA做疫苗,然后用一种脂质体纳米颗粒 (LNP)做传递,我想这可能是大家最关心的。”
此前该疫苗临床试验中,有四名疫苗组受试者在接种后出现贝尔氏面瘫(Bell Palsy),安慰剂组则无一人出现此问题。贝尔氏面瘫常表现为单侧面部的神经麻痹,症状可以自愈。由于面瘫出现在疫苗组中的概率并不比在普通人群中更常见,因此,FDA认为这四例面瘫不能看做疫苗欠缺安全性的证据。[7]
周德敏还表示,他曾不太看好这类疫苗,因为mRNA疫苗可能不擅长对付突变快的病毒,而流感、HIV等病毒的突变率很高,但目前来看新冠病毒突变率并不高。
“RNA病毒(包括新冠病毒)最大的问题是免疫逃逸,而免疫逃逸的来源是基因突变。如果病毒突变率不高,至少在突刺蛋白上突变不高,那病毒可能不会是一个大问题。”周德敏说。
2 六国已批准辉瑞-BioNTech疫苗
12月1日,英国首先批准了辉瑞-BioNTech疫苗紧急使用,该疫苗也成为首个获得西方国家许可的新冠疫苗。英国预定了4000万支辉瑞疫苗,第一批80万支现已运抵,80岁以上老人和医疗工作者优先接种。当地时间12月8日早晨,一位90岁的英国女性成为该疫苗获批后的首位接种者。[5]
英国之后,辉瑞疫苗先后在巴林(12月4日)、加拿大(12月9日)、沙特阿拉伯(12月11日)和墨西哥(12月11日)和美国(12月11日)获得使用许可;同时,该疫苗也向欧盟、澳大利亚、日本、新西兰等国家或地区提交了使用申请。[9,10]
值得注意的是在12月9日,英国开始辉瑞疫苗接种的第二天,英国国家健康服务系统(NHS)发出警告,有过敏史的人不应接种这款疫苗。早些时候,两名NHS医疗工作者在接种辉瑞疫苗后发生类过敏反应(anaphylactoid reaction),且均有过敏史。据《卫报》报道,目前两人恢复良好。[11]
12月10日,美国FDA委员斯蒂芬·哈恩(Stephen Hahn),表示FDA正与英国的合作方紧密配合,试图了解过敏反应的原因,至于接种人群,“我们会非常仔细地研究数据,来说明哪些人不应该接受疫苗,这些是FDA为了确保安全性和有效性所做的事情。” [12]
目前,美国尚未确定疫苗接种的优先顺序。美国疾病控制与预防中心(CDC)的联邦官员表示,应优先考虑美国2100万医护人员以及在养老院生活的300万美国老年人。[13]
3 新冠疫苗保护期尚不确定
除了辉瑞的mRNA疫苗,美国还有一款mRNA疫苗备受关注。11月,美国生物公司Moderna宣告了其研发的mRNA新冠疫苗有效率94.1%的三期临床试验结果。该疫苗可储存于-20℃环境。美国FDA将在12月17日召开专家会议讨论Moderna疫苗的紧急使用授权。
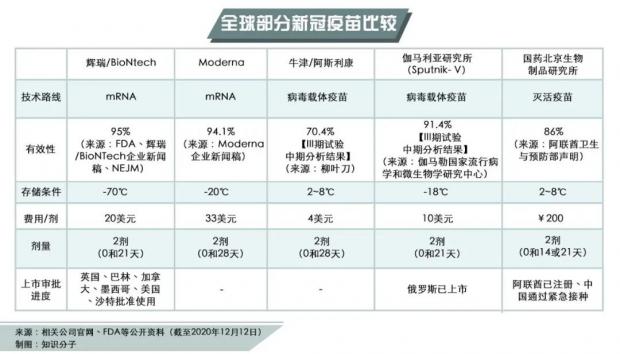
在其他国家,俄罗斯在今年8月批准了一款腺病毒载体疫苗“卫星V”(Sputnik V)注册,尽管当时其三期临床试验还未完成。11月24日,俄罗斯联邦卫生部宣布该疫苗第二次中期分析结果显示预防新冠病毒感染的有效性达到91.4%。[14]
12月9日,阿联酋批准了中国国药集团研发的新冠灭活疫苗正式注册。根据阿联酋卫生和预防部的声明,对Ⅲ期临床试验的分析表明,该灭活疫苗对抗新冠病毒感染的有效率为86%。[15]
这些短时间内研发出的新冠疫苗,对人体的保护效力能持续多久?
对此,周德敏表示,“我想三、五个月应该没问题,三五个月以后会怎么样?我现在不敢说。就跟做流感的时候,能感受到三到五个月如果能产生群体免疫力已经足够了,不行那半年以后再打一次。因为那个时候大家对疫苗争抢的欲望可能也就降下来了。”
辉瑞疫苗临床三期试验开展于今年7月,距今仅5个月。BioNTech公司CEO乌戈尔·萨辛(Uğur Şahin)曾表示他预计保护力持续数月甚至数年。[10] 随着对受试者的持续观测,时间或许会带来答案。
辉瑞和BioNTech称,其疫苗全球产量至2020年年底可达5000万支,2021年可生产13亿支。
参考资料
[1]https://www.fda.gov/media/144412/download
[2]https://www.smh.com.au/world/north-america/us-regulators-approve-pfizer-vaccine-immunisations-to-start-in-days-20201212-p56mvo.html
[3]https://www.cbsnews.com/news/covid-19-vaccine-pfizer-fda-panel-approves-emergency-use/
[4]https://www.pfizer.com/news/press-release/press-release-detail/pfizer-and-biontech-conclude-phase-3-study-covid-19-vaccine
话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。



 京公网安备 11010502034662号
京公网安备 11010502034662号 