阅读:0
听报道

pixabay.com
撰文 | 王一苇
责编 | 陈晓雪
2020年1月11日,新冠病毒全基因组序列由中国科学家向全世界发布。第一时间下载序列的科学家中,有一支美国的研究团队格外激动。他们预感到,一项曾被学界忽视、看似微不足道的研究成果将会成为抗击疫情的关键技术。
中国籍结构生物学者王年爽是这支队伍的成员之一。
“看到这个消息时是个周末,我在家里,当时就感觉眼前一亮,” 他回忆,“我们之前发明的技术很有可能能直接用上。”

王年爽和同事开发的S蛋白稳定技术,不仅可用于mRNA疫苗,也能用于腺病毒载体疫苗等基因疫苗。本图由受访者提供。
王年爽2014年博士毕业于清华大学,此后来到美国做博士后工作。新冠疫情暴发时,他所在的实验室正和美国国家卫生研究院(NIH)以及制药公司Moderna合作研发中东呼吸综合征(MERS)病毒的mRNA疫苗。MERS是另一种能感染人的冠状病毒。
为了制备MERS疫苗,他和同事已经完成了一项关键技术的研发——通过在冠状病毒基因序列中添加两个脯氨酸突变,稳定冠状病毒的刺突蛋白。
刺突蛋白(spike protein)也叫S蛋白,在冠状病毒表面分布,它像一个个小助推器,结合人体细胞表面并把病毒核酸信息注入细胞。同时,它也能激发人体免疫细胞产生抗体。如果能把控制S蛋白生成的基因序列当作疫苗注入人体,在体内生成无毒的S蛋白,就可以激发人体产生抗体。
但是有一个问题:结合人体细胞表面后,S蛋白很容易失活,无法再激发抗体。王年爽和同事通过修改S蛋白的基因序列,保持了它的活性。这样,只要把S蛋白的基因序列作为疫苗的主要成分注射进人体,就能持续高效地激发人体免疫反应。
冠状病毒表面结构,图源pixabay.com
利用这项技术,在得到新冠病毒序列后的那个周末,王年爽和同事迅速设计出带有脯氨酸突变的S蛋白序列并与NIH和Moderna分享。同时在周末两天时间里设计了17条基因序列,用于未来的新冠S蛋白结构解析,支持Moderna疫苗的各类测试,以及与多个公司合作开展的抗体筛选。此后,Moderna研发出以带有两个脯氨酸突变的S蛋白基因序列为核心成分的mRNA疫苗,并在2020年的3月16日成为美国首支进入临床试验的候选新冠疫苗。[1]
当地时间2020年12月18日,Moderna的新冠疫苗获得美国食品和药物管理局(FDA)紧急使用授权,用于18岁及以上的人群。其三期试验结果显示接种两剂后的有效性为94.1%。[2]
同样应用了这项技术的疫苗还有辉瑞/BioNtech的mRNA疫苗。目前,这两支疫苗已经成为美国人群接种的主要疫苗 [3]。此外,赛诺菲/葛兰素史克(GSK)和CureVac的mRNA疫苗也应用了这项技术。
王年爽和同事开发的S蛋白稳定技术,不仅可用于mRNA疫苗,也能用于腺病毒载体疫苗等基因疫苗。进入临床试验的新冠疫苗中,强生的腺毒载体疫苗和Medicago植物样病毒颗粒疫苗等就应用了这项技术。
王年爽说,在新冠以后,如果再出现类似的冠状病毒,同样的技术也能够迅速应用于新疫苗的研发。
而这一切,都始于一项曾经看上去希望渺茫的结构生物学研究。
这项稳定S蛋白的技术是如何诞生的?不同疫苗技术路线的优势和劣势是什么?如何看待基础研究投入和科学发展的关系?
以下是《知识分子》和王年爽的对谈,内容有精简。
知识分子:
从设计S蛋白到和Moderna合作研发疫苗,你做了哪些工作?
王年爽:在清华读博士期间,我和导师王新泉教授研究的重点就是冠状病毒的结构。2014年,我从清华博士毕业。当时 Jason McLellan 是我的海外合作导师。2013年他在达特茅斯学院成立了自己的实验室,开始做结构指导疫苗设计的工作(编者注:McLellan的实验室于2018年迁移到德州大学奥斯汀分校)。(我的工作)从那时起一直到2020年8月份,总共进行了6年多的时间。
从开始试验到最终达成设计S蛋白,我们大致经历了三个阶段,这三个阶段是一步一步相互促进的过程。
2014年到2015年是前期发展阶段。一开始,整个冠状病毒研究远远滞后于其他病毒,比如艾滋病毒(HIV)和流感病毒。当时关于S蛋白,有许多未知,连全长结构都是没有的。我们基本上从零开始。
之所以选择MERS病毒,是因为2014年的时候它还是我们领域的关注重点。2012年9月,MERS在中东暴发,它的致死率一开始大概在50%,后来降到35%左右 [4],比SARS的10%高不少。而当时对它的致病机制和侵染机制了解都不多。科学界有担忧,它有没有可能通过其他途径变成传播力更强的病毒。
一开始其实挺艰苦的,因为是新成立的实验室,我们的条件还比较差,很多设备都没有。
我是实验室里唯一一个做冠状病毒的。我的主要工作是每天纯化蛋白,然后针对蛋白做一些设计。我们不会接触活病毒,而是在基因层面上操作,相对比较安全。MERS病毒S蛋白的基因序列全长表达1000多个氨基酸,我会修改这段基因,然后放到哺乳动物细胞里培养,产出蛋白。这些蛋白取出纯化之后,就可以研究它的性质了。
修改基因的目的,是让蛋白稳定下来,保持它的活性。S蛋白原来呈蘑菇状,病毒入侵人体细胞后,它结合了细胞,会去掉头上的盖子,柄的一部分也弹开了,就失去了活性。如果用S蛋白做疫苗,我们需要它在进入人体后还能保持蘑菇状的活性状态,才能激发更多抗体产生。
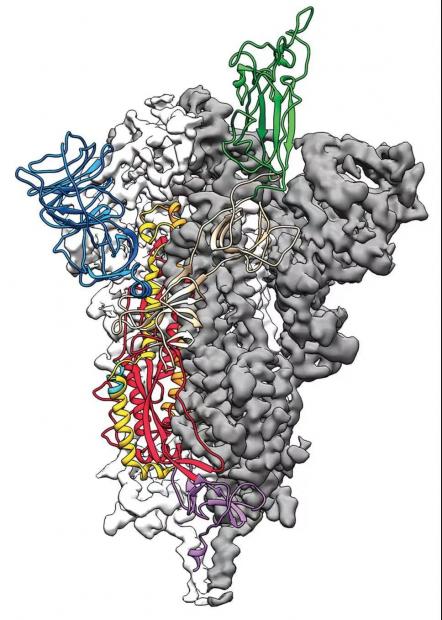
新冠病毒的S蛋白结构。
图源:https://science.sciencemag.org/content/367/6483/1260
SARS和MERS两种致病性高的冠状病毒,S蛋白结构是最不稳定的,很容易失活。由于蛋白不稳定,我们每次表达纯化后,获得的蛋白量非常少。不光少,也非常不稳定。纯化之后,很短的时间它有可能又失活了,就不能用了。
我们借鉴了之前科学家稳定流感病毒蛋白的经验,做了200多次尝试,通过添加突变、帮助蛋白形成三聚体等,发现有一些帮助,但不是特别明显。
我们就在想,有没有可能找另一种冠状病毒,不需要我们费这么大的气力拿到(S蛋白),并且有相似(的S蛋白)结构,通过那个结构反过来再做MERS,可能会相对容易一点。
我们的合作者,NIH的 Barney Graham 实验室,当时有一个博士后家住中东地区,他回家后感染了一种叫做HKU1的冠状病毒。他那个实验室就开始做HKU1病毒。我们也跟着尝试,结果蛋白相对稳定一点,能拿到比较好的蛋白样品。同样从Barney实验室,我们拿到一个能结合MERS病毒S2部位的中和抗体,这个抗体结合之后能大大提高S蛋白的稳定性,这给了我们很大信心:这条路是很有希望走通的。
第三阶段,我们才开始做S蛋白的结构指导的疫苗设计。根据合作得到的HKU1 S蛋白结构,我们最终通过筛选100多个MERS病毒S蛋白的突变体,发现添加两个脯氨酸突变能大大提高S蛋白的表达量、稳定性和免疫原性。Moderna大概在2017年开始用我们的技术,当时是做MERS疫苗的设计。
我们当时也不知道新冠病毒会发展成一场全球性的公共卫生事件,只是知道这是一种新发冠状病毒。过去10年里,有几个新发冠状病毒,包括埃博拉、寨卡病毒和MERS,但最终都没有发展成全球的危机。
在我们知道新冠病毒跟SARS序列相似性非常高的时候,我们其实有一些信心。因为冠状病毒的S蛋白都非常相似,我们用的技术手段主要还是来自于MERS。根据当时积累的一些经验,我们知道在哪些地方突变,它的稳定性会更好。但不知道全基因组的时候,还没法完全确认。
所以,拿到基因序列是最重要的。新冠的基因组序列是我们中国科学家首先报道的,也直接推动了全球针对新冠的疫苗和抗体的研发,这是我们中国对世界的一个巨大贡献。
知识分子:
听说你们这项技术的论文遭遇了5个顶级刊物的拒稿,现在看来似乎是很不可思议的事情。当时审稿人没有看到这个研究的意义?
王年爽:首先,大家可能对结构指导的疫苗设计这种思路还不是特别认可。大家注意到了我们加了两个脯氨酸,但可能没有深入研究这两个脯氨酸到底起了什么作用。结构指导疫苗设计整个领域大概在2013年开始取得突破,在当时还不是特别被人认可,这是一个方面。
第二个方面,2016年以后,几乎已经不认为MERS冠状病毒是能够导致全球危机的病毒。当时散发的病例越来越少,大家都知道它的传染性没有那么强。
还有一些其他原因,也可能是我们自己的问题,把非常多的数据集中到一篇文章中。一开始我们认为,这可能能够提升文章的价值,但后来我们发现审稿人普遍把目光都集中到了其他的方面。如果是做结构的,他会质疑你这个结构没有什么意义,因为MERS的S蛋白结构不是第一个冠状病毒的结构;做抗体的一些人又会质疑我们的抗体不是一个广谱的抗体。拆分开去攻击这篇文章的某几个点,看不到全貌,这也是一个问题。
最终看下来,有我们的问题,但我相信也有审稿人的问题,最后就没有得到认可。
知识分子:
你当时做的冠状病毒的研究,是一个相对没有那么引人注目的方向?
王年爽:对,是这样子的。一开始做这个,我们不确定到底是不是能有一种手段,对我们做的MERS冠状病毒有效,并且对其他的冠状病毒也有效,一开始有非常大的不确定性。做完一年以后还没有什么成果,当时也有怀疑,到底我们这条路能不能走得通,走不通的话,之前的努力有可能就白费了,是有担忧的。
不过当时感觉这样一项工作非常有意义。不光是在学术本身比较有意义,可以推动我们这个领域向前发展;另一方面,它将来有可能在应对一种新发冠状病毒的时候,能够直接用上,是简便通用的一种方法。所以一直坚持着去做。
知识分子:
假设过了一两年还是没有做出来,会有什么后果吗?比如博士后不能出站?
王年爽:会有担忧,不过当时我刚刚来美国,相对来说压力不是那么大,我觉得应该多投入一点时间,拼一下试一下。万一做成功了,是不是?
在美国,学术环境相对更加多元化。美国会有很多人习惯于一辈子就盯着一个方向做研究,有很多一辈子做一件事情的科学家。
当时在达特茅斯,学术环境还比较好,没什么竞争。实验室本身也比较小,周围的人都相对来说比较好,不会说因为你做出来一个什么东西,就特别崇拜你,或者做不出来什么东西,就特别看不起。整个学术氛围都特别好,我特别喜欢那种环境,不是特别功利,专注做自己的研究。
我们一直跟NIH旗下的疫苗研发中心(Vaccine Research Center,简称VRC)有长期合作的关系。不管是在经费方面,还是在其他的实验支持方面,都是跟他们合作完成的。
其实我特别希望在咱们国内会有一个类似VRC的机构。VRC本身有自己的传染病梯队。他们在过去的20多年的时间里做出了非常重要的突破,在人类免疫缺陷病毒(HIV)的广谱中和抗体、流感的广谱疫苗和呼吸道合胞病毒(RSV)的结构指导疫苗设计这几个方面都做得非常好。
他们是美国政府直属的,有相当的话语权。国家(机构)在(科技)政策上有引领作用,对其他的研发机构也是提示,要专注于做最新、顶尖的传染病技术研发。这样的工作有可能在很长一段时期内都看不到成果,如果单纯指望科学界、高校科研院所的团队来做这样一项工作,可能耗时耗力,很长时间做不出成果,可能慢慢的就不被重视。
希望我们国家能够集中全力,做一些面向未来的传染病基础技术和理论的开发工作。可能要花费很多精力,很长时间发不了文章,但是这些工作都是需要有人去做的。在新技术的开发上,国家有一个团队去做引领性的工作,对我们未来的应对传染病的战略会有重要帮助。因为是政府牵头,它在商业开发上也会有一定的优势,可以在公司和研究机构之间建立比较好的桥梁,这些都是这样一个团队所能集中解决的问题。
知识分子:
你说过,mRNA疫苗的技术是把医学免疫学的问题转化成一个生化技术的问题,用结构生物学的方式去构造疫苗是一种革命性的创新。mRNA疫苗的创新之处在哪里?
王年爽:病毒入侵的过程,就是把它本身的RNA注入到人体细胞里边,复制扩增,产生更多病毒体。灭活疫苗是通过降低病毒的活性,把病毒做成疫苗,注射到人体内。人的免疫系统会有免疫反应,产生抗体,就可以保护人抵抗病毒入侵。
mRNA疫苗最主要的优势是把医学和免疫学的问题转化成了一个生化技术的问题。它模拟了病毒的入侵过程,把病毒最重要的s蛋白的RNA注入到人体,肯定能激发比较强的免疫反应。通过模拟这样的过程,疫苗肯定是有效的。
mRNA技术本身的一个问题,主要是mRNA注入人体以后,会被人体当成异物,产生一些不良反应。怎样解决这个问题,这是需要关注的。
大概15年前,匈牙利裔科学家卡塔琳·卡里科(Katalin Kariko)在宾夕法尼亚大学发展一种技术,通过改变碱基的组成,让mRNA绕过人体的免疫识别。通过这个当前看来非常简单的生物化学的技术手段,一下子解决了这个问题,让mRNA疫苗技术迅速走向前台。
病毒载体疫苗其实也面临着同样的问题,会被人体当成异物。但它的改造就非常困难,因为腺病毒的颗粒是入侵细胞必须的一个成分。如果人本身感染过腺病毒,就会存在预存免疫,在疫苗真正发挥作用之前有可能就把疫苗给清除掉了。
知识分子:
你在微博上说过,现在疫苗接种是疫苗接种跟病毒变异的一场竞赛,未来的一两年很关键,如果控制不好,等到病毒出现亚型的话,就很难消灭了。为什么这么说?
王年爽:冠状病毒本身是RNA病毒, RNA病毒的一个重要特点就是变异速度比较快。
一开始,我们对RNA病毒变异的关注度其实不高。根据之前的研究,冠状病毒本身具有复制矫正机制,变异的速度相对慢一些。但是过去这一年,尤其去年12月份开始,有几个突变株引发了非常大的关注。
病毒的突变大概有两类,第一类的突变可能会影响它的一些传播特性和致病特性。在我看来,这种突变的影响不是特别大,因为我们通过疫苗的手段对抗这类突变株,其实没有什么压力。
还有一定的突变株,它的产生就是为了对抗人体的免疫反应。这类突变就会导致非常严重的问题。它对人体的免疫反应,尤其抗体反应,会有一定的抗性。我们用当前研发出来的中和抗体去杀它,很可能就杀不掉了。之前注射的疫苗建立起来的免疫保护,可能对它也是无效的。这种突变叫逃逸突变,会导致之前建立的免疫保护部分或者完全失效。
这类病毒的变异就非常引发关注。根据最近的三期临床结果,Novavax和强生做出来的疫苗对南非出现的株系效果就已经不是那么好了(编者注:Novavax针对南非逃逸变异株的二期b临床试验显示60%的有效性,低于其同时发布的三期临床试验中在英国89.3%的有效性 [5];强生的三期临床结果显示其疫苗在南非的有效性为57%,而在美国的则为72% [6])。很多康复患者也有可能会感染这种变异株。
知识分子:
mRNA疫苗能够快速应对病毒的这种突变吗?
王年爽:病毒针对人体免疫反应的这种突变主要是S蛋白上的突变。mRNA能够应对这种突变,主要是因为它的制备相对比较简单,因为只要替换序列就可以了。如果出来一种突变,(研究人员)有可能在短时间内迅速合成一条新的mRNA。相对于其他的几种疫苗手段来说,这样的反应会比较快速。
根据Moderna发布的数据,更新一个新疫苗的时间大概是6周左右。当然,后期还要通过动物实验或者至少小范围的临床试验来验证它的有效性,这其实是一个比较重要的限速步骤。
灭活疫苗用的是全病毒,做新的灭活病毒疫苗,需要重新更换病毒株,然后重新大规模培养,整个流程相对复杂,应对可能会相对慢一些。
知识分子:
如果重新研发一个新的mRNA疫苗来应对突变株,需要重新再经历一遍所有的动物实验和临床试验的过程吗?
王年爽:这还是要监管机构来说了算。但我认为这是没有必要的,尤其三期临床应该是没有必要的。一方面,三期临床耗时耗力,之前已经投入那么多,包括mRNA疫苗已经验证这样一种用S蛋白制备的技术手段产出来的疫苗是有效的,再做三期,必要性上没那么强。
再一个,因为病毒时刻都是在变化当中,即使重新做一个三期的临床试验,我们也不能保证感染的人是不是携带的是南非变异的毒株,所以三期试验获得的数据也有可能是不真实不全面的,并且耗时耗力,我个人感觉是没有必要的。
有可能需要做一个动物实验,外加一个小范围的临床试验,这是我个人倾向的更新疫苗后重新上市的流程。(编者注:2021年2月,美国食品和药品管理局(FDA)更新指导意见,针对突变株开发的S蛋白表达类疫苗,在临床数据方面有效性可以根据原疫苗的有效临床数据判定,此外需增加两项小规模的针对单一年龄群体的临床试验[7]。)
知识分子:
逃逸突变是S蛋白上的突变,你所研究的技术相当于是把S蛋白的序列的某两个碱基换掉。有没有可能突变之后你的技术会失效,做不到修改S蛋白的功能?
王年爽:我个人感觉概率是比较低的。S蛋白全长大概有1300多个氨基酸,虽然某一些突变株有可能出现很多个突变,相对来说比例比较小,像D614G和E484K等都是单碱基突变,理论上不认为这样少数的突变会影响S蛋白的结构和整体的免疫原性。
冠状病毒跟流感病毒有一个非常大的不同,冠状病毒出现的突变大多集中在少数位点,不会发生像流感病毒(出现)大范围的重组,这是相对来说比较好的一点,防控起来相对容易。
知识分子:
我身边的人都会有一些对接种疫苗的疑问,有些人觉得国内的疫苗数据也不是特别完善,效果感觉也没有国外的疫苗好,会抱有疑虑,说我是不是不去接种了。对普通人,你有什么样的建议?
王年爽:首先,中国和其他国家只要能批准上市的疫苗,当前数据其实还是相对比较扎实的,至少能保证接种疫苗是利大于弊的,接种肯定比不接种好,这一点上没有问题,所以说,能接种疫苗的时候不要犹豫,这肯定是对你自己有好处的,对你身边的人也是有好处的,这是第一点。
第二,疫苗的判定标准有很多种,包括它的有效性、安全性、可及性、可负担性,还有其他很多指标,保护时间的长短、覆盖毒株的范围。我们需要依靠很多的指标来综合评价一个疫苗,没有说哪个疫苗就一定具有所有的优势,这是不存在的。辉瑞、Moderna的疫苗也有他们的劣势,包括储存条件等指标。
不要把哪个疫苗当成绝对好,或者说哪个疫苗绝对不好,不同的疫苗可能有它的适用范围,要综合考虑各方面来判断到底要接种哪一个疫苗。不要神话,也不要丑化。
当前面临的情况其实还是疫苗整体供应不足的问题,这是全球都面临的一个问题,其实中国已经在开始加大疫苗产量,扩大疫苗接种范围。在能够接种疫苗的时候,我们不要犹豫,接种肯定是利大于弊的。
知识分子:
流感病毒每年都会制备新的疫苗,或者针对一个可能流行的毒株去制备一个新的疫苗。对于新冠,未来的防控会是这样子的吗?
王年爽:凭当前的数据,我们还不能得出特别清晰的结论,未来的新冠病毒到底变成什么样。
但是对于新冠,我们当前所能用到的技术手段已经比之前研发流感疫苗的时候多了。现在全球多地都在做基因组测序,我们对序列的掌控和了解多了很多,未来还是要持续做监控,根据出现突变的频率和危险性及时更新策略。
当前不是特别清楚(病毒)会限制在这几个突变的范围之内,还是会持续更多的突变。这需要一段时间的观察。如果只限制在小的范围内,将来有可能做多价疫苗来进行防控。如果出现更大范围的突变,包括RBD(受体结合区)上连片的突变,可能我们就需要一起用上其他防控手段。
研究冠状病毒领域的学者,一般的共识是疫苗需要不断更新,有可能未来会像流感一样每年更新,在普遍人群通过疫苗或者通过感染达到群体免疫之后,致死率不会那么高,普遍的症状也会降到大致相当于流感的水平。到那时,相当于人和病毒达成了一个妥协。这样一种前景是还是很有可能的。当然也有最坏的情况,也有可能相对更好一点的情况,还是需要再持续观察。
将来能够回归正常的生活,这是我们每一个人都期待的。我相信那一天不会特别远,至少再过几年之后可能会达到那样一种状态,也希望疫情的危害性能够尽量降到最低。
参考资料:
[1]https://www.forbes.com/sites/victoriaforster/2020/03/17/first-person-injected-with-trial-coronavirus-vaccine-in-seattle/?sh=3156f9872583
[2]https://www.cdc.gov/mmwr/volumes/69/wr/mm695152e1.htm?s_cid=mm695152e1_w
[3]https://covid.cdc.gov/covid-data-tracker/#vaccinations
[4]http://www.emro.who.int/pandemic-epidemic-diseases/mers-cov/mers-situation-update-june-2019.html
[5]https://ir.novavax.com/news-releases/news-release-details/novavax-covid-19-vaccine-demonstrates-893-efficacy-uk-phase-3
[6]https://clinicaltrials.gov/ct2/show/study/NCT04505722
http://www.pmlive.com/pharma_news/j_and_j_submits_one-dose_covid-19_vaccine_to_who_for_emergency_use_listing_1363827
[7]https://www.fda.gov/media/142749/download
话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。



 京公网安备 11010502034662号
京公网安备 11010502034662号 