孤儿药的前世今生:从药厂弃儿到莎乐美肠策略 | 图源:
导 读
每年的2月28日是国际罕见病日,和 “罕见病” 常常同时被人提起的另一个名字是“孤儿药”(orphan drug)。“罕见病” 和 “孤儿病” 两者的关系和差别在哪里,是可以互相替换的吗?“孤儿” 一词又是从何而来?该领域学者董咚在《知识分子》发文,回顾这段历史,并展望罕见病和孤儿药的未来。
撰文 | 董咚
责编 | 刘楚
目前,世界上大概存在7,000-8,000种罕见病(rare diseases / disorders),并且正以每年约250种新疾病的数量增长 [1,2]。其中,约一半的罕见病在儿童时期发病,且极少可治愈。目前,仅有5%-10%的已知罕见病可以通过药物或手术等手段进行治疗,而这些治疗手段多数只能提高患者存活率或延缓病情的恶化。就这个意义而言,罕见病囊括了非常广泛的疾病及其临床症状,也对患者在身体、精神、经济和其他方面造成巨大的负担 [3]。
和 “罕见病” 常常同时被人提起的另一个名字是 “孤儿药”(orphan drug)。维基英文词条中关于罕见病的介绍是一句拗口的话:
“罕见病是影响一小部分人的任何疾病。在世界的某些地方,孤儿病是一种罕见病,其罕见性意味着缺乏足够大的市场来获得支持和资源来发现治疗它,除非政府给予经济上有利的条件来创造和销售这种疾病治疗药物。” [4]
2009年,比利时的一个研究中心曾经出具过一份关于《孤儿病和孤儿产品的政策》的报告,其中明确指出 “孤儿病通常被定义为患病率极低的疾病或者就是罕见病”;而 “罕见病通常难以诊断,专业临床医生通常稀缺……罕见病治疗药物不太可能由私营公司生产,因为市场太小,孤儿产品的研发成本通常太高,无法使产品盈利。(因此)用于治疗罕见病的药物因此又称为孤儿药。” [5]
但是 “罕见病” 和 “孤儿病” 的差别在哪里,它们是可以互相替换的吗?又是如何发展而来的?
1、孤儿药的“孤儿”从何而来?
“孤儿药” 的说法实际上是从60年代才开始的,但彼时 “孤儿” 这一说法与罕见病并无关联。
1930年,美国食品药品监督管理局(FDA,Food and Drug Administration)成立。1938年,美国发布新的《食品药品与化妆品法》(Food, drug, and cosmetic act, FDCA),取代1906年的《纯净食品与药物法》(Pure Food and Drug Act),新药上市申请(new drug application, NDA)的程序开始逐步规范化,但这距离药物的 “安全性” 严格审查仍有很长一段时间。
到了二十世纪六十年代,药品安全的问题已经非常令人担心。1960年,当时的联邦德国药厂 Chemie Grünenthal 向FAD正式提交在美国上市销售沙利度胺(Thalidomide)的申请。当时,这款已风靡全球、抗妊娠反应的止吐药,被一个刚入职的审评员弗兰西斯·凯尔西(Frances K.O. Kelsey)打回,并要求补充研究。
因为弗兰西斯·凯尔西一人的努力,沙利度胺没有在美国上市,最终全美仅有17人因为服用了由医生分发的样品而分娩了患有 “海豹症” 的孩子;而当时在全球46个批准沙利度胺上市的其他国家,约有1万名婴儿因此而产生严重的出生缺陷 [6]。
这一事件间接促使了1962年《联邦食品、药品和化妆品法——科夫沃—哈里斯修正案》(Kefauver–Harris Amendments to the Food, Drug and Cosmetic Act)的通过。该法案被认为是现代消费者权益运动的一个标志性成果。

图1 审评员弗兰西斯·凯尔西 | 图源
《科夫沃—哈里斯修正案》最重要的贡献在于立法要求所有新药的上市申请都必须基于药物有效性证据,即新药上市前必须做安全性、有效性评价,必须通过充分良好的临床试验验证。同时,该修正案也赋予FDA作为药品研发、审评和监管守门人的角色,对美国乃至全球药品审评制度的发展产生了极为深远影响。
修正案出台以后,收紧新药审批的同时,FDA提出了新药研究申请(investigational new drug notice, IND notice)程序性要求:所有计划进入临床试验的药物必须要在开始之前先向FDA提出申请,否则就不能开展临床。
1962年修正案的出台标志着新药审批从极其松散向严格逐渐收紧过渡。为了搞清楚有多少药在IND申请规定出台之前已经进入临床,FDA要求药企提供正在进行临床试验的药物清单;依据清单,药企必须补充提交IND申请,或者撤出临床并向FDA说明撤出理由。
结果,有四分之一的清单药物最后选择撤出了临床试验。而撤出原因,依据当时美国临床医学研究学会(The American Society for Clinical Investigation)的代表 Grant E. Liddle 的说法,这些药的商业价值太低了 [7]。
据历史学家Koichi Mikami考证,首个将 “孤儿”(orphan)单词用来形容药物的人是儿科医生、美国儿科学会(American Academy of Pediatrics)药物剂量委员会主席 Harry C. Shirkey。1963年举行的一个学术会议上,Harry C. Shirkey 在表达对于儿童用药可及性的担忧时直接使用了 “pharmaceutical orphans”(制药孤儿)一词。
1968年,Shirkey医生在《儿科学杂志》(The Journal of Pediatrics)又专门撰文,进一步阐述对于 “制药孤儿” 的担忧。他说,“在命运奇怪而不幸的转折之下,婴儿和儿童变成了 ‘治疗或者制药的孤儿(therapeutic or pharmaceutical orphans)’。自1962年,他们被很多新药拒之门外…… 有一小部分在1962年之后批准的新药,应该是既可以用于成人又可以用于婴儿、儿童。然而,从1962年开始,很多药物开始标注 ‘孤儿化’ 的条款,例如声称 ‘不能用于儿童’ 或者 ‘由于缺乏在这一年龄组别的研究,该药不推荐用于婴儿或儿童’,抑或是‘没有足够的临床证据可以证明适合推荐婴儿或儿童使用该药’。” [8]
确实,正如Shirkey医生所言,《科夫沃—哈里斯修正案》的出台是为了保护未出生的婴儿不要因为药物导致畸形;然而其后果却造成了这些本应被保护的人群无药可用,成为 “孤儿”。
Shirkey医生同时代的另一观点认为,正是由于《科夫沃—哈里斯修正案》使得药物上市的成本骤升,因此很多药企不愿意为了少数人(比如婴儿和儿童)而专门做临床试验,从而使得这些少数人无药可用。那些没有盈利性的药品被药厂弃于一边,变成了 “孤儿”。然而,与此同时,因为上市成本高,在美国当时的市场上形成了 “drug lag”(药品滞后)困境,孤儿药也被认为是这一情况的极端表现,有时也只能通过对相关企业唤醒其 “社会责任心” 才能稍微得以解决。
到了1974年,FDA牵头组织成立了一个专门针对 “商业价值较低的药品” 的 “跨部门合作工作小组”,希望能够发展出一套激励机制来解决药企因为研发和生产成本昂贵而无法从一小部分患者那里收回成本的问题。
实际上,在1970年代中期,孤儿药已经不单指儿童用药,还涉及所有因为利润低、使用人数少的药物,包括单一用途药物、用于治疗第三世界国家流行病的药物以及未获得专利的药物等等 [9]。
“跨部门合作工作小组” 在1975年得出的结论是,虽然应该出台激励机制来鼓励药企生产这些因为使用人数太少而没有商业价值的药物,但是这些可能的药物实在是太多太分散了,很难形成一套统一的机制。于是,这些药不仅仅因为制药企业而被 “孤儿化”,也被1970年代的药品监管改革 “孤儿化” 了。[7]
1977年,美国国会举行了一个由亨廷顿舞蹈症(Hungtington’s Disease)患者发起的听证会 [10],基于这个听证会所发表的报告被提交到这个FDA的跨部门工作小组。
1979年,FDA “跨部门合作工作小组” 发表了一份新的工作报告,其中特意回应了亨廷顿舞蹈症患者的需求,同时也提到亨廷顿的报告和其他 “人数少但是有发言权的特殊疾病(special disease)组织或者志愿机构” 所谈到的类似建议 [11]。
这一段内容提供了两个有用的信息:(1)他们使用了 “特殊疾病”(special disease)一词,而非 “罕见疾病”;意味着,“罕见病”这一用词在当时并未被FDA或其他组织或机构注意到;(2)在当时已经有了一些由人数少、疾病特殊的患者自发形成的患者组织,而这些患者组织在之后1983年孤儿药法案的出台过程中发挥了重大的作用。
2、孤儿药法案背后的三股力量
1979年报告在某种程度上成为了1983年孤儿药法案的前奏。从70年代中期开始,已经有不同相关利益群体基于自身理由或多或少地关心起孤儿药立法的事情。
第一个群体是医生。例如,纽约西奈山医院的一名研究人员研发了一个可用医治肌阵挛的药物。但是这个药物的一个成分是5-羟基色氨酸——一种天然的氨基酸代谢中间产物。然而当时并没有任何厂商生产5-羟基色氨酸,因此这名研究人员只能自己在实验室里面提取,于是他和一个肌阵挛患者一起找到了纽约的议员,希望通过立法的方式来解决药厂不愿意生产孤儿药的问题。
第二个群体是药企,尤其是生产仿制药的药企。70年代末80年代初,仿制药厂的数量在美国也逐渐增多。原研药企并非不知道孤儿药所引发的问题,然而他们当时的主要诉求是不希望FDA只针对孤儿药而采取特殊的政策,更何况当时已经有了针对某些新药研究申请在同情(compassionate)基础上的加速审批。原研药企希望FDA可以一揽子解决药物审批时间过长所导致的 “药品滞后” 问题。但是,仿制药企的看法却不相同。他们敏锐地发现,有很大一批孤儿药是专利已经过期的药物,许多原研药企已经因利润缩减而停产。而专利过期的药物正是仿制药企发家致富的好机会。而专利过期的药物正是仿制药企发家致富的好机会。80年代初,仿制药行业协会成立,随后又立刻在协会下设了孤儿药机构,专门鼓励仿制药企来抓住孤儿药立法的机遇。眼看着仿制药企雄心勃勃准备大干一场,原研药企被逼无奈,不得不掉转车头,表明支持孤儿药立法。
第三个群体是患者。还记得FDA的跨部门合作小组吗?这个小组的组长曾代表FDA在美国国会议员面前表示,政府对于孤儿药立法的支持,只能是针对那些已经研发出来而且又有证据表明足够安全、有效的药物。但是,患者的看法并不相同。时任妥瑞综合征协会会长 Abbey S. Meyers 在证词里说:
“数百万患有罕见疾病的美国人生活没有希望。我们相信,患有镰状细胞性贫血、库利氏贫血、亨廷顿氏病、囊性纤维化、威尔逊氏病、Tay-Sachs病、肌张力障碍等众多疾病的患者,可以让生产他们所需要的药物有利可图。[7]”
可以说,患者群体一方面敏锐地指出,罕见病的人群基数在整体上来看是很大的(数百万);另一方面,他们也提出自己的主张,希望孤儿药的问题不仅仅只是立足于已经研发成功但未上市的药物,而是需要拓展到专门为罕见病来研发新的药物。

图2 1980年美国国会举行的罕见病听证会,议员Henry Waxman (左), Sharon Dobkin, Abbey Meyers (中), Adam Seligman (右) | 图源:
在所有相关利益方的共同努力下,1983年孤儿药法案终于出台 [12]。法案的主要内容可以概括成四点:(1)药企可在药物获批之后获得七年市场独占期;(2)临床研究和临床试验的费用享有50%的税收抵免优惠政策;(3)政府将拨款补助企业的研发经费;(4)建立药品研发企业与FDA的特殊沟通机制。
3、变成复数的罕见病
孤儿药法案的出台产生了一个重要的成果是美国罕见病组织(The National Organization for Rare Disorders,NORD)的建立。其创建者之一就是上文提到的 Abbey S. Meyers。在NORD成立之前,大部分的罕见病团体都是通过单个疾病组织抱团取暖。罕见病这个名词在大多数的时候都是以单数的形式,也就是单个疾病的形式出现的。而 Abbey S. Meyers 在听证会上的发言,无疑成为了罕见病从单数变成复数的先声。
在中文文献里面,罕见病一开始也是作为一个单数出现的。1957年,绍兴市第二人民医院的叶壬高医生给《中级医刊》写信,概括性地介绍了当时并不为人所知的 “蚕豆病”。文末,叶医生提醒读者,需要将 “蚕豆病” 与其他一些表征类似的疾病区分。其中有一个名为Lederer氏急性溶血性贫血的疾病,被叶医生称为 “与蚕豆病并为罕见之病” [13]。
1965年,《解放军医学杂志》在首期杂志上刊登了第一篇明确在标题中提到罕见病的文章《咽鼓管异常开放症并非罕见病》[14]。虽然这篇文章的主旨是帮助读者澄清咽鼓管异常开放症的症状并助其诊断,但罕见病这一名词在标题内的使用也表明,在当时的医学界,“罕见病” 已经成为大家可以接受并且可以日常使用的词汇,尽管仍然是以单数概念出现。
在英国,二十世纪七十年代中期,由于 “孤儿药” 所引发的讨论,有些英国医生也开始用罕见病来描述一些不常见的疾病以及患有这些疾病的患者在寻医问药方面所遭遇的困难。例如,1975年《英国医学杂志(The BMJ )》上刊登了Walshe医生的来信,题目就是 “给罕见病的药”(Drugs for Rare Diseases)。J.M.Walshe医生在治疗威尔逊症(肝豆状核变性)领域赫赫有名,他在信中表达了他的病人有药可用却无人生产的困境 [15]。
然而,正如一些学者指出的,1970年代之前,虽然 “罕见病” 一词已经出现,但是几乎没有任何的影响力。甚至在1983年孤儿药法案第一版里,都没有对于 “作为复数形式存在的罕见病” 的定义。甚至有人认为 “罕见病” 是 “孤儿药” 的一个副产品 [9]。事实上似乎也确实如此。
1983年孤儿药法案刚通过的时候,并没有 “罕见病” 的明确定义。后来,FDA发现很难将孤儿药所谓的 “不盈利” 性界定出来;换而言之,如何让孤儿药获得盈利很难具体描述。究其原因,是无法确定哪些是属于适合发展 “孤儿药” 的 “罕见病”。
1982年,时任FDA孤儿药开发办公室主任,也就是FDA跨部门合作小组的组长Finkel在一个会议上提出,可以将一个孤儿药的 “潜在使用人群” 定在发生率为0.05%的疾病,也就是说,全美患病人数不超过10万人的疾病。
凑巧的是,NORD的创会会长 Abbey S. Meyers 也出席了上述会议,而她和Finkel更是会上唯二的两位女性。会议间隙,Abbey把Finkel带到了女厕所,向她建议将患病人数提高到20万人;其原因是,10万人的上限将把Abbey所了解的三个疾病——妥瑞氏综合征、多发性硬化和发作性睡病都排除在了 “罕见病” 之外。[7]
就这样,在1984年对孤儿药法案的修正案中,美国把罕见病定义为患病人数不超过20万的疾病。
罕见病第一次在英文文献中作为复数形式可以追溯到19世纪中后期。1889年5月,英国医生乔纳森•赫金森(Jonathan Hutchinson)在题为《罕见病的临床应用》的演讲中,把 “罕见病” 定义为 “少见到一定程度,以至于一个医生在其漫长的职业生涯中几乎都未曾遇到过一例的人类疾病” [16]。虽然在此之前也有人使用 “rare disease” 这个词来描述一些单个的不常见的疾病,但赫金森医生的文章是从医学文献中能找到的明确将罕见病作为一个集合名词的最早定义。
图3 赫金森医生 | 图源
此外,赫金森医生对于罕见病领域的重要贡献还有他在文中写下的这几句话:
“罕见往往是最有价值的,因为它观照着常见……我怀有希望在此表明,这些罕见的疾病通常是最有启发性的; 它们与常见的疾病休戚与共; 而我们所有人的责任就是要竭尽所能地去认识它们,并努力加深对它们的了解。”
4、罕见相对论
罕见与常见永远是相对的。130多年前,当赫金森医生发出上述感叹的时候,一定没有预料到,我们今天可以把他的这番话演绎到何种极致的地步。
2003年人类基因组项目完成之后,药物基因组学蓬勃发展。从定义上看,药物基因组学是研究基因组、遗传变异和药物反应之间的关系的学科,其目的是通过对病人特异基因位点的检测来预测药物浓度、药物疗效和药物不良反应,以达到个体化治疗、改善人类健康的目的[17]。
而超过80%的罕见病是基因遗传病,毋庸置疑,罕见病是药物基因组学最适用的研究对象;而药物基因组学对罕见病的影响也是巨大的。其正面影响在众多的文献中都进行了充分阐述,限于篇幅,在此不多赘述;而其最主要的负面影响,却值得我们深思。
第一个负面影响是关于 “Salami-slicing”,即莎乐美肠切割策略——指的是制药公司依据遗传或者生物标志物将疾病分成极为细小的类别,使得其符合罕见病的定义,从而获得孤儿药资格。

图4 冬季莎乐美肠 | 图源:
salami-slicing 策略在制药界久已有之,药物基因组学的出现则使得这一做法愈演愈烈。在 “精准医学” 的话语之下,企业更加有理由将较大的(非孤儿)疾病分为多个新定义的亚型以符合 “罕见病” 的定义,再通过对单独的适应症申请“孤儿药”认证,从而充分享受孤儿药法案的激励措施,尤其是市场独占期以及由此带来的高额利润 [18]。
与 salami-slicing 类似的策略还有药品专利 “常青化”(evergreening)——主要指企业 “通过发展防御专利组合,如开发新的药物释放形式、新剂量、新的组合或变体,或者采取限制竞争的商业手段(如与仿制药企业达成协议等)来延长药物的专利生命周期”。因此,常青化有时也被称为 “生命周期管理”(lifecycle management)[19],这一做法并不仅限于罕见病领域,也广泛应用在常见病药物研发领域。
具有讽刺意味的是,1962年出台的《科夫沃—哈里斯修正案》初衷之一就是为了更好地监管药厂并通过促进竞争来促使药厂降低药价。彼时,修正案的提议者之一、国会议员科夫沃,他同时也担任美国参议院反托拉斯和垄断小组委员会的主席(这一委员会也被称为 “科夫沃委员会”)。1959年,科夫沃委员会出台了一份报告,谴责医药行业通过重复研究和微不足道的分子修饰来创造新的可申请专利但治疗上等效的产品。在某种程度上来说,就是 salami-slicing 和常青化的组合拳策略。然而,科夫沃议员的这一初衷并未得到议会的支持——在出台的过程中,那些与之相关的条款最后并未被写入。
salami-slicing 和常青化策略让我们看到,基于发病率或者患病人群的罕见病定义实际上可能会带来一系列的问题。换而言之,如果只提供定义,而对孤儿药所独有的优惠条件和审核机制不加以监管和更新,可能有一天,所有的疾病都可以被切割成罕见病,而所有的药都会成为孤儿药。
更值得重视的是,在罕见病的对立面并不仅仅只有常见病,还有被忽视的疾病(neglected diseases)。被忽视的疾病主要发生在经济极不发达的地区,同样也是因为无法盈利的原因,没有药厂愿意生产药物来解决问题。早在1985年,美国孤儿药法案出台之后不久,关于被忽视疾病的问题就已经被提出 [20]。
直到2007年,在几位学者的研究发现支持下,美国推出了针对被忽视疾病的 “优先审查凭证”(priority review voucher)计划。根据该计划,为治疗或预防16种被忽视热带病之一的产品获得FDA上市许可的公司,有权获得优先审查凭证。这一凭证可以由获得者用于未来任何产品的申报,即便该公司自己不使用 ,也可以按市场价格出售给另一家企业。2012年,在时任总统奥巴马的批准之下,优先审查凭证资格范围扩大到罕见的儿科疾病;后在2016年又扩大到 “医疗对策产品”,即那些可以用于应对突发公共卫生事件、恐怖袭击或自然灾害所需的药品、疫苗和医疗器械 [21]。
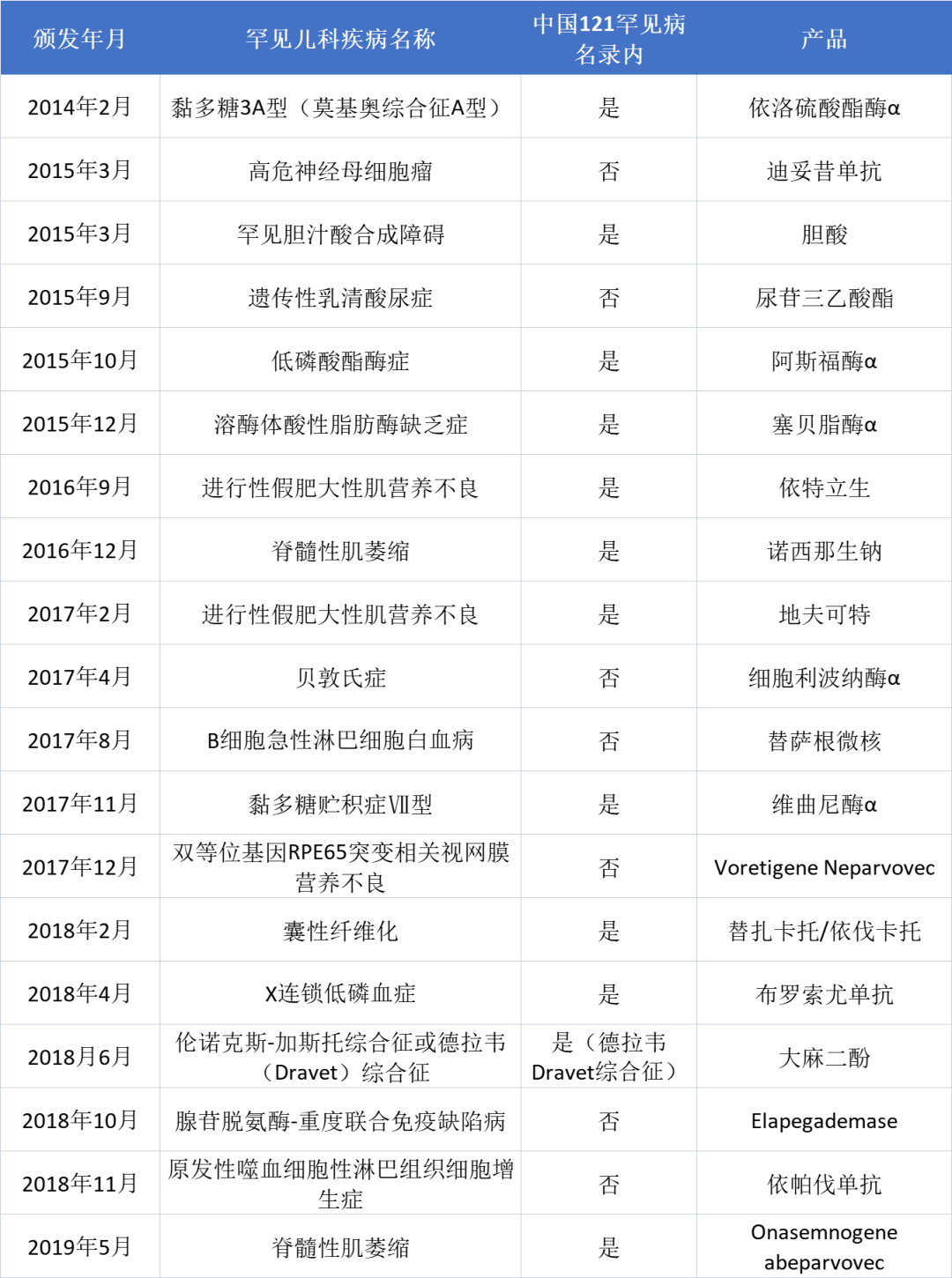
即便实践中存在一定的局限性,不可忽视的是,这一计划的绝妙之处在于将被忽略疾病、罕见病和常见病三者的利益绑定在一起。从2014年到2019年,FDA共授予31个药获得该凭证,其中有10个药是针对被忽视疾病的(例如,登革热、疟疾、抗药性肺结核等),19个是针对罕见儿科疾病的(例如,黏多糖、Dravet 综合征、进行性肌营养不良和脊髓肌萎缩症等,参见下表)[22]。
表1以罕见儿科疾病用药而获得优先审查凭证的产品名单(2014-2019)
至此,罕见病和孤儿药对于常见病的启示才变得无比的具体和现实。
结 语
历史告诉我们,孤儿药未必一直都是无人问津,罕见病也未必永远都会罕见。归根到底,人才是疾病的本体,而本体的存在与感受才是真实所在。如果没有弗兰西斯·凯尔西的坚持,世界上也许会出现更多不幸的 “海豹症” 患儿;如果没有 Abbey Meyers 的灵机一动,在女厕所里与FDA的官员讨价还价,把罕见病定义的门槛提高到20万人,那可能今天就会有很多的 “罕见病” 患者无法获得 “孤儿药” 研发者的重视;如果不是全世界所有受罕见病影响的人一起努力,不停 “鼓与呼”,那今天,一个平凡的2月28日,就不会成为国际罕见病日。2022年,国际罕见病日的主题是 “分享你的生命色彩”。在全球3-4亿受罕见病影响的人群中,你能看见TA们的生命色彩吗?
作者简介
董咚,香港中文大学赛马会公共卫生及基层医疗学院助理教授、香港中文大学深圳研究院罕见病真实世界数据研究实验室负责人,自2014年开始专注于与罕见病相关的真实世界数据研究,现任北京病痛挑战公益基金会理事。
北京病痛挑战公益基金会是专注支持罕见病群体的公益基金会,致力于通过病友服务、社会创新、公众倡导等,解决罕见病群体的迫切问题,为其建立平等、受尊重的社会环境。
参考文献:
[1]Gouw, A. M., Pal, L. R., Varon, D., Fumagalli, D. C., & Chacko, A. (2019). Rare Disease Genomics and Clinical Diagnostics. Genomics and Clinical Diagnostics, Chapter 8; 212.[2]Nguengang Wakap, S., Lambert, D. M., Olry, A., et al. (2020). Estimating cumulative point prevalence of rare diseases: analysis of the Orphanet database. European Journal of Human Genetics, 28(2), 165-173.. [3]Angelis A, Tordrup D, Kanavos P. Socio-economic burden of rare diseases: A systematic review of cost of illness evidence[J]. Health Policy,2015,119(7):964-79[4]“A rare disease is any disease that affects a small percentage of the population. In some parts of the world, an orphan disease is a rare disease whose rarity means there is a lack of a market large enough to gain support and resources for discovering treatments for it, except by the government granting economically advantageous conditions to creating and selling such treatments.” [5]Denis A., Simoens S., Fostier C, Mergreat L, and Cleemput, I. (2009). Policies for Orphan Diseases and Orphan Drugs. [6]Rägo, L. and Santoso, B. (2008), “Drug Regulation: History, Present and Future”, in van Boxtel, C. J., Santoso, B. and Edwards, I. R. (eds.), Drug Benefits and Risks: International Textbook of Clinical Pharmacology, 2nd Edition, Amsterdam: IOS Press.[7]Mikami, K. (2019). Orphans in the market: the history of orphan drug policy. Social History of Medicine, 32(3), 609-630.[8]Shirkey, H. (1999). Editorial comment: therapeutic orphans. Pediatrics, 104(Supplement_3), 583-584.[9]Asbury, C. (1985). Orphan Drugs: Medical versus Market Value. Lexington, MA: Lexington Books[10]Wexler, A. (2010). Stigma, history, and Huntington's disease. The Lancet, 376(9734), 18-19.[11]Interagency Task Force on Significant Drugs of Limited Commercial Value, Significant Drugs of Limited Commercial Value: Report of Interagency Task Force to the Secretary of Health, Education, and Welfare, 29 June 1979.[12]关于孤儿药法案出台背后的故事,著述众多,在此就不展开了。有兴趣的读者可以阅读由Abbey S. Meyers 授权病痛挑战基金会免费提供下载的著作《孤儿药:一个全球性的运动》[13]叶壬高.蚕豆病[J].中级医刊,1957(6):8-8.[14]李兆基 ,王晋泉 ,邹宜昌 ,李宝实.咽鼓管异常开放症并非罕见病[J].解放军医学杂志,1965(01):45-46.[15]Walshe, J. M. (1975). Drugs for rare diseases. British Medical Journal, 3(5985), 701.[16]Hutchinson J. Abstract of the Oration on the Clinical Uses of Rare Diseases[J]. The Lancet, 1889, 133(3429): 974-976.[17]俞镔. (2020). 药物基因组学: 指导常规用药的精准工具. 中国当代儿科杂志, 22(11), 1143-1148.[18]Gibson, S., & von Tigerstrom, B. (2015). Orphan drug incentives in the pharmacogenomic context: policy responses in the US and Canada. Journal of law and the biosciences, 2(2), 263–291. [19]李蓓, & 易继明. (2019). 药品专利常青化策略及应对之探讨. 科技与法律, (1), 1-10.[20]Anon. THERAPEUTIC ORPHANS, The Lancet, Volume 326, Issue 8457, 1985,[21]World Intellectual Property Organization. 促进医药技术和创新的应用——公共卫生、知识产权和贸易之间的融合: 第二版,2021年出版。[22]该表依据US Food and Drug Administration . Drug Development: FDA's priority review voucher programs: Published: January 31, 2020. <‐20‐251>. 翻译和绘制。
0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 