撰文 | 周叶斌
1月30日,中国药监局批准了两个国产新冠口服抗病毒药,分别是君实的新冠RNA复制酶RdRp抑制剂VV116(氢溴酸氘瑞米德韦,商品名民得维)与先声的3C样蛋白水解酶3CL抑制剂SIM0417(先诺特韦,与利托那韦联用,商品名先诺欣)。
这两个药物针对的靶点与一些已上市的新冠抗病毒药靶点相同——先声的先诺欣和辉瑞的paxlovid相同,君实的民得维和瑞德西韦相同,这在药物研发上增加了成功的希望。可我们也要注意,同靶点的药物不是分子相同的仿制药,在其有效性、安全性的验证上,还是要沿用新药的严格标准。
验证过的靶点,就一定是安全有效的吗?
我们经常说新药研发是一个高风险、高投入又有高回报的行业。其中高风险与高投入的本质原因是新药研发的成功率很低。而新药研发中很大一部分失败风险来自于靶点的错误。
在所有的靶点验证中,风险最低的,应该是已经有针对该靶点的分子通过了临床验证,在临床试验里显示安全有效。这次在国内获批的两个新冠口服药VV116和SIM0417都属于这种靶点已经经过临床验证的情况。
VV116的靶点是RdRp,它和默沙东的新冠口服药Molnupiravir以及吉列德的静脉注射抗病毒药瑞德西韦针对的都是相同的靶点。
Molnupiravir在三期临床试验里显示在未接种疫苗的高危人群里,确诊5天内服药,降低转重症以及死亡风险30%[1]。而在类似的人群里,瑞德西韦在一个562人的临床试验里显示降低转重症以及死亡风险87[2]。这两项临床证据无疑验证了RdRp作为新冠抗病毒药的靶点的可行性。
而SIM0417的靶点是3CL,与辉瑞的Paxlovid靶点相同。Paxlovid在三期临床试验里显示在未接种疫苗的高危人群中降低转重症以及死亡风险89%,后续真实世界跟踪显示在接种过疫苗的高危人群也能降低住院率68%[3-4]。这些也让3CL作为靶点得到了充分的验证。
但是得到过充分验证的靶点,安全的是那个靶点,以及那些验证过的药物。针对同一个靶点开发的新药分子,仍然是全新的分子,需要当作一个新药来谨慎求证其有效性和安全性。不能认为出生即自带安全有效的光环。
回顾新药研发的历史,会发现即便针对的是同一个靶点,不同的药物分子仍然可能有不同的表现,甚至会出现有的分子成功,有的分子失败的“奇事”。
所以我们一定要明确即便是针对同一个靶点,甚至在分子上相似性都非常高,不同的分子仍然是不同的分子,只有经过完善的验证才能明确该分子在治疗某个疾病上的安全性、有效性。这和仿制药不同,仿制药是同一个分子,可以只要证明和原研药有生物等效性,外加生产质量上过关,我们就可以认为它和原研药一样,都可以互换。
打个比方,一对同卵双胞胎,他们基因组几乎完全一样,长得外人也看不出区别。但是我们不能说其中一个考上了清华,清华就可以给另一个也发录取通知书。要考虑到一样的基因组不代表最后各方面的表型完全一样,甚至在外貌这个表型一致的时候,也不代表学习成绩方面就一样。
我们必须要把这对双胞胎当作两个独立的个体来看待。新冠抗病毒药也是一个道理。VV116和SIM0417,它们针对的靶点经过良好验证,这是靶点的事情,我们需要看它们本身经过了什么样的验证,有什么样的数据支持。
VV116已公布的数据说明了什么?
获批的两个国产新冠口服药中,VV116公布数据相对较多。2021年的一篇论文介绍了VV116的筛选、合成过程,也显示了在体外细胞实验与动物模型里抑制新冠病毒的作用[5]。
VV116从分子上看是基于瑞德西韦前体改造的氘代药物,所以它不仅是针对RdRp这个已经获得验证的靶点,分子上还非常类似。这种类似性可以进一步降低研发上的风险。不过VV116还是一个独立于瑞德西韦的分子,理论上的风险低不代表最后结果一定不会差。
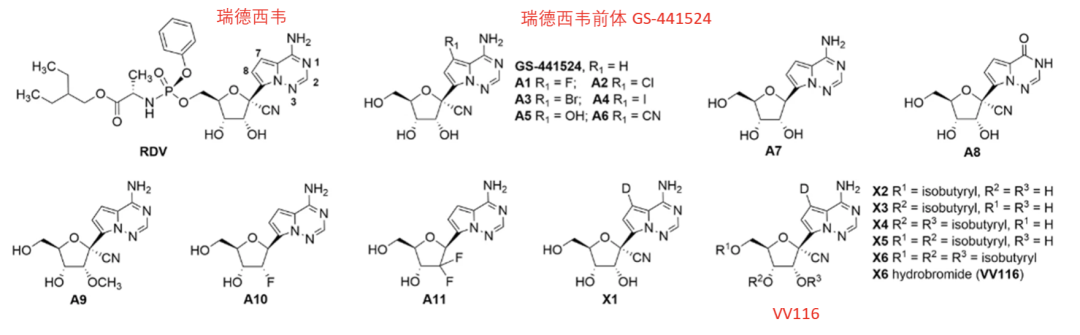
附图. VV116是基于瑞德西韦前体GS-441524做的氘代药物(来源:引文5)
VV116的化学分子和瑞德西韦的一个前体GS-441524非常像,采用的氘代分子改造方法,既是改善药物在体内的代谢特征,也往往用于规避专利保护。
可是我们要想一下,为什么吉列德要去做瑞德西韦,不直接用GS-441524这个前体。有部分不同说法,有些说是瑞德西韦专利保护期更长,这可能有一定道理。但是吉列德的科学家也发表过一些论文,谈过瑞德西韦的研发思路以及为什么没有开发GS-441524。
其实真正抑制新冠病毒复制的分子,既不是瑞德西韦也不是GS-441524,而是这两个分子细胞内经酶催化形成的ATP类似物,即下图里的1-TP[6]:
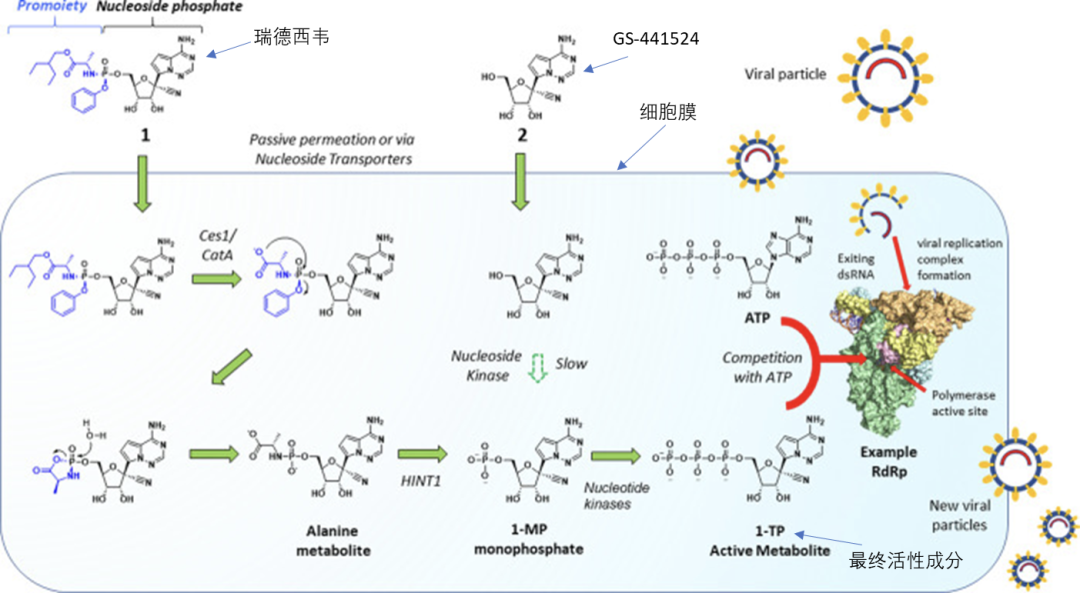
瑞德西韦最终活性成分(1-TP)的代谢过程(来源,引文6)
吉列德根据以往丙肝药物的研发经验,得出的结论是从GS-441524到1-TP的转化过程效率很低,因此用GS-441524做药很难用合理的剂量做到有效抑制病毒。做成瑞德西韦绕开了GS-441524到1-TP这一步,能在更低的剂量下在肺部等组织形成较高的1-TP浓度。
当然也有科学家持不同的观点,不少人注意到GS-441524在一种猫冠状病毒引起的猫传染性腹膜炎里效果似乎不错,因此认为GS-441524做进一步的口服优化也能用于治疗新冠。吉列德也发表过GS-441524口服优化改造的论文。
回到VV116身上,即便是验证过的靶点,在动物模型里显示出抑制新冠病毒的能力,我们仍然需要寻找人体内真实有效的数据。
VV116目前公布的三期临床试验是与Paxlovid的非劣性研究[7]。可是在这项非劣性研究里,比较的是症状持续缓解时间,我们不确定在症状持续缓解时间上,Paxlovid是否优于安慰剂,因此,当VV116在这一点上无论是优于或不劣于Paxlovid,都很难推导出VV116本身有效性如何。
如果我们看VV116的头对头试验招募人员特征,会发现它更像是Paxlovid失败的EPIC-SR试验,即在接种过疫苗但有高危风险因素的人群里的一个临床试验。在EPIC-SR中,Paxlovid在连续4天症状缓解这一主要终点上与安慰剂没有区别,在转重症风险上有更低的趋势[8]。
结合后来真实世界里显示Paxlovid降低接种过疫苗的高危人群住院风险,可以看到,如果和Paxlovid做头对头比较,真正有意义的终点应该是降低重症风险。症状缓解方面,与Paxlovid相似或更优,没法确认药物的有效性。
不同的3CL抑制剂还是存在不同
先声的SIM0417没有公布详细数据,这个药的另一个代号是SSD8432。在Pubmed检索均未找到发表的论文,只有少数论文在提到有这样一个3CL药物在研发中。对于一个获批上市的药物来说比较令人意外。
从该药也需要和利托纳韦联用来看,推测或许在化学结构上与Paxlovid的抗病毒成分Nirmatrelvir相似。
先声的SSD8432登记在clinicaltrial.gov的临床试验有4项,两项显示在招募的均为一期剂量探索。SIM0417登记的临床试验有三项。一项在健康人群中的药物代谢分布研究已经完成,另一项药物冲突研究还在进行但没有在招募,最后一项预计招募1200人的2/3期有效性安全性研究显示估计的初步完成时间是2023年1月31日[9]。该研究的主要终点是与安慰剂比,11项新冠症状的综合指数出现连续两天缓解时间。
根据媒体报道,SIM0417与利托纳韦联用,在1208例轻到中症新冠成人患者中,相比安慰剂,11项新冠症状首次达到持续恢复时间约1.5天,其中重症高风险亚组人群显著缩短约2.4天;用药后第5天,病毒载量对比安慰剂最大下降超96%;核酸转阴时间较安慰剂组缩短约2.2天[10]。
这应该是那项预计招募1200人的2/3期临床试验,当然,这类新闻通稿不会经过同行评议,也无法看到评判药物有效性、安全性所需的细节。
SIM0417是全世界第三个被批准的3CL抑制剂。除了Paxlovid外,日本在2022年11月22日批准了本国药企盐野义研发的ensitrelvir。仅比较有数据正式发表的Paxlovid与ensitrelvir,也会发现不同的3CL抑制剂还是有所不同。
Paxlovid的三期临床试验共招募了2246人,1120人使用了Paxlovid。而ensitrelvir在日本获批是基于一项69人的2a期临床试验,一项341人的2b期临床试验以及一项1821人的三期临床试验[11]。
Paxlovid是的三期临床试验是在未接种疫苗的高危人群中显示大幅降低住院风险。
ensitrelvir的临床试验不同,招募的大部分是接种过疫苗的人,三期临床甚至没有要求是高危人群。在两个2期试验里分别做了两个剂量125毫克与250毫克,均显示能降低载毒量,加速核酸转阴,不过在2b试验里原先设计的12项新冠症状改善时间上与安慰剂组无区别[12]。后续分析显示如果看5项呼吸系统症状,用药组改善速度更快,这也成了三期临床试验的指标。从通报的三期临床试验结果来看,比较5项呼吸系统症状,用药组改善时间是167.9小时,安慰剂组是192.2小时,差别为24小时[13]。
由于招募人群、试验终点不同,我们很难比较直接ensitrelvir与Paxlovid。不过值得注意的是在2022年7月,日本的专家委员会拒绝推荐当时在二期临床试验中显示载毒量降低且5项症状改善占优的ensitrelvir,认为需要更多数据[14]。
如今越来越多国产抗病毒药的注意力集中到了载毒量下降、核酸转阴上。如果我们看Paxlovid的三期临床试验,确诊三天内用药的受试者,第五天载毒量下降比安慰剂多0.868 log10。
ensitrelvir在三期临床里是第四天比安慰剂下降多1.4 log10,比Paxlovid下降更多。
根据新闻稿,SIM0417联用利托纳韦后第五天载毒量比安慰剂组下降多1.43 log10。但在2a临床试验里,ensitrelvir的125毫克与250毫克组载毒量下降分别为1.49与2.81 log10,到了2b试验里分别为1.30与1.21 log10,效果变差了。
可见不同研究里由于受试者的情况不同,载毒量变化会有差异,很难通过不同研究的载毒量推断药物有效性。
最终能参考的还是这些药物在各自的三期临床试验、真实世界跟踪里明确的有效性。例如Paxlovid有降低重症风险的作用,而根据ensitrelvi发表的论文与SIM0417的新闻稿,二者似乎是缓解轻症症状的速度。
因此,不同的3CL抑制剂,不能混淆有效性。更不能混淆的是不同分子的安全性。ensitrelvir曾经因为在高剂量动物实验里显示对胚胎骨骼发育有负面影响被质疑过[14]。在这方面受影响更大的是molnupiravir,由于一些动物实验中高剂量的致突变性风险,被严格限制了使用场景。
对于新药,我们还想看到更多的数据
综合上述的分析,我们可以看到每一个新药都是一个独立的分子,即便是针对已经由别的药物分子验证过的靶点,靠谱的是那个靶点,不是其它针对该靶点的分子。这些分子需要像任何新药一样,在上市前接受严格的有效性、安全性论证。新冠口服药也不应例外。
当一个新冠口服药获批时,我们需要思考这个获批是用什么样的数据来支持的,其中公开的数据是什么,获得过什么样的检验,是否符合一般抗病毒药上市的标准。
以新冠药物为例,FDA批准过的单克隆抗体,临床试验的安全性数据(同一药物所有临床试验使用了最终批准剂量、疗程的受试者人数)从700-2100人以上不等,molmupiravir超过900人[15]。Paxlovid仅三期临床试验中用药组的安全性数据就超过1000人。
相比之下,VV116公布的与Paxlovid头对头研究中,完成跟踪的VV116受试者人数不到400人。
此外,无论是molnupiravir,Paxlovid还是ensitrelvir在获批前都有不少研究文献发表,前两个在获批时也通过药监部门公布了大量临床试验数据。当一个获批的药物在文献检索里一片空白,主要的信息来源是公司新闻稿时,这种数据公开程度,是否恰当?
当然,或许随着进一步的研究,我们能看到更完善的数据,例如先声在新闻稿里表示在今后会发表三期临床试验结果,而君实的VV116也在进行更大规模的研究。
根据clinicaltrial.gov上的信息,VV116还有两项正在招募受试者的三期临床试验,一项计划招募1310人,试验终点包括转重症比例与症状改善时间,另一项计划招募1200人,终点为症状改善时间[16]。
另外,从药品研发的角度看,开发已验证过的靶点的新药确实降低了靶点本身不靠谱的风险。可是后来者也要面对先行者巨大的先发优势。
目前在中国以外的全球新冠口服药市场中,Paxlovid和molnupiravir两分天下。这两个药是可以找出很多缺点,但现在它们积累了大量的真实世界有效性数据量。同靶点的后来者要有一席之地,需要的不仅是理论上的“好”,而是扎实完善的数据。
有些情况下,一些药物会因为主场优势获得优待,例如ensitrelvir虽然一开始被日本专家们拒了,可三期临床试验初步结果出来后还是获得了紧急使用授权。日本政府也很大方,在获批前就给了150万的订单。但这个药离开主场,遇到的挑战就多了不少。
如果一个药,仅仅只在一个地方获批,对背后的药企来说是限制了发展,对这个地方的人来说也有数据不足的问题。
参考文献:
1.https://www.nejm.org/doi/full/10.1056/NEJMoa2116044
2.https://www.nejm.org/doi/full/10.1056/NEJMoa2116846
3.https://www.nejm.org/doi/full/10.1056/NEJMoa2118542
4.https://www.nejm.org/doi/full/10.1056/NEJMoa2204919
5.https://www.nature.com/articles/s41422-021-00570-1
6.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8887656/
7.https://www.nejm.org/doi/full/10.1056/NEJMoa2208822
8.https://www.pfizer.com/news/press-release/press-release-detail/pfizer-announces-additional-phase-23-study-results
9.https://clinicaltrials.gov/ct2/show/NCT05506176?term=SIM0417&draw=2&rank=3
10.https://news.yaozh.com/archive/38392.html
11.https://www.shionogi.com/global/en/news/2022/11/e20221122.html
12.https://pubmed.ncbi.nlm.nih.gov/36477182/
13.https://www.shionogi.com/global/en/news/2022/09/20220928.html
14.https://www.bioworld.com/articles/521042-shionogis-covid-19-antiviral-pill-fails-again-to-impress-mhlw-panel-for-conditional-approval
15.https://www.fda.gov/media/154473/download
16.https://www.clinicaltrials.gov/ct2/results?cond=&term=VV116&cntry=&state=&city=&dist=
0
推荐



 京公网安备 11010502034662号
京公网安备 11010502034662号 