撰文 | 唐金艺
责编 | 叶水送
新冠抗体可以在体内存在多久一直是人们关心的问题。近日,多项聚焦新冠抗体动力学变化的研究陆续公布,在此笔者一一进行解读和总结。以期让我们能清晰地了解,即使有了新冠疫苗,其诱导的抗体能为我们提供长期保护吗?
在这之前,先回顾一下此前的两种高致病性冠状病毒严重急性呼吸综合征冠状病毒(SARS-CoV)和中东呼吸综合征冠状病毒(MERS-CoV)的抗体反应。
一、冠状病毒引起的长效抗体不稳定?
在 SARS-CoV 感染出现症状后的第4天即可在血清中检测到抗体,随后在10-16天抗体水平持续升高,在症状出现后的15-20天达到顶峰 [1,2,3],此后一直维持在比较高的水平,直至3到4个月后开始下降,但2年后仍然可以检测到比较高水平的抗体反应,然而在3年后仅剩一半的人可以检测到 SARS-CoV 抗体,6年后则基本都检测不到 [3,4]。
也有研究表明5年以后 SARS-CoV 抗体水平仍然很高,且有的康复患者在长达13年后仍然可以检测到低水平的抗体 [5,6]。这表明 SARS-CoV 感染诱导的长效抗体反应实际上很不稳定,可能和感染病毒的量和疾病严重程度有关。
但可以肯定的是,虽然抗体水平随着时间的流逝而逐渐降低,但绝大多数人在1到2年的抗体水平是比较高的,其中和性(即抗体与病毒相互作用后使病毒生物活性丧失)也与抗体滴度显著相关。
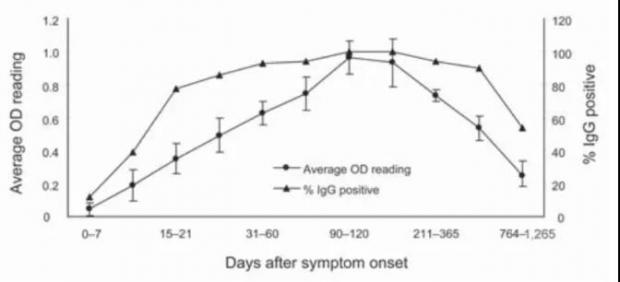
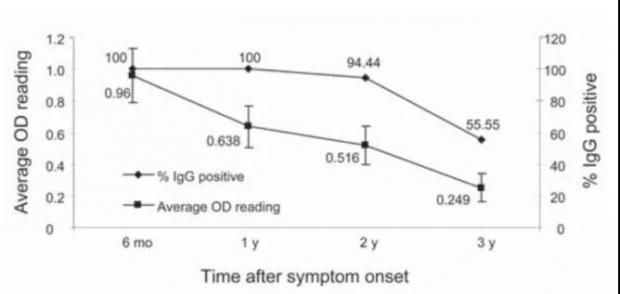
感染后不同时间的SARS-CoV抗体反应。图源参考文献[3]
MERS-CoV 康复患者的大部分在感染后2到3周后可以检测到抗体,随后抗体水平在一段时间内趋于稳定,重症患者在2到3年后仍能检测到抗体反应,而轻症患者的抗体2年后则会下降至较低滴度或检测限以下 [7,8,9]。
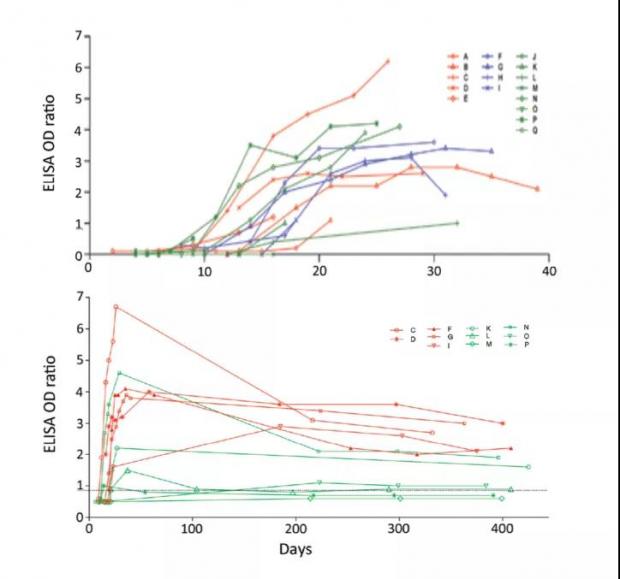
感染后不同时间的MERS-CoV抗体反应。图片改编自参考文献[8,9]
二、新冠抗体约一个月后达到顶峰,随后缓慢下降
新冠病毒(SARS-CoV-2)感染的早期抗体反应与 SARS-CoV 相似,此前的研究表明,少部分 SARS-CoV-2 感染的患者出现症状后的2到4天即可在血清中检测到抗体,随后滴度持续升高,所有患者在出现症状后的2到3周均能检测到抗体 [10,11]。在约3到4周后到达顶峰,随后出现缓慢下降趋势 [12]。
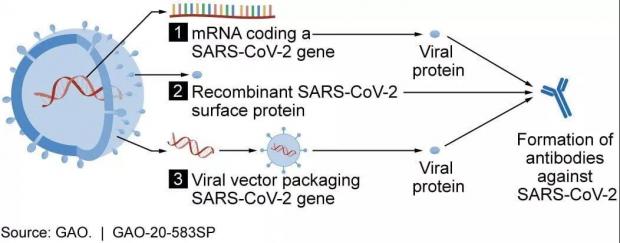
新冠疫苗制备的原理,图片展示了三种方法途径,图片来自covidvax.news
但伦敦大学圣乔治分校领衔的一项对177名新冠肺炎(COVID-19)患者的研究显示,有2%到8.5%的患者在两个月内均未出现抗体反应 [13]。研究人员认为这些患者可能存在其他的免疫反应机制,如通过T细胞免疫或其他抗原诱导的交叉免疫反应来清除病毒。
另一个可能的解释是,轻微感染可能只发生在呼吸道的黏膜细胞上,诱导了局部免疫反应,没有引起全身性的体液免疫。同时该研究也表明,绝大部分出现抗体的患者其抗体水平在近两个月内保持稳定 [13]。
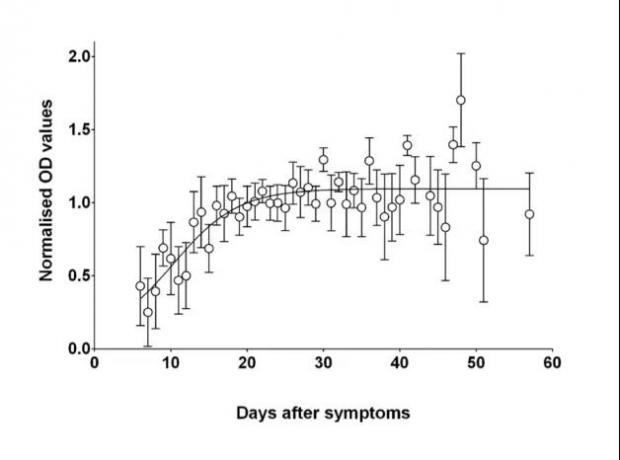
感染后不同时间的SARS-CoV-2抗体反应。图片来源参考文献[13]
伦敦国王学院对65名 COVID-19 患者的研究显示,几乎所有患者在症状出现后的3周内出现抗体,在1个月后达到顶峰,随后开始缓慢下降 [14]。这一现象与早期的研究一致。研究者继续追踪发现,3个月后虽然抗体滴度较峰值有所下降,但仍处在较高水平。抗体中和性也有所下降,少数 ID50(抑制50%感染时的血清滴度)峰值低(<300)的患者会下降到检测限以下。此外,研究者发现抗体的滴度和中和性与疾病的严重程度显著相关,但其动力学变化与疾病严重程度无关。
随后,重庆医科大学和加拿大血液供应商 Héma-Québe 分别公布了各自的抗体研究结果 [15,16],前者对173名 COVID-19 患者的研究结果分析后发现,在出现症状最开始的7到10天,抗体滴度较低,随后在2到3周内增加,约1个月到达顶峰后开始缓慢下降,3个月后大部分患者的抗体中和水平均有所下降,但绝大多数抗体的ID50值仍大于300 [15]。后者通过对15名多次捐献血浆的康复患者进行追踪,发现抗体在症状发生后的76天左右保持稳定,随后开始下降,少数康复患者的抗体在100到110天后会下降到检测限以下 [16]。这两项结果也与之前的研究一致。
同一时间,西奈山伊坎医学院从西奈山卫生系统筛选出19763名血清中抗体阳性(≥80)的 COVID-19 轻中症患者进行抗体分析,建立数据集,这也是笔者目前为止看到的样本最大的血清学研究 [17]。研究根据抗体的滴度进行分类,1:80或1:160定义为低滴度;1:320定义为中滴度,也是血浆治疗所需的最低滴度;1:960或≥1:2880定义为高滴度。
在19763名患者中,1448(7.33%)人为低滴度;4391(22.23%)人为中滴度;13913(70.43%)人为高滴度,在高滴度组中,有6272(30.75%)人为1:960,7641(38.68%)人为1:2880。该研究表明,该地区九成以上的轻中症患者的抗体峰值滴度可以达到血浆治疗的标准。
三、血清中的抗体浓度,决定其抗病毒能力
随后研究者进一步证实抗体滴度与其中和性显著相关,与此前的多项研究一致。其中,高滴度抗体能完全中和病毒,中滴度抗体能中和90%的病毒,低滴度抗体仅能中和约50%的病毒。
重要的是,研究者追踪121名康复患者后发现,出现症状后的30天和82天抗体相比,任意初始水平的抗体滴度均没有显著变化,这也说明抗体可能在近3个月内的滴度保持相对稳定。加州大学洛杉矶分校的研究则表明,轻症患者的抗体在73天后会下降至最高滴度的一半 [18]。另一项麻省总医院的研究表明中和抗体在4周左右到达顶峰,随后开始缓慢下降,在75天后仍有很高水平的中和活性,中和活性与抗体滴度相关 [19]。伦敦大学学院和厦门大学也分别得到了相似的结论,并且认为抗体将会在体内维持1到2年 [20,21]。华中科技大学对武汉首批感染的349名患者(包括最早于2020年1月1日感染)进行追踪,发现直至目前(半年后),大多数抗体仍稳定在比较高的水平 [22]。
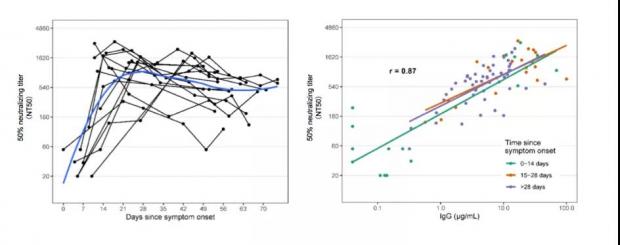
感染后不同时间的SARS-CoV-2抗体中和性(左)以及滴度与中和性的关系(右)。图片改编自参考文献[19]
7月20日,两项 COVID-19 的重组腺病毒载体疫苗的最新临床试验公布,均显示在接种后28天有九成以上的受试者体内出现高滴度的中和性抗体 [23,24]。该结果与上述 SARS-CoV-2 自然免疫的结果相似,但目前 SARS-CoV-2 特异性中和抗体的持久性和保护性仍然未知。
四、新冠疫苗能否带来长期保护?
基于目前已公布的多项研究结果,我们对 SARS-CoV-2 特异性抗体的动力学变化有了一个初步的认识:早在出现症状后的2到4天(由于潜伏期长,此时SARS-CoV-2可能已经感染1到2周),即可在部分患者中检测到抗体,随后在2到3周内抗体滴度持续增加,1个月左右到达顶峰,随后保持稳定或缓慢下降持续2到3个月,2.5到3个月后下降至约最高滴度的一半,少数抗体反应较弱的患者抗体则会下降至检测不到的水平。6个月后仍能在大多数患者中检测到抗体,此后继续缓慢下降,可能持续1到2年。抗体的滴度与中和性和疾病严重程度显著相关,与抗体的动力学变化以及血浆捐献次数无关。
抗体滴度随着时间降低并不奇怪,截至目前暂无更长时间的抗体数据,接种疫苗后,即使抗体水平持续下降,也可以通过加强免疫等方式提高抗体滴度。除此以外,T、B细胞形成的特异性免疫记忆更为重要,如果自然感染或疫苗免疫能够形成有效且持久的免疫记忆,那么在下次感染时,记忆细胞会识别相应抗原,迅速分化形成浆细胞,快速产生抗体以保护机体免受病毒感染。研究表明,SARS-CoV-2 感染或接种疫苗均能诱导强效的细胞免疫反应,且 SARS-CoV 感染的康复患者17年后在体内仍然能检测到 SARS-CoV 特异性的T细胞 [23,24,25,26],这暗示 COVID-19 患者很可能也存在长效的免疫记忆。
新冠病毒不像狂犬病毒,后者能够在感染后迅速入侵神经系统,免疫记忆来不及产生抗体实施保护作用,所以狂犬疫苗只能依赖抗体提供保护;新冠病毒也不像流感病毒易突变导致记忆细胞无法识别。所以依赖免疫记忆的新冠疫苗对于长效保护来说可能相对更可靠。目前仍待解决的问题:1)长效抗体的保护性如何; 2)抗体和记忆细胞的持久性如何。这些问题只能等待时间给我们答案。
作者简介
唐金艺,中国科学院上海巴斯德研究所博士研究生
参考文献
1. Hsueh PR., et al. Chronological evolution of IgM, IgA, IgG and neutralisation antibodies after infection with SARS-associated coronavirus. Clin Microbiol Infect. 2004 Dec;10(12):1062-6.
2. Lee N., et al. Anti-SARS-CoV IgG response in relation to disease severity of severe acute respiratory syndrome. J Clin Virol. 2006 Feb;35(2):179-84.
3. Wu LP., et al. Duration of antibody responses after severe acute respiratory syndrome. Emerg Infect Dis. 2007 Oct;13(10):1562-4.
4. Tang F., et al. Lack of peripheral memory B cell responses in recovered patients with severe acute respiratory syndrome: a six-year follow-up study. J Immunol. 2011 Jun 15;186(12):7264-8.
5. Wang H., et al. Follow-up study on serological detection of anti-SARS-CoV IgG/IgM antibody and its significance. Infectious Disease Information 2009:235-7.
6. Guo X., et al. Long-Term Persistence of IgG Antibodies in SARS-CoV Infected Healthcare Workers. MedRxiv 2020.02.12.20021386.
7. Park WB., et al. Kinetics of Serologic Responses to MERS Coronavirus Infection in Humans, South Korea. Emerg Infect Dis. 2015 Dec;21(12):2186-9.
8. Choe PG., et al. MERS-CoV Antibody Responses 1 Year after Symptom Onset, South Korea, 2015. Emerg Infect Dis. 2017 Jul;23(7):1079-1084.
9. Payne DC., et al. Persistence of Antibodies against Middle East Respiratory Syndrome Coronavirus. Emerg Infect Dis. 2016 Oct;22(10):1824-6.
10. Adams ER., et al. Antibody testing for COVID-19: A report from the National COVID Scientific Advisory Panel. MedRxiv 2020.04.15.20066407.
11. Long QX., et al. Antibody responses to SARS-CoV-2 in patients with COVID-19. Nat Med. 2020 Jun;26(6):845-848.
12. Robbiani DF., et al. Convergent antibody responses to SARS- CoV-2 in convalescent individuals. Nature. 2020 Jun 18.
13. Staines HM., et al. Dynamics of IgG seroconversion and pathophysiology of COVID-19 infections. MedRxiv 2020.06.07.20124636.
14. Seow J., et al. Longitudinal evaluation and decline of antibody responses in SARS-CoV-2 infection. MedRxiv 2020.07.09.20148429.
15. Wang K., et al. Longitudinal dynamics of the neutralizing antibody response to SARS-CoV-2 infection. MedRxiv 2020.07.14.20151159.
16. Perreault J., et al. Longitudinal analysis of the humoral response to SARS-CoV-2 spike RBD in convalescent plasma donors. BioRxiv 2020.07.16.206847.
17. Wajnberg A., et al. SARS-CoV-2 infection induces robust, neutralizing antibody responses that are stable for at least three months. MedRxiv 2020.07.14.20151126.
18. Ibarrondo FJ., et al. Rapid Decay of Anti–SARS-CoV-2 Antibodies in Persons with Mild Covid-19. NEJM. 2020; (published online July 21.)
19. Lyer AS., et al. Dynamics and significance of the antibody response to SARS-CoV-2 infection. MedRxiv 2020.07.18.20155374.
20. Grandjean L., et al. Humoral Response Dynamics Following Infection with SARS-CoV-2. MedRxiv 2020.07.16.20155663.
21. Yao XY., et al. Neutralizing and binding antibody kinetics of COVID-19 patients during hospital and convalescent phases. MedRxiv 2020.07.18.20156810.
22. Wu J., et al. SARS-CoV-2 infection induces sustained humoral immune responses in convalescent patients following symptomatic COVID-19. MedRxiv 2020.7.21.20159178.
23. Zhu FC., et al. Immunogenicity and safety of a recombinant adenovirus type-5-vectored COVID-19 vaccine in healthy adults aged 18 years or older: a randomised, double-blind, placebo-controlled, phase 2 trial. Lancet. 2020; (published online July 20.)
24. Folegatti PM., et al. Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial. Lancet. 2020; (published online July 20.)
25. Juno JA., et al. Humoral and circulating follicular helper T cell responses in recovered patients with COVID-19. Nat Med. 2020; (published online July 13..)
26. Bert NL., et al. SARS-CoV-2-specific T cell immunity in cases of COVID-19 and SARS, and uninfected controls. Nature.2020; (published online July 15.)
0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 