阅读:0
听报道
撰文 | 荔 枝(美国知名药厂研究员) 责编 | 叶水送
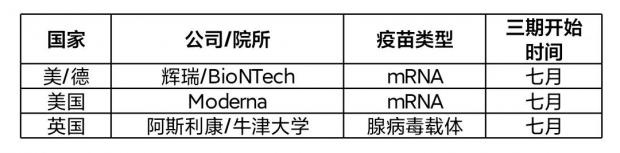
目前,在欧美国家开发的新冠疫苗中,正在进行三期临床试验的有三种,分别由辉瑞/BioNTech、Moderna 以及阿斯利康/牛津大学来开发,如果这三家今天坐一块吃饭,那场面应该会很有意思。
他们会谈论哪些话题,对新冠疫苗的研发策略会有哪些议论?
美国FDA局长在谈论新冠疫苗,图片截自abc
1 辉瑞:傲视群雄,一路稳 “扎” 稳 “打”
风头最劲的,当属老大哥辉瑞和 BioNTech。他们联合开发的 mRNA 疫苗目前三期试验进展顺利,预计未来一周内将实现3万人的入组目标。
高处不胜寒。这两家公司刚刚发布消息,说我们还可以提高难度,向药监局申请增加人数,争取获得更多的安全性和有效性数据。
加多少?他们伸出4个指头。
加44个人?
不,是加到4万4千人。
具体做法包括增加试验人群的种族多样性,将年龄下限从18岁降至16岁,并收入患有某些慢性疾病的人群,如艾滋、甲肝、乙肝等。
即便加大了难度,辉瑞 CEO Albert Bourla 表示自己之前说的仍然作数,即十月底将有足够数据进行有效性验证。
Bourla 就是美国的刘敬桢。国药集团的两款新冠灭活疫苗一路高歌猛进,董事长刘敬桢豪言十月底看到三期结果,年底上市,一时风光无两。

辉瑞CEO Albert Bourla 和国药集团董事长刘敬桢 图源:cnbc.com / bjnews.com
Bourla 的表态和刘敬桢如出一辙。不同的是国药的疫苗在国内已经开始了紧急使用,辉瑞的疫苗只有等到满意的三期结果出来之后才有可能被授权紧急使用。
虽然美国药监局时不时咳两声,表示什么都要通过我的火眼金睛,但在特朗普眼里,这张紧急使用授权已经在路上了。9月4日的白宫新闻发布会上,特朗普就点名表扬了 Bourla,说这个家伙可厉害了,十月份就能让很多人来上一针。
虽然被特朗普点名表扬其实不是很多人的梦想,但辉瑞和 BioNTech 这款疫苗目前在欧美国家中确实傲视群雄。基于 BioNTech 的 mRNA 技术,两家公司一开始送了4款疫苗进入临床,最后选出效果和安全性最好的一款进行三期试验,一路稳扎稳打,如今在欧美国家已经走在了最前面,极有可能拔得头筹,同时还为mRNA技术实现零的突破。
这款疫苗已经获得了美国政府19.5亿美金的合同,订单量一亿剂。当初美国政府还想再出一笔钱资助疫苗的开发,辉瑞说没事,我们不要,收了这个钱就得什么事都商量着来,耽误功夫。
2 Moderna:起个大早赶个晚集,试验被要求放慢脚步
大哥就是大哥。同样在做mRNA疫苗的小弟 Moderna 就没有这个底气。它不仅签了15亿美元的合同(一亿剂),还收了10亿美元的研发资助。结果三期试验开始前,公司和美国国立卫生院的人在试验方案上谈不拢,导致试验开始日期推迟了不少。
要知道,他们打算做新冠病毒的mRNA疫苗可是在1月中旬的时候,彼时新冠肺炎还没有大流行,也没有几个人知道这一新型的冠状病毒。
Moderna 是美国最早开始一期临床的,但是现在三期落在了辉瑞后面。在大哥面前 Moderna 很低调,说我最近决定放慢脚步,思考一下人生。近期,该公司被批评三期试验中少数族裔人数不够多,而少数族裔恰恰是新冠感染率和重症率较高的人群。于是 Moderna 决定放慢入组速度,优先考虑少数族裔。如此一来,完成三期的日子就难免要往后再挪一点。
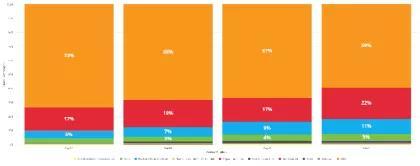
Moderna三期试验志愿者族裔分布在过去四周的变化。少数族裔比例呈升高趋势。(橙色代表白人,其他颜色从上到下依次为拉丁裔,非裔,亚裔等)图源:Moderna
Moderna 此举既出于必要,也包含些许无奈。出于覆盖高风险人群的考虑,确实应该保证少数族裔的入组比例。但是美国的少数族裔,尤其是非裔,参与临床试验的热情向来不高。这里面有相关知识普及程度的关系,但更主要的原因,是不信任,而这个不信任是有深远的历史渊源的。
在美国奴隶制时期,有大量黑奴被用来进行惨无人道的人体试验,堪比日军 “七三一” 部队在中国犯下的罪恶行径。即使到了20世纪,这一罪恶仍未停止,最臭名昭著的是跨度长达40年的 Tuskegee 梅毒实验。
从上世纪30年代到70年代,美国公共卫生局以提供免费医疗为诱饵,诱骗阿拉巴马州600名黑人佃农加入一项 “医学研究”,其中大部分是梅毒患者。研究的真实目的是观察梅毒在未接受治疗的情况下如何发展,但受试者对此毫不知情。研究人员甚至不对患者透露他们患的病其实是梅毒,以免他们寻求治疗。
患者被告知自己患有某种血液疾病。研究人员用欺骗性手段让患者误以为自己在接受 “治疗”。后来部分患者参加征兵体检时被查出患有梅毒,这些研究人员竟然阻止他们获得治疗。
这些黑人农民一直被跟踪观察了40年。直到1972年公共卫生局内部研究人员将此事曝光,“研究” 才被终止。
有这样的历史伤痛,非裔美国人十分排斥临床试验。即使是现在的新冠疫苗临床试验,也面临着难以说服非裔人群参加的窘境。
但是来自两方面的压力,让药企不得不努力增加少数族裔的入组比例。一是前面提到的科学原因,确保试验对象包含足够的高风险人群;另一方面,也受到美国目前烈火燎原的民主平权运动影响。Moderna 就被抗议者要求在三期试验中提高少数族裔比例。
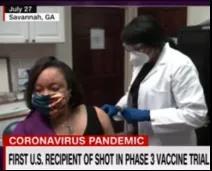
Dawn Baker,佐治亚州的一名新闻主播,是Moderna三期试验的第一名志愿者。她多次发声,鼓励非裔美国人积极参与这项临床试验。图源:CNN
3 阿斯利康:三期试验被按下暂停键,暂时只有英国为其开绿灯
Moderna 的经历有些坎坷不平,阿斯利康的神情最近则略显憔悴,这几天更是体验了一把过山车似的人生。
阿斯利康和牛津大学共同开发的腺病毒载体疫苗三期试验已经注册了近两万人,但是9月6日突然按下暂停键,起因是一名英国的志愿者出现了 “不明原因” 的神经疾病,症状疑似横贯性脊髓炎。这种病可能由自身免疫系统攻击脊髓而引起,以前有过因疫苗接种而导致该病的零星案例。
这就不是一般的不良反应了。按照标准程序,阿斯利康应立刻暂停全球的三期试验。经确认,该志愿者打的针确实是疫苗,不是安慰剂。各国的独立安全委员会对该案例进行了审查,以核实上述症状是否由疫苗引起。
9月12日,好消息传来。英国安全委员会开了绿灯,说我这边没问题了,英国的试验可以继续。不过具体调查结果稍后才会公布,而其他国家则仍在审查中。
世卫组织也适时地敲了敲黑板,说这个案例给全世界提了个醒,疫苗开发道路千万条,安全第一条,试验不规范,亲人两行泪。
凭心而论,这个案例其实是给全世界上了一堂临床试验扫盲课:当我们谈论临床试验时,我们在谈些什么?你以为是 “轻舟已过万重山”,其实是 “将登太行雪满山”。经过一/二期试验筛选出安全的剂型和剂量后,三期试验仍将是一个充满挑战的历程,这也正是三期的意义所在。
新冠疫情让很多人知道了还有临床试验一二三期这回事。阿斯利康这次的不良反应又让人知道了临床试验不是请客吃饭。
碰上不良反应,你以为是 “黑云压城城欲摧”,其实是 “也无风雨也无晴”。不论结果如何,都是临床试验的家常便饭。
目前,各个疫苗的临床试验报道的不良反应多数为轻度或中度,如注射部位酸胀、头痛、发烧、体寒、无力等,持续时间也很短暂,这些即属于之前广为媒体报道的一个说法:“没有明显的不良反应”。
而碰上重度不良反应,会有一套既定的规范操作。就像这次阿斯利康亲身演示的:暂停试验、独立审查。如果不是疫苗的原因,试验继续。如果不幸确由疫苗引起,那就具体情况具体分析,不管是盖棺定论,还是有继续试验的余地,这都是临床试验的常态。
2014年,美国默克公司的埃博拉疫苗(Ervebo)在进行一期试验的时候就经历了一次暂停,原因是多名志愿者出现关节疼痛症状。这一疫苗使用一种动物病毒作为载体,和今天的腺病毒载体疫苗原理相似。调查发现疫苗的病毒载体侵入了志愿者的关节组织。于是研究人员大幅降低剂量,然后重启了试验。该疫苗于2019年获得批准。
阿斯利康这次暂停就相当于在路上开车压到一块大石头下意识踩了一脚刹车。实际上,这是阿斯利康踩到的第二块石头,其 CEO Pascal Soriut 坦白了另一件事,今年7月他们也观察到一例神经疾病,暂停试验后发现是多发性硬化症,也是一种自身免疫系统对神经进行攻击引起的疾病,但好在调查显示和疫苗无关,试验得以继续。奇怪的是,那次暂停在当时并未对外披露。
最近的这次暂停之后,面对投资者的质询,Soriut 很委屈,说临床试验本来就这样,平时哪有这样的阵仗,全世界都在盯着你看。
消息披露的当天,阿斯利康的股价有小幅下跌(2%),算不上过度反应,说明大部分投资者对三期试验的期望还是理性的。可惜中国的康泰生物不幸躺枪,股价暴跌17%。康泰生物是阿斯利康在中国的合作伙伴,不久前与阿斯利康达成协议,为其生产面向中国内地的新冠疫苗。
目前,各国进入三期临床的9种疫苗,今天看来都很有希望,但变数仍然存在。
在这场病毒与人类的战役中,战争逐渐进入到尾声,在敌我双方的战略意图已经无比明显的情况下,这个时候我们对胜负的预判已经没有任何意义了,只有拼命地打下去,打到枪声停下来的那一刻,才是最后的结果。
参考资料
1. https://www.fda.gov/media/139638/download
2. https://mp.weixin.qq.com/s/7J-xC0uGwTcoE7JcQZ0rzw
3. https://www.cnbc.com/2020/09/04/moderna-slows-coronavirus-vaccine-trial-t-to-ensure-minority-representation-ceo-says.html
4. https://www.modernatx.com/cove-study
5. https://www.cnbc.com/2020/09/12/pfizer-proposes-expansion-of-late-stage-coronavirus-vaccine-trial.html
6. https://www.fiercepharma.com/vaccines/pfizer-could-see-early-efficacy-data-for-coronavirus-vaccine-late-october-ceo
7. https://www.statnews.com/2020/09/12/pfizer-and-biontech-announce-plan-to-expand-covid-19-vaccine-trial/
8. https://www.whitehouse.gov/briefings-statements/remarks-president-trump-press-briefing-september-4-2020/
9. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2608128/pdf/jnma00387-0030.pdf
10. https://www.nytimes.com/2020/09/12/health/astrazeneca-coronavirus-vaccine-trial-resumes.html
11. https://www.cnbc.com/2020/09/13/coronavirus-pfizer-vaccine-could-be-given-to-americans-before-end-of-year-ceo-says.html
12. https://www.cnbc.com/2020/09/09/covid-19-vaccine-trial-participant-had-neurological-symptoms-astrazeneca-ceo-says.html?__source=Facebook
13. https://www.forbes.com/sites/russellflannery/2020/09/09/china-drug-makers-shares-plunge-on-astrazeneca-vaccine-pause/#492c79337036
14. https://www.astrazeneca.com/media-centre/press-releases/2020/covid-19-vaccine-azd1222-clinical-trials-resumed-in-the-uk.html
15. https://en.wikipedia.org/wiki/Tuskegee_Syphilis_Study
话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。



 京公网安备 11010502034662号
京公网安备 11010502034662号 