阅读:0
听报道

- 导 语 -
昨日,针对新型冠状病毒的药物瑞德西韦(remdesivir)刷爆了朋友圈,它的出现被认为可能改变当下新冠病毒感染无药可医的局面。2月3日,该药将在中国进行临床三期试验,招募的患者数量为270名,试验预计4月27日结束。
中国国家药品审评中心首席科学家钱家华表示,虽然临床试验预计4月底结束,但如果效果好的话,可以提前结束。“希望临床试验设计时考虑到这一点,比如提前设计期中分析或适应性设计。依据前期试验所得数据调整后续试验方案,以便及时发现与更正试验设计一些不合理的假设或者缩短研究周期。”
在如此缺药的情况,为何还要做临床试验?“因为该药在世界任何一个国家都沒有获批,截至2月1日,沒有在中国开展临床试验,美国FDA不公开IND(指临床研究申请)期间研究进展,该药在美国做的结果我们也不知道。”钱家华解释说。今天,瑞德西韦获中国国家药品评审中心受理。
然而,根据《新英格兰医学杂志》2月1日的报告结果,瑞德西韦只对一例新冠状病毒肺炎患者有潜在的效果,对于SARS冠状病毒和MERS病毒的结果,此前更多是基于细胞和动物实验的效果。它能否带来一线希望?
撰文 | 叶水送 责编 | 陈晓雪
01 在研药物仅“治疗”了一名患者,但扭转疫情非常迫切
截至2020年2月2日7点38分,国内新型冠状病毒肺炎确诊人数为14411例,疑似病例为19544例,治愈人数328例,死亡为304例。确诊人数与疑似病例的总和,已经是2003年全球非典确诊病例的4倍。
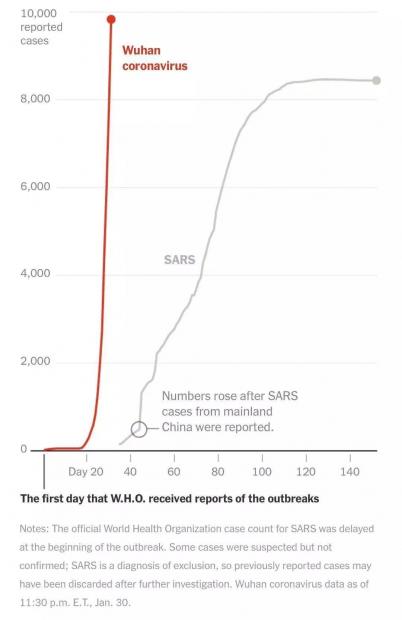
新型冠状病毒感染人数与SARS感染人数发展趋势的对比
突袭而来的新型冠状病毒疫情,一时间不仅扰乱了我们正常的生活秩序,还带来了不小的恐慌,更多的人的生命和健康遭到威胁。
然而,对于这一病毒,目前“无特效药,只能对症支持治疗”,国家卫生健康委员会1月28日发布的《新型冠状病毒防护指南》显示。1月29日,世界卫生组织发布的信息指出,“到目前为止,还没有专门用于预防和治疗新型冠状病毒的药物”。美国FDA以及美国疾控中心等权威机构也认为,暂无有效药物。
对于那些感染病毒的确诊患者,只能“接受用于缓解和针对症状的治疗,而病情严重的患者应得到针对其所有病症的最佳的支持性治疗”。
然而最近的一则研究显示,新型冠状病毒无药可医的现状可能会改变。

2020年2月1日,美国《新英格兰医学杂志》报道了美国首例确诊新型冠状病毒肺炎患者成功治愈的病例。
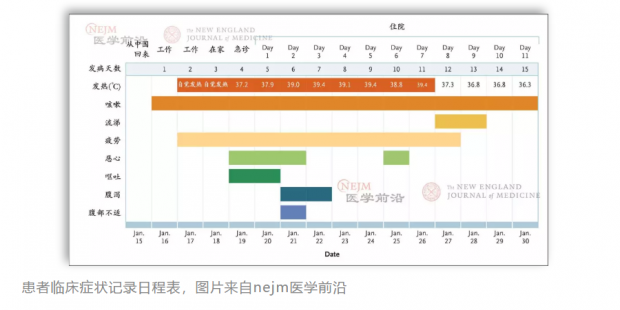
患者为35岁的男性,从武汉探亲返回美国后发病入院。医生一开始采取保守治疗,协助患者控制症状,后在治疗无进展且患者病情恶化的情况下,给予了他在研药物瑞德西韦,对其进行静脉输注,仅一两天患者就有临床获益,不再需要吸氧,目前 “无发热,除咳嗽改善比较缓慢外,所有其他临床症状均消退”。
瑞德西韦是一种处于研发阶段的核苷酸类似物,此前被美国制药公司吉利德科学用于非典型性肺炎(SARS)和中东呼吸综合征(MERS)的治疗,显示有活性。但瑞德西韦并未获得美国FDA的上市批准,由于美国有同情用药法案,于是在这名重症患者身上,经FDA批准使用了这一未获批上市的药物。
同情用药在何时以及何种情况下使用?钱家华表示,“在有临床注册的情况下,同情使用对一例病人是可以的。治疗SARS和MERS的药,如果要治一例新型冠状病毒患者,机制类似,FDA会同意,一般打电话就可以。医生给FDA直接负责该药临床注册的办公室打电话,当时就能批准。当然还需要一些工作,可后续再补充。美国FDA的临床医生都是24小时值班的。这是紧急情况,临时的、只有这一例或少数病人是可以批准的”。
尽管患者在使用瑞德西韦后病情发生了好转,但论文作者表示,“需要通过随机对照试验来确定remdesvir及用于治疗2019-nCoV感染患者的其他试验性药物的安全性和疗效。”
02 国内临床试验明天开启
瑞德西韦是一种处于研发阶段的核苷酸类似物,此前被美国领先制药公司吉利德科学用于非典型性肺炎(SARS)和中东呼吸综合征(MERS)的治疗均显示有活性。由于新型冠状病毒与SARS、MERS病毒同属于冠状病毒科,因此该药物新型冠状病毒有类似的抑制作用。
至于该要为何之所迟迟未审批下来,主要是后来SARS和MERS病毒消失后,该药面临没有患者的尴尬处境。瑞德西韦的出现为新型冠状病毒疫情的扭转带来一丝希望。
目前,国家卫健委已与吉利德科学取得了联系,双方都有意愿进行下一步的合作。

1月31日,吉利德科学全球首席医疗官Merdad Parsey博士代表公司发表声明,表示“吉利德正在配合中国的卫生部门开展一项随机、对照试验,以确定使用瑞德西韦治疗新冠病毒感染者是否安全和有效。”吉利德科学也对此项试验予以大力支持。
2月1日,上海市公共卫生临床中心党委书记、卫健委专家组卢洪洲教授在接受《上观新闻》时表示,“目前,专家组已写好方案及申请,并汇报上级部门,同时与吉列德公司直接联系。从美国同行的研究来看,这一药物的临床疗效立竿见影,基于以往 remdesivir 在 MERS 病毒治疗领域亦有突出表现。一旦获准,相关部门也将开通绿色通道引入药物,受益我国病人”。

2月2日,瑞德西韦获得国家药品评审中心受理。
2月3日,瑞德西韦治疗新型冠状病毒的临床试验将在北京中日友好医院启动,这项3期、随机、双盲、安慰剂对照试验由中日友好医院主任医师曹彬牵头,总样本量270例,入组轻、中度新冠肺炎患者。试验预计在4月27日结束。
“尽管目前没有抗病毒数据显示 Remdesivir(瑞德西韦)对于新冠病毒的活性,但其针对其它冠状病毒的有效数据给了我们希望。”Parsey博士表示。
03 瑞德西韦的作用机理是怎样的
瑞德西韦是一个小分子药物,由吉利德科学开发,该公司是一家位于美国加利福尼亚州以研发抗抗毒药物而著称的生物制药公司,此前开发出重磅药物索非布韦,不仅让广大的丙肝患者获益,也为其带来了数百亿美元的收益。
2014年,埃博拉病毒在西非肆虐,其50%的致死率,相信很多人即使不在非洲,也对此病毒心有余悸。当时对埃博拉病毒也是无药可医。应美国政府的特别请求,吉利德科学开始研发出了瑞德西韦,希望能够对抗埃博拉病毒。该药早期显示了对抗埃博拉病毒有良好的效果,但在2019年年中“被抛弃”,主要是由于它不及同类抗击埃博拉病毒抗体药物。不过,瑞德西韦在抗击冠状病毒方面表现良好。
Parsey 博士介绍,“在体外和动物模型中,瑞德西韦证实了对SARS病毒和MERS病毒病原体均有活性,它们也属于冠状病毒,且与新冠病毒在结构上非常相似。”
瑞德西韦是如何抵抗冠状病毒的?熟悉此药的 Assembly Biosciences 副总裁&首席科学官(中国)黄琦介绍,“这是一个类核酸抑制剂,直接抑制RNA病毒的RdRp(转录酶),可导致病毒复制能力下降”。
然而,除了美国35岁的新型冠状病毒患者外,瑞德西韦此前没有对新型冠状病毒进行任何试验,对于冠状病毒SARS和MERS病毒的结果,更多是基于细胞和动物实验的疗效。瑞德西韦是否会成为冠状病毒的广谱抑制剂,我们拭目以待。
“RNA病毒的转录酶活性区域比较保守,各种冠状病毒之间差别不大。抗病毒药体外细胞的结果还是能比较好预估临床表现的。” 黄琦表示。
04 药品效果还需临床试验验证
根据瑞德西韦在国内的注册信息,临床试验2月3日开始,4月27日结束。
“虽然说到4月份,如果效果好的话,经常药效果好会提前结束的。就像青霉素一样,作用会立竿见影,我也希望它是这样的药。”国家药品审评中心首席科学家钱家华对《知识分子》表示。
当下如此缺药,为何国家卫健委还要吉列德来在国内做临床试验?另外,国内也有几个潜在的药物正准备应用于患者,能不能像美国那样,对患者使用“同情用药”,满足其临床需求?
“我自己觉得卫健委这一步做得非常对,因为这个药此前在中国没报过临床注册,它在美国做了试验,结果我们也不知道。”钱家华表示。
“我觉得还是应该慎重一点,在广泛地使用之前,面对错综复杂的人群,不同的年龄、不同的生病背景,还是应该在中国的新型冠状病毒患者身上试一下,而且中国有这么多病人,会很快出来结果。“钱家华补充道,“按照世界卫生组织的公告现在对于治疗冠状病毒没有效药,做临床试验是正确道路,不管是国外,还是国内的药,不管是西药还是中药,一视同仁。”
钱家华此前介绍,为控制新型冠状病毒感染肺炎疫情,科研机构和制药公司也在加紧抗新冠病毒的研发;从疫苗、抗血清、降解酶抑制剂、病毒核酸复制酶抑制剂、中成药到肠道益生菌群的合并用药。
“目前,艾伯维(Abbvie)和强生(J&J)的已经批准治疗艾滋病药物以合并用药形式应用于2019-nCoV患者的治疗 ,国内企业也在加紧研发抗新冠病毒的药物。我们拭目以待。”钱家华表示。

话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。




 京公网安备 11010502034662号
京公网安备 11010502034662号 