阅读:0
听报道
导 读
早在3000多年前,希腊人围攻特洛伊城,久不能破,谋士们决定智取。在一次攻城后,希腊军佯装撤退后留下一只木马,特洛伊人将其当作战利品带回城内。当特洛伊人歌舞升平庆祝胜利时,埋伏在木马中全副武装的希腊兵杀死了睡梦中的守军,打开了城门迎接城外接应的军队,轻松拿下防守了十年之久的特洛伊城。
实际上,这一伎俩癌细胞早就熟稔于心,而且比人类的军师还玩得溜,它们的计谋是如何做到滴水不漏的?靠的就是外泌体。那么,癌细胞是如何借助外泌体攻破人类生存的底线?
癌细胞胃口这么好,如何釜底抽薪 “饿死” 它们?
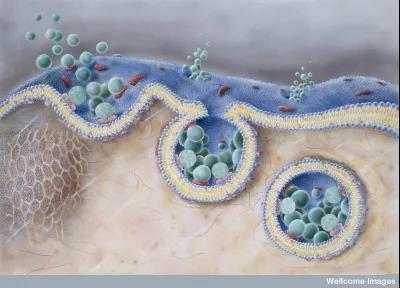
图片来自wellcome images
撰文 | 丁 零
责编 | 叶水送
外泌体(Exosomes)是细胞分泌的直径为30-200nm的膜包裹结构,早在上世纪六十年代就有记载 [1]。30多年前, Bintao Pan 等在研究血细胞成熟过程中也发现了外泌体 [2],当时认为外泌体只是帮助细胞丢弃不需要的细胞成分。接下来十年里,外泌体只能忍辱负重,戴着“细胞的垃圾箱”的高帽子。
21世纪以来源源不断的证据表明,这些垃圾箱其实是 “快递小哥”,有着将信息投递到身体各个组织的重大使命。
值得推敲的是,癌细胞的 “快递” 数目远远高于正常细胞。诡计多端的癌细胞究竟在秘密地撺掇什么阴谋?
从细胞 “垃圾桶” 到明日之星的华丽转身
外泌体是由多泡小体和细胞膜结合后释放到细胞外的一种膜泡。但凡细胞这个大仓库储存的,包括各种核酸、蛋白、脂肪等,只要有订单,无论风雨外泌体都尽职尽责把它投递出去。
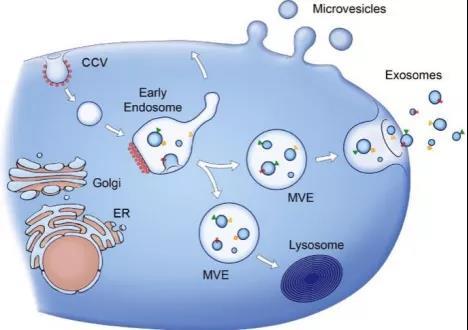
图一:外泌体释放示意图,图片来源:J Cell Biol, 2013. 200(4): p. 373-83.
1985年,研究者在探索网织红细胞向成熟红细胞转变过程时发现,多泡小体与细胞膜融结合后,可以将携带转铁蛋白(transferrin)及其受体的小囊泡释放到细胞外 [2]。但在接下来的11年中,外泌体被打入冷宫,无人问津 。
直到1996年,外泌体的伯乐Raposo发现B淋巴细胞等免疫细胞释放的外泌体携带了引发免疫应答至关重要的膜结合分子 [3]。两年后, Zivogel 等发现了另一种外泌体分泌细胞类型:树突细胞,其外泌体可携带功能性免疫分子促进小鼠抗肿瘤反应 [4]。这些里程碑式研究肯定了外泌体在细胞间通讯中不可忽视的作用,并促进其临床应用的探索 [5]。
得益于高通分析技术的发展,外泌物快递的包裹陆续被打开,其运输货物一览无遗(图二)。
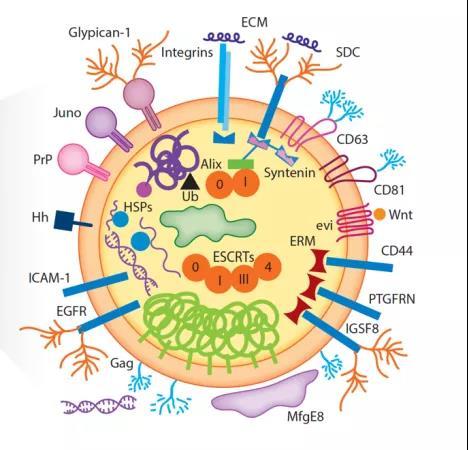
图二:外泌体蛋白示意图(非穷尽),图片来源:Annu Rev Biochem. 2019 Jun 20;88:487-514.
有意思的是,某些特定细胞,比如免疫细胞,受到外界挑衅时会释放与 “岁月静好” 时期截然不同的外泌体。这些特殊蛋白的具体作用还有待破解,但显然是肩负着秘密使命。
在日复一日,年复一年的快递工作中,机智的外泌体还发明了一种省时省力的物流模式。
如果直接运输蛋白质这种大包裹,会增添运输的难度。2007年,瑞典 Jan Lötvall 团队发现外泌体可将 mRNA 运输到目的地,再启动 “翻译” 程序生产蛋白 [6]。这就好比一个任性的买主要求快递一架飞机,在快递公司没有航空母舰的情况下,只能把飞机零件运送过去,再配送几个能组装飞机的工程师。
除了 mRNA 外,外泌体还可以运输微小RNA(miRNA),直接影响目标细胞的基因表达 [7]。那 miRNA 又是何方神圣?
如果是一支部队,mRNA就是一个小兵的角色。外泌体把mRNA送到目标细胞以后,这个小兵就开始扎营劳作,生产蛋白质。但miRNA就好比一个将军,进入目标细胞后,统筹帷幄,指挥成百上千mRNA的工作,从而精细调控蛋白生产线以及细胞功能。
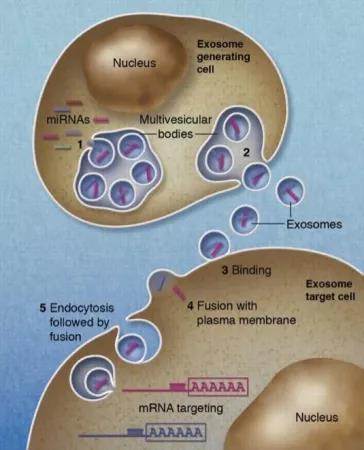
图三:外泌体传递miRNA,图片来源:Blood, 2012. 119(3): p. 646-8
外泌体如何上演 “特洛伊木马计”
外泌体利用 “打包式” 通讯手段,比广为人知的单分子(比如激素、细胞因子)传输显然更加有效。细胞中最最精明的癌细胞又是如何打着外泌体的算盘呢?
2017年年底发表的一篇综述总结了癌症领域外泌体研究的大事件 [8]。从时间轴密度来看,伴随着对外泌体重视程度的增高,近年突破性研究有大幅度提升(图四)。
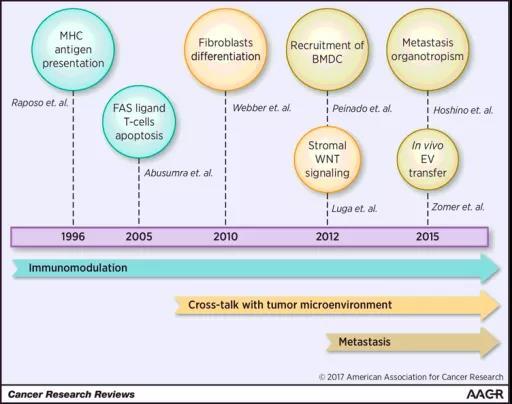
图四:癌症外泌体历史事件,图片来源:Cancer Res. 2017 Dec 1;77(23):6480-6488.
癌细胞的特诺伊木马计划包括发配外泌体到 “国内战场” 以及 “国际战场” [9]。国内战场指的是原发肿瘤(Primary tumor)区域,而国际战场便是进军到其他器官,这个过程叫癌转移(Metastasis)。
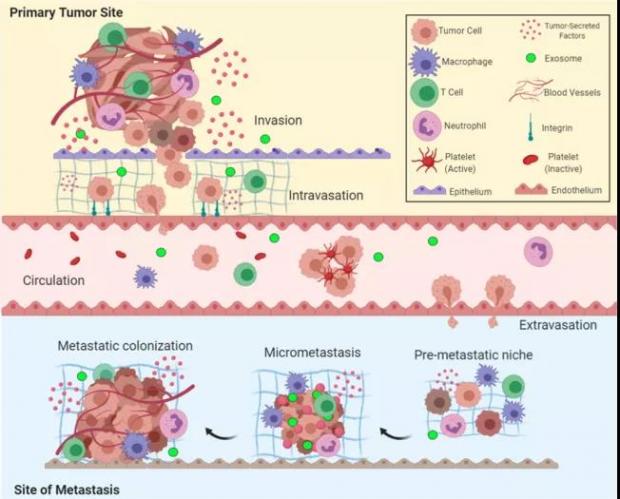
图五:癌转移五个关键步骤:侵袭、内渗、循环、外渗和形成转移灶,图片来源:Signal Transduct Target Ther. 2020 Mar 12;5(1):28
原发瘤区域的癌细胞部队有两大重要任务:第一是保证自身的野蛮生长;第二是为转移做好准备。为达到这两大目的,癌细胞对内要做好人力资源管理,对外要充当外交官的角色和邻里打好关系以备不时之需。而外泌体便是很重要的通讯员。
人力资源这块工作,癌细胞可谓得心应手,它们又是如何利用外泌体这得力助手呢?癌细胞和正常细胞很重要的区别就是癌细胞属于绝对的 “超生游击队”。为了将让队伍所有同志们响应 “超生” 指示,“超生先进分子” 会慷慨把自己的高繁殖秘诀,比如变异表皮生长因子受体,通过外泌体分享给 “落后分子”,从而达到全民超生的繁荣景象 [10,11]。
作为优质的外交官,癌细胞处理国际问题也依靠外泌体这名大将,如癌细胞可释放含有 TGF-beta 的外泌体,成功将成纤维细胞(Fibroblast)转化为成肌纤维细胞(Myofibroblast),而成肌纤维细胞为了达成友好建交,卖力地分泌生长分子和趋化因子帮助肿瘤生长以及转移 [12]。
另一方面,在面对 “反抗分子” 时,癌细胞坚决实施铁腕政策,利用外泌体将活化的表皮生长因子受体(EGFR)运输到巨噬细胞,从而抑制巨噬细胞先天的战斗力 [13]。
最可恶的是外泌体还能帮助癌细胞运输 PD-L1。
众所周知,PD-L1 和其受体 PD1 的相互作用能抑制T细胞的免疫反应。本来PD-L1长在癌细胞上,空间的局限性多多少少给了T细胞逃逸的机会。但癌细胞穷追不舍,还派出外泌体携带 PD-L1,一方面进行远程攻击 [14],一方面在循环系统里拦截 PD1/PD-L1 抑制剂等药物攻击肿瘤细胞 [15]。
因其具备长途运输的功能,可想而知,外泌体在癌转移中也发挥着关键作用。事实上,外泌体的多篇重磅研究都和癌转移有关。其中最具影响力的当属外泌体领域大神 David Lyden 团队2015年发表在《自然》杂志 [16] 以及2019年发表在《发育细胞》[17]上的两篇大作。
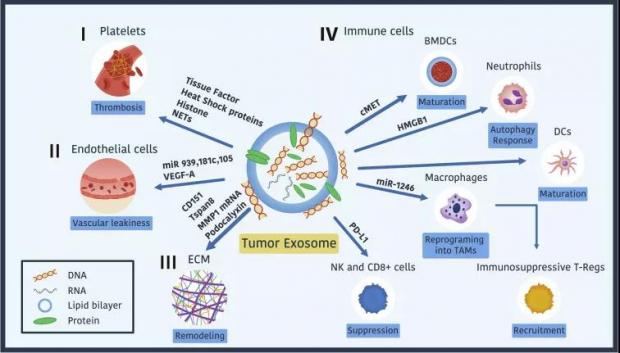
图六:癌细胞外泌体建立转移前微环境的机制,图片来源:Dev Cell, 2019. 49(3): p. 347-360
1889年,Stephen Paget 提出著名的种子和土壤(seed and soil) 理论。他发现,癌细胞转移并不是随机任性的,而是具有器官倾向性(Organotropic Metastasis)。换句话来说,就是某些原发肿瘤容易在特定的器官中产生新的病灶。比如说,乳腺癌细胞就倾向于移民到骨头、肺部和脑部。
神奇的是,转移站点如同等待种子发芽的土壤一样为癌细胞的到来创造各种有利条件。这个现象背后的机理一直都是癌症研究领域的旷世之谜。
早在2005年,David Lyden 团队发现,在癌细胞到达之前,转移站点就密布着类似分泌体的物质,貌似在为癌细胞接风。这些外泌体从哪里来的?它和癌转移又有什么关系?带着这些疑问,David Lyden 展开了十年的探索之路。
直到2015年,谜底才慢慢解开。
癌细胞在转移之前不敢贸然行事,便指使外泌体根据邮编 (一种叫整合素的跨膜蛋白),找到地址,开始改造微环境 “筑巢引凤”,使其更适合癌细胞生长。由于不同类型的癌细胞释放的外泌体携带不同的整合素,外泌体便可以选择性扎营。当癌细胞在血液或淋巴里巡逻时,发现外泌体已经建设好的地点,才指挥大部队进驻 [16]。
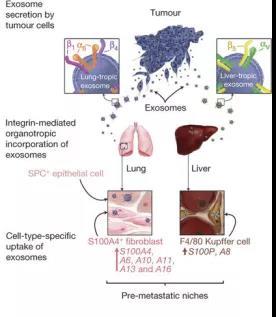
图七:外泌体调控癌转移器官倾向性机制示意图,图片来源:Nature, 2015. 527(7578): p. 329-35.
癌细胞同谋者的 “木马计”
和癌细胞一样,它的同谋们也学会了特诺伊木马这一招。
第一个出场就是上文提到的头号同谋成纤维细胞。2012年,发表在《细胞》上的文章里提到,乳腺癌相关成纤维细胞(cancer-associated fibroblasts , CAFs)分泌的含有Cd81的外泌体被乳腺癌细胞吞噬以后,能引发Wnt信号通路促使肿瘤转移 [18]。除此之外,CAFs还大方地调度了好几位miRNA大将军去辅佐癌细胞,编号分别为21, 378e, 和143 [19]。
看上去笨笨的成纤维细胞被癌细胞利用见怪不怪。万万没想到,按常理应该是足够聪明的脑细胞的一种,脑星形胶质细胞也被癌细胞给收买了,这真是实实在在的 “脑子进水”了。
2015年,余棣华教授团队发现转移到脑部癌细胞中的肿瘤抑制基因PTEN表达下调,但神奇的是,一旦离开大脑,PTEN的表达就恢复正常水平。经过进一步研究,他们发现神经系统中的星形胶质细胞能分泌携带微RNA的外泌体,进而输送到肿瘤细胞中去压制PTEN的表达 [20]。
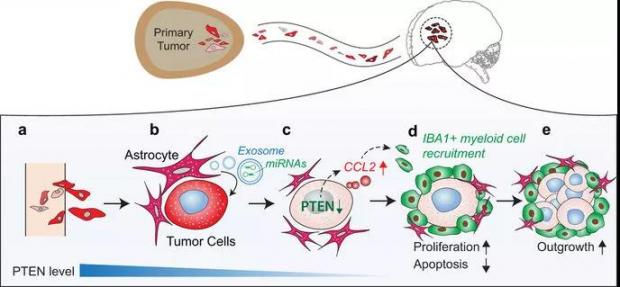
图八:肿瘤细胞和脑微环境之间的相互作用,图片来源:Nature, 2015. 527(7576): p. 100-104.
那么问题就来了。这些非亲非故的细胞为何要去帮助癌细胞?是主动还是被动的?如果是主动,癌细胞到底给了什么回扣?如果是被动的,癌细胞又用了什么伎俩?遗憾的是,这个问题迄今为止还没有一个完美的解释。
癌细胞借助外泌体试图攻破人类生存的底线。所谓 “水可载舟,亦可覆舟”,外泌体作为癌细胞精兵强将,反过来人类是不是也可以把外泌体这武器给用起来,反打癌细胞一耙呢?请见下篇:破解癌细胞的诡计。
作者简介
丁零,生物化学博士,青年写作者。曾就职霍华德·休斯医学研究所及MD安德森癌症中心,现从事咨询行业。
参考文献
1.Pegtel, D.M. and S.J. Gould, Exosomes. Annu Rev Biochem, 2019. 88: p. 487-514.
2.Pan, B.T., et al., Electron microscopic evidence for externalization of the transferrin receptor in vesicular form in sheep reticulocytes. J Cell Biol, 1985. 101(3): p. 942-8.
3.Raposo, G., et al., B lymphocytes secrete antigen-presenting vesicles. J Exp Med, 1996. 183(3): p. 1161-72.
4.Zitvogel, L., et al., Eradication of established murine tumors using a novel cell-free vaccine: dendritic cell-derived exosomes. Nat Med, 1998. 4(5): p. 594-600.
éry, C., Exosome Explosion. TheScientist, 2011.
6.Valadi, H., et al., Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nat Cell Biol, 2007. 9(6): p. 654-9.
7.Stoorvogel, W., Functional transfer of microRNA by exosomes. Blood, 2012. 119(3): p. 646-8.
8.Ruivo, C.F., et al., The Biology of Cancer Exosomes: Insights and New Perspectives. Cancer Res, 2017.
9.Becker, A., et al., Extracellular Vesicles in Cancer: Cell-to-Cell Mediators of Metastasis. Cancer Cell, 2016. 30(6): p. 836-848.
10.Gan, H.K., A.N. Cvrljevic, and T.G. Johns, The epidermal growth factor receptor variant III (EGFRvIII): where wild things are altered. FEBS J, 2013. 280(21): p. 5350-70.
-Nedawi, K., et al., Intercellular transfer of the oncogenic receptor EGFRvIII by microvesicles derived from tumour cells. Nat Cell Biol, 2008. 10(5): p. 619-24.
12.Webber, J., et al., Cancer exosomes trigger fibroblast to myofibroblast differentiation. Cancer Res, 2010. 70(23): p. 9621-30.
13.Gao, L., et al., Tumor-derived exosomes antagonize innate antiviral immunity. Nat Immunol, 2018. 19(3): p. 233-245.
14.Daassi, D., K.M. Mahoney, and G.J. Freeman, The importance of exosomal PDL1 in tumour immune evasion. Nat Rev Immunol, 2020. 20(4): p. 209-215.
15.Chen, G., et al., Exosomal PD-L1 contributes to immunosuppression and is associated with anti-PD-1 response. Nature, 2018. 560(7718): p. 382-386.
16.Hoshino, A., et al., Tumour exosome integrins determine organotropic metastasis. Nature, 2015. 527(7578): p. 329-35.
17.Wortzel, I., et al., Exosome-Mediated Metastasis: Communication from a Distance. Dev Cell, 2019. 49(3): p. 347-360.
18.Luga, V., et al., Exosomes mediate stromal mobilization of autocrine Wnt-PCP signaling in breast cancer cell migration. Cell, 2012. 151(7): p. 1542-56.
19.Donnarumma, E., et al., Cancer-associated fibroblasts release exosomal microRNAs that dictate an aggressive phenotype in breast cancer. Oncotarget, 2017. 8(12): p. 19592-19608.
20.Zhang, L., et al., Microenvironment-induced PTEN loss by exosomal microRNA primes brain metastasis outgrowth. Nature, 2015. 527(7576): p. 100-104.
话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。




 京公网安备 11010502034662号
京公网安备 11010502034662号 