阅读:0
听报道
pixabay.com
撰文 | 商 周
责编 | 计永胜
在全球新冠大流行的背景里,多个国家为研发新冠疫苗投入了大量的人力物力。截至目前,已有54种新冠候选疫苗进入临床试验阶段,另外至少还有87种正在进行临床前的动物实验 [1]。
在这些众多候选疫苗中,mRNA新冠疫苗脱颖而出,吸引了全世界的目光。
2020年11月18日,美国辉瑞(Pfizer)公司公布其和德国BioNTech公司联合开发的mRNA新冠疫苗BNT162b2的三期临床试验结果,保护效率高达95%,这意味着世界上首个完成三期临床试验的新冠候选疫苗的诞生 [1]。
在正处于研制阶段的各类新冠候选疫苗里,mRNA疫苗不仅在时间上取得了领先,还显示出远高于人们预期的保护效率。无疑,mRNA疫苗成为了这场新冠疫苗竞赛中的明星。
那么,为什么是mRNA 疫苗呢?
1 疫苗的原理和种类
当病原体(比如病毒、细菌)入侵我们身体的时候,免疫系统会作出反应,产生针对病原体的免疫细胞和分子。这些免疫细胞(比如T细胞和B细胞)和免疫分子(比如抗体)能够特异性地识别病原体,对其进行高效的打击和消灭。
得益于免疫系统的特异和高效,大多数情况下我们能够战胜病原体,拥有一个健康的身体。
除了特异性之外,免疫细胞还有记忆性。具体来说,当身体被某种病原体感染过一次之后,针对该病原体特异的免疫细胞能够长时间地在我们的身体里存在。当同一种病原体再次侵入我们的身体,这些免疫细胞就能够很快地把该病原体消灭。
正因为免疫系统拥有记忆,我们在被某种病原体感染并且痊愈之后,一般不会再被它感染发病。
疫苗就是利用了免疫系统的特异性和记忆性,采用一种安全的方式在人体内诱导出针对某种病原体的免疫反应。
那么,如何人为地去诱导针对病原体的反应呢?
首先,我们得知道 “敌人”,也就是病原体是什么。
1796年,英国人爱德华-詹纳(Edward Jenner)发明了人类历史上第一个疫苗:牛痘, 也就是针对天花的疫苗,这种疫苗的诞生导致人类历史上的第一个烈性传染病的灭绝。18世纪人类对病原微生物基本上一无所知,天花疫苗的发明更像上天赐给的礼物,因为牛痘病毒对人类来说是安全的,而且能够诱导人体免疫系统产生对天花病毒的免疫反应。
但这样的礼物极少,爱德华-詹纳的成功也很难复制。
人类对疫苗的研发进入正常的轨道,应该从法国科学家路易斯·巴斯德(Louis Pasteur)算起,就是发明 “巴氏消毒法” 的巴斯德。
1865年,法国的的蚕丝业遭受重创,因为蚕卵得了一种奇怪的病。巴斯德负责对这场蚕病的研究。通过提出假设-设计实验-实验验证,严谨、勤奋的巴斯德找到了蚕病的元凶:一种感染蚕的细菌,从而挽救了法国的蚕丝业。
利用同样的思路,巴斯德发现了导致鸡瘟的病菌。而且,巴斯德发现,这种病菌在实验室培养一段时间后毒性会自然降低。再把这种毒性降低了的病菌接种到鸡身上,鸡只会有轻微的症状,但之后就有了对这种病菌的免疫力。就是利用这个方法,巴斯德发明了针对鸡瘟的疫苗。
这就是减毒活疫苗,也是人类历史上第一种在实验室里制备出来的疫苗。和詹纳的成功很难复制不同,巴斯德的成功为人类研发疫苗铺设了一条康庄大道,越来越多的针对不同病原体的疫苗面世。
直到现在,一些常见的疫苗依然是减毒活疫苗,比如麻疹疫苗和风疹疫苗。在新冠疫苗的研发里,美国的Codagenix公司的研发人员通过对新冠病毒的基因组进行改造,产生了减毒的新冠病毒,这个减毒活疫苗目前已经进入了一期临床试验阶段。
减毒活疫苗的优势是,它们带有病原微生物的全部抗原,而且能够在身体里繁殖,所以容易激起人体的免疫反应。但减毒活疫苗的劣势也很明显,就是病原体能够在人体内繁殖,因此存在让人得病的风险,这一点对免疫力较低的人群更是如此。
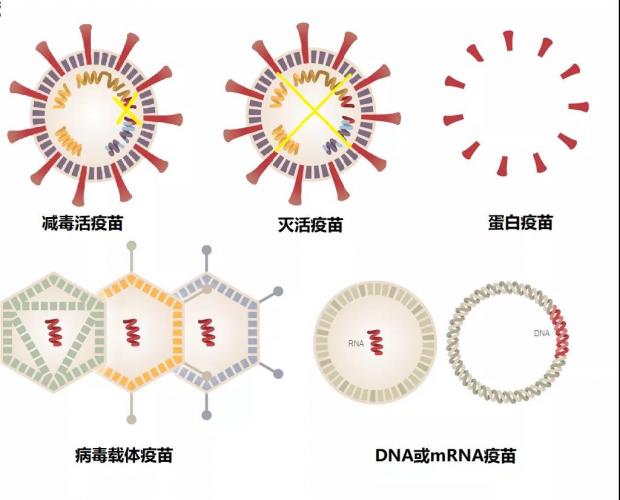
图1. 疫苗的五种常见类型 (图源:参考链接1,稍作修饰)
为了消除减毒活疫苗的风险,科研人员将病原微生物彻底杀死,然后再对人进行接种,这就是灭活疫苗。
灭活疫苗依然保留着病原体的全部抗原,可以激起人体的免疫反应。而且病原体不能在体内繁殖,所以比较安全。
在现有的常见疫苗里,狂犬病疫苗、甲肝疫苗、百白破三联疫苗等都是灭活疫苗。而正在研发的新冠疫苗,有四款灭活疫苗已经进入了三期临床试验(见下表),其中三款来自中国,分别是武汉生物制品研究所、北京生物制品研究所和科兴生物。
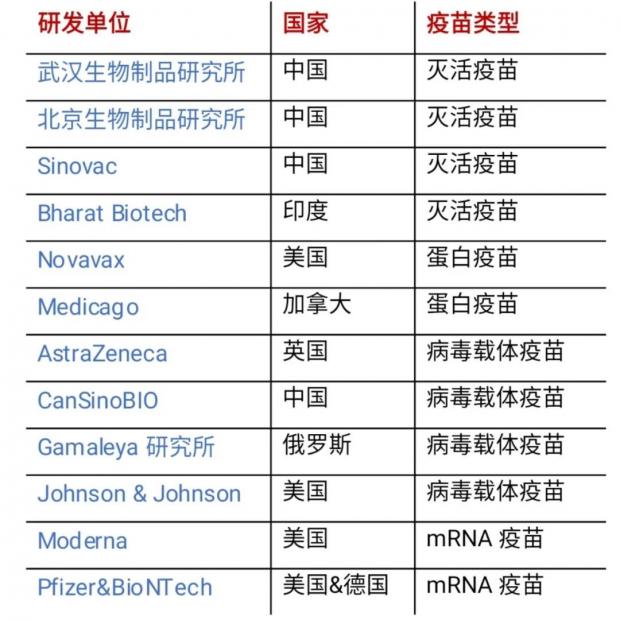
目前进入三期临床试验的12种新冠候选疫苗 (数据来源:参考链接1;制图:知识分子)
虽然灭活疫苗的安全性提高了,但它不能在体内增殖,所以激起的有效免疫反应相对有限,一般需要多次接种才能达到保护的效果。
随着人类对感染性疾病发病机制的深入了解,更多疫苗的制备方法被发明了出来。
比如,如果我们知道了病原微生物感染所必需的关键蛋白分子,那么这个关键蛋白就可以作为疫苗。通过在实验室里生产这种关键蛋白,然后将它作为疫苗对人进行接种,使人体产生针对它的特异免疫反应,就可以防止感染的发生。
这就是蛋白疫苗,也被叫做亚单位疫苗。一个大家熟悉的例子就是乙肝疫苗。通过基因工程的方法在实验室里获得乙肝表面抗原蛋白,然后将其接种给新生儿,极大地降低了乙肝感染的发生,在全世界拯救了无数的生命。
在正在研发的新冠候选疫苗,已经有两种蛋白疫苗进入了三期临床试验阶段。这里采用的关键蛋白分子,就是新冠病毒感染细胞时所必需的S蛋白。
因为不带病原体的其它成分,蛋白疫苗比较安全。它也有缺点,单个蛋白的免疫原性比较弱,不容易激起强的免疫反应,所以一般需要多次接种。
一个克服单个蛋白免疫原性较弱的方法,是通过表达载体将编码候选蛋白的基因带进宿主细胞。这里用的载体是不会让人得病的病毒,比如腺病毒。把编码病原微生物关键蛋白的基因插入腺病毒的基因组里,然后在体外大量生产这种“改造”过的腺病毒,再将它作为疫苗接种到人体内。
这就是病毒载体疫苗。这种疫苗也已经投入了使用,比如针对埃博拉病毒的疫苗。目前正在研发的新冠候选疫苗中,有四种病毒载体疫苗也已经进入了三期临床试验阶段,其中一种来自中国,由中国军事科学院军事医学研究院与康希诺生物合作研发。
病毒载体疫苗的优点是能激起较强的免疫反应。但它同样存在缺点,一方面,病毒的DNA有插入人体细胞基因组的可能,从而导致其它疾病;另一方面,一些人接种疫苗前可能就有针对腺病毒的免疫反应,这种预存的免疫反应会大大降低病毒载体疫苗的效果。
以上四种技术,都有经过检验的成熟产品获批上市,它们可以称为传统疫苗。不过,这些技术生产的疫苗,必须在实验室进行细胞培养才能获得疫苗所需要的病毒或蛋白。所以,当疫苗需要快速和大规模的生产时,这个特点就会成为一个瓶颈。
突破这一限制,核酸疫苗是一个方向。
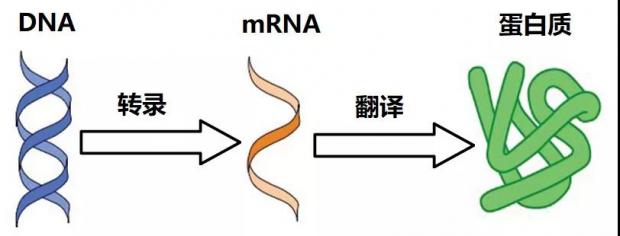
图2. 从DNA到蛋白质的示意图
核酸疫苗之所以能够被快速大规模生产,是因为它们的制备不需要培养细胞,可以在实验室里直接合成。
我们知道,作为疫苗的抗原一般是蛋白,那么DNA和mRNA为什么可以作为疫苗呢?作为遗传物质的DNA可以在细胞核里转录成信使RNA(mRNA),然后mRNA在细胞质里按照遗传密码翻译成蛋白质。
对于核酸疫苗来说,将体外合成的编码病原微生物关键蛋白的DNA或mRNA直接接种到人体内,它们在人的细胞里被翻译成蛋白质,就能激起免疫反应 [2]。
核酸疫苗包括DNA疫苗和mRNA疫苗两种。
先说DNA疫苗。一般而言,DNA疫苗是通过把编码病原体关键蛋白的DNA插入到质粒载体中来构建的。带有关键蛋白的DNA的质粒在进入人体细胞后先被转录成mRNA,然后再翻译成病原体蛋白。
在目前研发的新冠疫苗里,由印度Zydus Cadila公司研发的DNA新冠疫苗已经进入二期临床试验阶段 [1]。
DNA疫苗虽然能在实验室里大量合成,但也有几个缺点。一是DNA的免疫原性较弱;二是因为DNA转录成mRNA是在细胞核里完成,所以不仅需要让DNA穿过细胞膜进入细胞,而且还要穿过核膜进入细胞核;三是从DNA到蛋白质还有一个转录成mRNA的中间步骤,多一个步骤就意味着复杂度的增加。相比于上面三个可以努力克服的缺点,第四个缺点就更加麻烦,因为进入细胞核的DNA有插入人体细胞基因组的可能,这就存在引发其它疾病的风险。
相比于DNA疫苗,同样可以大量在体外合成的mRNA疫苗则没有这些麻烦,因为mRNA没有插入人体细胞基因组的可能,它是一种更加安全的疫苗。因此,mRNA疫苗被寄予厚望 [3]。
那么,集中了如此多优点的mRNA疫苗,为什么还没有被批准使用过呢?
2 新冠疫情里升起的明星疫苗
mRNA疫苗本身也有一些短板。
第一,和高度稳定的DNA不同,mRNA非常不稳定 [3]。
在细胞内,DNA只有一个拷贝,需要稳定的存在;而作为信使和中间产物的mRNA则是在需要的时候产生,在不需要的时候消失,所以必须能够被降解。
第二,mRNA本身有较强的免疫原性,容易激活免疫系统。
具有较强的免疫原性是一把双刃剑,它可能帮助产生有效的免疫反应,但也可能因为让免疫反应走向另一个方向从而降低针对病原体关键蛋白的特异免疫反应。至于这把双刃剑具体效果,则可能因mRNA疫苗而异,所以需要根据具体情况做出调整。
第三,将mRNA导入细胞同样是一个挑战。
mRNA翻译成蛋白这一过程是在细胞质中进行的,所以只需要让mRNA通过细胞膜进入细胞质就行,但将高度不稳定的mRNA导入细胞并不是一件容易的事情。
因为mRNA的巨大潜力和优势,研究人员为解决上面三点问题付出了不懈的努力。通过对mRNA进行一定的修饰和改变,可以增强它的稳定性和调整它的免疫原性;通过把mRNA包裹在一个可以和细胞膜融合的载体中,可以有效地把它导入到细胞质中。
1990年,研究人员首次将体外合成的mRNA导入动物体内,实验取得了成功[4]。在之后的二三十年里,以上三点问题得到了较好的解决,为mRNA疫苗的诞生提供了技术保障。
在研发技术上不再有问题的mRNA疫苗之所以还没有诞生,还有另外一方面的原因,这就是疫苗研发所必须走的流程。
一个疫苗要得到批准使用,先要做临床前试验,也就是动物实验。只有在动物身上显示安全有效的疫苗才能进入临床试验阶段。
临床试验包括三期。
一期临床试验的对象一般是几十个人,目的是确定疫苗的剂量,检测疫苗的安全性,同时也测试是否可以激发针对病原体的免疫反应。
二期临床试验的对象一般是几百个人,包括不同的人群(比如老人,小孩),目的是测试疫苗在各人群里的反应是否不同,同时再次验证疫苗的安全性和激发免疫反应的能力。
三期临床实验的对象则是几千甚至几万人,目的是测试疫苗在自然条件下防止病原体感染的效果。要做到这一点,试验对象会被随机分成两组,一组接种疫苗,一组接种安慰剂。这些都是在双盲的情况下进行的。随后,这些试验对象去照常生活。等到在正常的生活里被感染的试验对象达到一定数量之后,就可以比较疫苗组和安慰剂组的感染发生的情况,计算出疫苗的保护效力。
一般而言,一个疫苗从设计到通过临床试验需要十几年的时间,而且只有一小部分疫苗能够顺利通过所有的试验得到批准。所以,对研发疫苗的公司来说,研制新的疫苗是一个耗时费力而且高风险的过程。
但新冠疫情让事情发生了变化,极大地加快了疫苗诞生的步伐。
一方面,全球新冠大流行,让世界急需在短期内生产出大量的疫苗,最能符合这一点的就是核酸疫苗,尤其是更加安全的mRNA疫苗。另一方面,因为新冠疫苗需求的紧迫性,政府对新冠疫苗研发给予了支持,包括资金和政策两个层面。
美国Moderna公司开发的mRNA新冠疫苗就是一个很好的例子。
1月初,中国科学家公布了新冠病毒的基因序列。1月23日,中科院武汉病毒研究所石正丽小组通过bioRxiv预印版报道了新冠病毒的S蛋白在感染中起到了关键的作用 [5]。几天之后的1月底,Moderna公司就设计出了以新冠病毒S蛋白为靶点的mRNA疫苗。
在美国政府提供的10亿美元支持下,Moderna公司在三月份完成了mRNA新冠疫苗的动物实验,在猴子身上证明了它的有效性,并随即开始了一期临床试验。
新冠病毒在欧美国家造成的严重疫情,促使通常耗时最长的三期临床试验时间大大缩短。Moderna公司在7月底开始的三期临床试验,几个月后就有了初步的结果。11月16日,Moderna公司公布了他们研发的新冠疫苗mRNA-1273的三期临床的初步结果,其保护效率高达94.5% [1]。
同样在1月底就设计出了mRNA新冠疫苗的还有德国公司BioNTech。它和美国辉瑞公司合作的mRNA新冠疫苗的临床试验虽然在5月份才开始启动,但通过合并一、二期,和二、三期临床试验的方式,他们开发的BNT162b2成为了世界上首个完成了三期临床试验的新冠候选疫苗。
11月20日,BioNTech和辉瑞公司向美国食品和药品管理局(FDA)提出了紧急使用的申请。这个申请的审批预计在12月中旬完成 [6]。
如果审批通过,这款mRNA疫苗将成为人类历史上的第一个mRNA疫苗。
目前,欧盟已经向BioNTech和辉瑞公司下了一个三亿支疫苗的订单,一旦这款疫苗在十二月通过了审批,年底之前将有一大批人可以得到接种。而且,因为BioNTech、辉瑞和Moderna公司的这两款mRNA新冠疫苗在三期临床试验的成功和领先,一个很可能的结果是mRNA新冠疫苗将主导欧美国家的新冠疫苗市场。
BioNTech公司CEO Sahin 认为,如果更多的疫苗能够在明年三月前被批准使用,明年秋天将有60-70%左右的人得到新冠疫苗的接种,从而达到群体免疫的水平 [7]。
当然,因为这是mRNA疫苗的首次应用,即使通过FDA的紧急使用审批,mRNA新冠疫苗的有效性和安全性仍需在实际使用中去进一步验证。对于人类历史上第一次出现的mRNA疫苗,我们应该保持谨慎的乐观。
mRNA新冠疫苗的出现,除了帮助世界抵抗紧迫的疫情外,还极大地推动了疫苗研发这一领域的进展。一个可以预测的事件是,这种可以快速生产、成本低廉的疫苗将出现在更多的疾病领域,为人类的健康带来福音。从某种意义上来说,新冠病毒的出现,加速了mRNA疫苗的诞生,从此疫苗研发领域进入了新的纪元。
参考资料
1.https://www.nytimes.com/interactive/2020/science/coronavirus-vaccine-tracker.html
2.https://www.who.int/teams/health-product-and-policy-standards/standards-and-specifications/vaccines-quality/dna
3.https://www.nature.com/articles/nrd.2017.243
4.Wolff, J. A. et al. Direct gene transfer into mouse muscle in vivo. Science 247, 1465–1468 (1990). This study demonstrates protein production from RNA administered in vivo.
5.Zhou et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature 2020,volume 579, pages270–273
6.https://edition.cnn.com/2020/11/20/health/pfizer-vaccine-eua-submission/index.html
7.https://abcnews.go.com/Health/biontech-ceo-explains-pfizer-covid-19-vaccine-plans/story?id=74278184
话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。



 京公网安备 11010502034662号
京公网安备 11010502034662号 