阅读:0
听报道
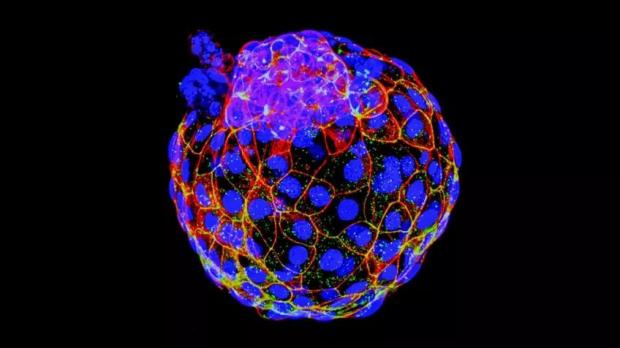
多个研究小组从人类干细胞中制造出了人类胚胎最早期发育阶段的囊胚模型。Credit: UT Southwestern
撰文 | 杜忆南 纪冬梅
责编 | 计永胜
生命起始于精卵结合。随后,这枚受精卵细胞一边向着子宫的方向前进,一边发生分裂。当它抵达子宫合适部位的时候已经演变成由滋养层(Trophectoderm)、上胚层(Epiblast)和下胚层(Hypoblast)组成的囊胚(Blastocyst)。囊胚着床后,也就是与母体细胞 “紧密” 衔接后,滋养层、上胚层和下胚层分别发育为胎盘、胚体和卵黄囊……
探索人类胚胎的发育机制,尤其是最早期囊胚的形成与发育过程,是我们解析早期流产、不孕不育和出生缺陷等临床问题的关键途径。
遗憾的是,虽然已有多个研究团队成功地利用小鼠干细胞在体外实现小鼠囊胚模型的构建,但是在人囊胚样结构的模型研究上,科学家举步维艰,先前只能分别诱导出上胚层、滋养外胚层和下胚层细胞,而不能将三者有机整合为囊胚结构。
2021年3月17日,《自然》杂志报道了两项突破进展。美国德克萨斯西南医学研究中心教授吴军团队和澳大利亚蒙纳士大学教授何塞·波罗(Jose Polo)团队分别利用人类多能干细胞诱导和成体细胞重编程技术成功获得了人类胚胎最早期发育阶段的囊胚模型(被命名为Blastoid和iBlastoid)[1,2]。这两个囊胚样结构均包含了人类真实囊胚中的干细胞类型,空间分布一致,并可在实验室环境中模拟人类早期胚胎的发育和着床过程。
“这两项研究将分散的信息完美整合在一起,为我们了解胚胎最早期的发育方式构建了具有潜在应用价值的实验模型。而我们对胚胎最早期的发育知之甚少。” 加拿大多伦多儿童医院发育生物学家珍妮特·罗森特(Janet Rossant) 评论道 [3]。
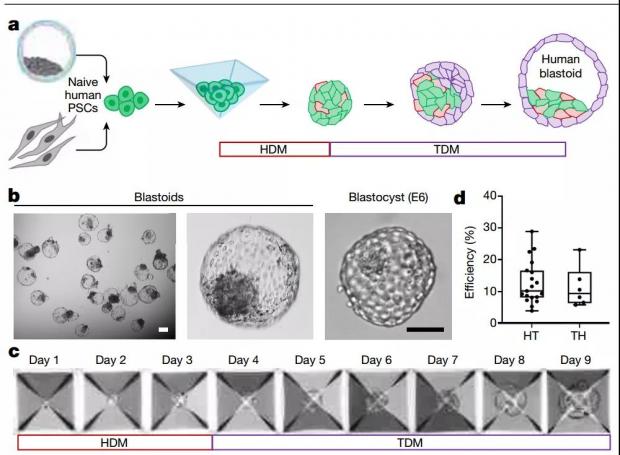
图1. 吴军团队体外构建的人类囊胚模型。(图源:参考文献[1])
吴军团队主要使用的是多能干细胞。科研人员将干细胞置于3D培养系统,先用下胚层细胞分化培养基(Hypoblast differentiation medium,HDM)培养,后改为滋养层细胞分化培养基(Trophoblast differentiation medium,TDM)。数天后获得了囊胚样结构(Blastoid)。
囊胚样结构在形态结构、细胞种类数量和基因表达上都与真实的人囊胚(受精后6天)高度相似。并且,从囊胚样结构中分离出的细胞(上胚层细胞、滋养层细胞和下胚层细胞)有进一步地向对应方向分化的干细胞潜能。此外,通过体外模拟子宫植入实验,研究人员发现一部分囊胚样结构能粘附在培养皿上发育,其中某些能生成类似于真实囊胚在着床后的羊膜囊腔和卵黄囊腔的结构。
何塞·波罗团队同样使用了3D细胞培养系统,但他们是将人体成纤维细胞进行了重新编程,诱导成为囊胚样结构,并命名为iBlastoid。iBlastoid也同时具备上胚层、滋养层和下胚层细胞,并能在实验室培养条件下继续发育。
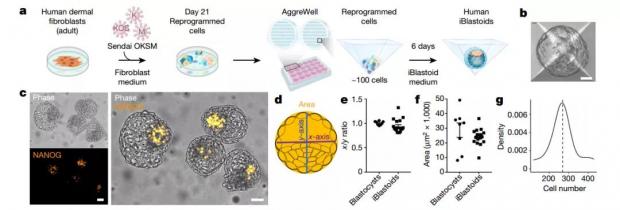
图2. 何塞·波罗团队体外构建的人类囊胚模型。(图源:参考文献[2])
这两项研究的确取得了重大突破,但两篇论文的作者在描述实验结果时仍很谨慎,承认研究的局限性,比如对囊胚样结构的诱导效率有待提升,获得率还不够稳定;单细胞转录组分析结果提示囊胚样结构中还包含了一些在真实囊胚中并不存在的细胞类型。同时,由于法律与伦理限制,两个团队均没有将囊胚样结构长时间继续培养(未超真实胚胎发育14天限制),因此无法评估该囊胚模型后续发育中与真实囊胚的吻合度。
吴军在接受《科学》杂志采访时也强调,囊胚样结构不是胚胎,“它只是胚胎发育最早期阶段的多种细胞的集合” [4]。由于涉及到生物医学伦理,普通民众之间对这些研究成果的看法可能会存在差异,正如加州大学旧金山分校生殖和发育学教授苏珊·费舍尔(Susan Fisher)所言,这将检测科学家和大众对细胞集合的理解有何不同 [4]。
值得一提的是,预印本网站bioRxiv分别于3月9日和3月12日发布了北京大学第三医院研究员于洋团队和加州理工学院生物学与生物工程部教授玛格达琳娜·泽尼卡·戈茨(Magdalena Zernicka-Goetz)团队关于用人类多能干细胞构建囊胚样结构的文章 [5,6]。
“体外人类囊胚模型为早期胚胎着床失败或着床后发育异常导致的不孕或流产提供了直接的研究材料,也适用于环境暴露组学与相关风险评估。” 安徽医科大学第一附属医院生殖医学中心主任曹云霞教授点评道,“该模型还可以用于胚胎植入前与产前诊断技术用于阻断遗传性疾病传递的研究,具有广阔的临床研究与应用价值。”
参考资料:
[1] Yu L, Wei Y, Duan J, Schmitz DA, Sakurai M, Wang L, Wang K, Zhao S, Hon GC, Wu J. Blastocyst-like structures generated from human pluripotent stem cells. Nature. 2021 Mar 17. doi: 10.1038/s41586-021-03356-y. PMID: 33731924
[2] Liu X, Tan JP, Schröder J, Aberkane A, Ouyang JF, Mohenska M, Lim SM, Sun YBY, Chen J, Sun G, Zhou Y, Poppe D, Lister R, Clark AT, Rackham OJL, Zenker J, Polo JM. Modelling human blastocysts by reprogramming fibroblasts into iBlastoids. Nature. 2021 Mar 17. doi: 10.1038/s41586-021-03372-y. PMID: 33731926
[3] Subbaraman N. Lab-grown structures mimic human embryo's earliest stage yet. Nature. 2021 Mar 17. doi: 10.1038/d41586-021-00695-8. PMID: 33731911
[4] www.sciencemag.org/news/2021/03/researchers-re-create-key-human-embryo-stage-lab?utm_campaign=news_daily_2021-03-18&et_rid=159394161&et_cid=3705014
[5] Fan, Y. et al. Generation of human blastocyst-like structures from pluripotent stem cells. Preprint at bioRxiv https://doi.org/10.1101/2021.03.09.434313 (2021).
[6] Sozen, B., Jorgensen, V., Zhu, M., Cui, T. & Zernicka-Goetz, M. Reconstructing human early embryogenesis in vitro with pluripotent stem cells. Preprint at bioRxiv https://doi.org/10.1101/2021.03.12.435175 (2021).
话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。



 京公网安备 11010502034662号
京公网安备 11010502034662号 