图源:pixabay
撰文丨周叶斌
2023年12月8日,FDA一次批准了两个针对镰状细胞病的基因治疗,其中有首个基因编辑疗法——同时也是首个基于CRISPR基因编辑技术的疗法[1]。
自上世纪90年代人类基因组计划起步后,基因治疗一直是最被人们畅想的医学方向。但基因治疗此后却历经波折,1999年美国宾夕法尼亚大学一个基因治疗临床试验导致18岁受试者Jesse Gelsinger死亡的严重不良反应事件更是让基因治疗经历了多年冷遇。
可近年来,属于基因治疗的CAR-T肿瘤免疫治疗深刻改变了血液瘤的治疗格局;针对罕见病脊髓性肌萎缩症的基因治疗Zolgensma自2019年上市后为超过3000名患有这种“绝症”的患儿带来希望,2022年更是全球销售额超14亿美元,证明基因治疗完全可以取得商业成功[2]。甚至连FDA这类监管机构也在为可能出现的基因治疗井喷而招兵买马,严阵以待[3]。一切似乎都预示着,基因治疗的时代真要来了。
最适合基因治疗的疾病?
从患者人数看,全球患者人数估计为两千万。而且由于镰刀型细胞贫血的致病基因型多见于非洲裔人群,绝大多数患者都在非洲落后地区,发达国家的患者少很多,如美国患者人数约10万[4]。
当某个疾病集中发生在落后地区,往往会因较难获得经费支持,难以到疾病发生地展开研究,或是直接的歧视等原因,被医学界、社会忽视,不为人知。镰状细胞病却例外,它是全世界知名度最高的遗传病。镰状细胞病的遗传机制、镰刀型血红蛋白对疟疾的适应优势,都已经成了遗传学的经典教科书内容。只要你学过一点遗传学,那一点里多半包括镰状细胞病。
因此,很多人都知道镰状细胞病是由于血红蛋白上的变异导致,准确说是血红蛋白β链上出现的变异。成人的绝大多数血红蛋白都是由两条α链与两条β链构成,而β链编码基因上一个碱基的突变让这个157个氨基酸构成的蛋白质里第6号位的谷氨酸变成缬氨酸,就是导致镰状细胞病的元凶。携带该变异的血红蛋白β链在一般情况下与正常蛋白无异,可在缺氧条件下,该变异会让血红蛋白纤维化,导致红细胞变形:不再是具有韧性的扁平状,变成极为脆弱的镰刀状。镰刀状的红细胞在经过毛细血管时极易破碎,导致血管阻塞危象(vaso-occlusive crisis),毛细血管堵塞又可能让器官血液循环受阻,进而出现脏器损伤。
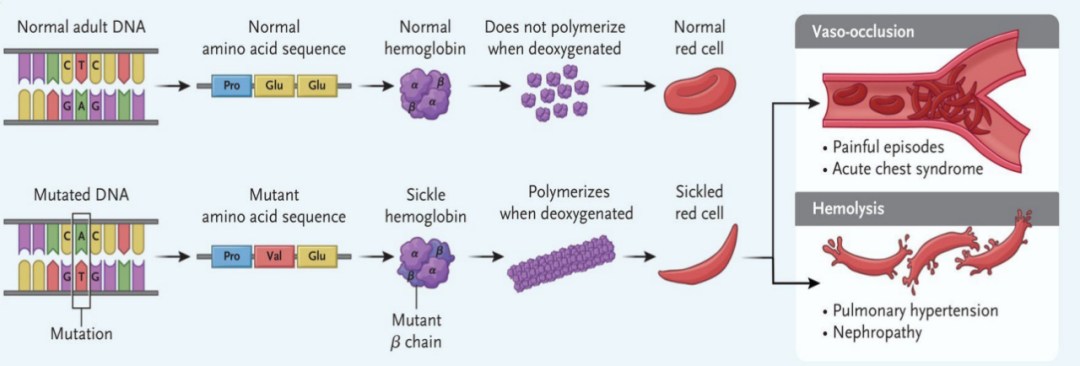
镰状细胞病的致病机理[5]
血管阻塞危象对患者来说非常危险,也极为痛苦。遗憾的是,尽管只是一个氨基酸的改变,致病机理也早已有大量深入的研究,镰状细胞病却仍是不治之症。常用药物化疗药羟基脲,通过增加胎儿血红蛋白(不带有β链,不受镰状细胞病基因变异影响)可以降低血管阻塞危象频率与严重程度。近年来的新药包括针对黏附分子CD62P的单克隆抗体crizanlizumab以及增加血红蛋白与氧气亲和度的小分子药物voxelotor,也能减少血管阻塞危象。可是这些药物都无法治愈镰状细胞病。
镰状细胞病,这个人类第一个搞清楚分子机制的遗传病,似乎是注定要靠基因治疗,这种回归遗传学的方法来攻克。
很多因素都让镰状细胞病太适合基因治疗了:作为一个单基因遗传病,它的致病机理非常简单明确,不需要考虑其它基因或环境因素影响;能让人体运转正常的血红蛋白水平有很广的区间范围,意味着不需要让蛋白表达固定在非常精细的水平上;该疾病影响的又只是红细胞,只需在造血干细胞上做基因改造就能治疗,造血干细胞又是最容易在体外做基因改造,重新输回体内起效的细胞类型。
实际上在基因治疗上市前,镰状细胞病也有一种治愈式疗法:异体干细胞移植。如果患者能找到骨髓配型吻合的健康人,比如兄弟姐妹的配型成功率较高,通过干细胞移植,将健康人的造血干细胞移植到患者体内后,患者本人虽然还是有镰状细胞病基因,但他(她)的造血干细胞已经是来自捐赠者的正常基因型,将生产正常的血红蛋白,不再受疾病困扰。
可是能配型成功的患者只是少数:美国只有不到20%的患者能找到适合的捐赠者[5]。随着基因治疗领域的发展,不难想象我们可以针对镰状细胞病患者的造血干细胞做改造,让后者也能生产正常的血红蛋白,再用自体骨髓移植的方式来治愈疾病。
治愈率超95%
这也是FDA同日批准的两个基因治疗都采用的方案。可具体如何改造基因,两个被批准的镰状细胞病基因治疗却充分展示了条条道路通罗马。
镰状细胞病的基因治疗目的是让患者造血干细胞能产生正常的血红蛋白。一种方法是人为引入另一个血红蛋白的基因,这也是12月8日获得FDA批准的Lyfgenia采用的方法。Lyfgenia利用慢病毒载体(lentiviral vector)将一个携带T87Q变异(既能抑制镰刀型血红蛋白聚合,又能作为生物标记物)的血红蛋白β链引入患者的造血干细胞,从而产生功能正常的血红蛋白。该基因治疗的路线有点类似CAR-T,CAR-T治疗也是在患者的一类血细胞,T细胞里引入CAR基因,后者表达出来的蛋白可以识别特定的肿瘤细胞抗原。已上市的多个CAR-T治疗其实也是用慢病毒载体引入CAR基因。
不过获得FDA批准的两个镰状细胞病基因治疗里引发更多关注的是Casgevy,因为它是第一个采用CRISPR基因编辑技术的基因治疗。2020年获得诺贝尔奖的CRISPR基因编辑技术在过去十几年彻底改变了基因编辑领域,成了使用最广的生物技术之一。不同于Lyfgenia利用病毒载体引入外源基因,Casgevy是在用CRISPR/Cas9系统,在体外对患者造血干细胞的基因组序列做修改,也就是基因编辑。
但Casgevy不是直接修复突变的血红蛋白β链,而是采取类似围魏救赵的策略。成人血红蛋白主要由两条α链与β链构成,可胎儿的血红蛋白却是由两条α链与γ链构成。镰状细胞病的基因变异不影响γ链,这也是为什么能增加胎儿血红蛋白表达的羟基脲能治疗镰状细胞病。胎儿到成人的血红细胞类型转变与BCL11A这个转录因子关系密切:是BCL11A抑制了血红蛋白γ链的表达,才让人体的血红蛋白转型。
Casgevy用CRISPR/Cas9在造血干细胞中阻断BCL11A的表达,让胎儿血红蛋白的表达不再受抑制,也让患者能不再受不正常的血红蛋白β链影响。
从有效性来看,两种基因治疗都取得了极为优异的治愈效果:Casgevy临床试验中符合评估标准的30位患者,29位在18个月中未出现血管阻塞危象,治愈率高达96.7%[5],而Lyfgenia临床试验中31位患者跟踪12-24个月,29位未出现血管阻塞危象,治愈率93.5%[6]。
这些基因治疗在临床试验阶段已经对一些患者的生命产生了巨大改变。Casgevy的第一位受试者Victoria Gray在四年前成为全球第一个接受CRISPR基因编辑治疗的志愿者。在接受治疗前,她的生活经常被镰状细胞病带来的剧痛打断——需要不时到医院接受输血、使用强效阿片类药物止痛等等,这使Victoria Gray和无数镰状细胞病患者一样,根本无法正常生活、工作。而在接受了基因治疗后,如今Victoria Gray已经有四年没有发生一次“病发”,她还有了一份全职工作:沃尔玛的收银员。今年3月在伦敦举行的第三届国际人类基因组编辑峰会上,Victoria Gray还是特邀嘉宾,分享她的经历[7]。而她的经历也预示着基因治疗蕴含的巨大潜力:众多严重遗传疾病的患者的希望或许就在这里。
定价超1500万人民币
与同日两个基因治疗获批一样备受关注的,是两个镰状细胞病基因治疗的价格:Casgevy定价220万美元,按照当下的汇率,折合人民币超过了1500万,而Lyfgenia更是高达310万美元。这些定价也反映了基因治疗的未来仍然面临着很多挑战。
单价百万美元以上几乎是基因治疗的标配:前文提到的Zolgensma在2019年上市时的定价为210万美元。Lyfgenia背后生产商在去年还有两款同样基于慢病毒载体的基因治疗上市:针对地中海贫血症的Zynteglo和针对罕见神经系统疾病肾上腺脑白质营养不良(cerebral adrenoleukodystrophy)的Skysona,定价分别为280万与300万美元。
高昂的定价不能简单归于企业唯利是图,基因治疗的成本确实极高。每一个患者的基因治疗实际上都是针对这位患者专门订做一份药物,以镰状细胞病的基因治疗为例,治疗过程包括从患者体内收集造血干细胞,对这位患者的造血干细胞做基因工程改造,再以骨髓移植的方式输入改造好的细胞[8]。目前这类治疗的生产成本远超传统药物。
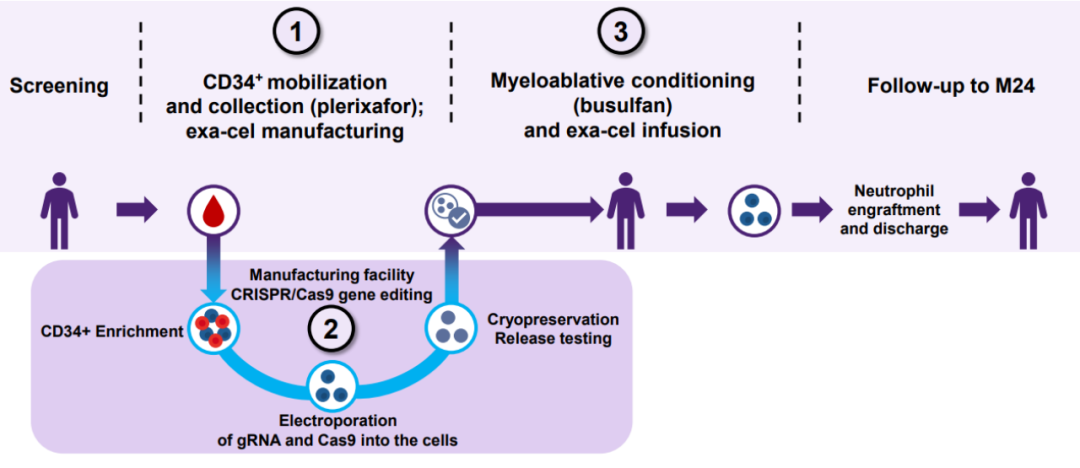
首个CRISPR疗法Casgevy的治疗过程[8]
而镰状细胞病的绝大多数患者生活在非洲经济落后地区,很难想象目前的基因治疗能惠及大多数有需求的患者。这无疑会导致医学伦理上的困境。
价格还只是当下基因治疗普及的诸多困难之一,从某种程度上说甚至不是最大限制因素。无论是Casgevy还是Lyfgenia,患者接受治疗的过程都极为漫长,还充满危险。完成造血干细胞采集后,患者需要等待细胞完成基因工程改造,回输改造完的造血干细胞本身耗时很短,可是在回输前患者需要用化疗药物清除体内的造血干细胞,这样才能让回输的造血干细胞获得必要的生存空间。清除体内造血干细胞后,患者处于严重免疫抑制状态,必须在医院等待数周,直到体内白细胞恢复才能出院。
如此复杂又危险的治疗过程使得能做治疗的只有大型医学中心,例如Casgevy目前全美只有50个治疗中心,这又意味着很多患者由于地理因素限制不可能有机会用上这类治疗。
其实由于治疗的复杂程度,这些基因治疗甚至未必是患者最好的选择。前文提到镰状细胞病目前可以通过异体骨髓移植治愈,从两个慢病毒载体基因治疗Lyfgenia和Skysona的临床数据看,基因治疗后的白细胞、血小板恢复慢于配型成功的异体骨髓移植[9]。
考虑到两个镰状细胞病基因疗法的种种局限,适合的患者应该是病情严重,如发生多次血管阻塞危象,同时又无法使用传统异体骨髓移植的人,而这一人群,在美国估计不到2万人,只是全美约10万患者中的很小一部分,对于全球两千万镰状细胞病患者来说,更是极少数[1]。
基因治疗的时代尚未降临
同一个疾病在同一天有两个基因疗法获得FDA批准,这无疑显示了基因治疗的飞速发展。可同时这并不意味着基因治疗已经解决了各种科学挑战。除却上述提到的生存成本高、治疗过程复杂等问题,真正要把基因治疗推广到更多疾病,还有很多科学难题需要解决。
前文提到镰状细胞病几乎是基因治疗的完美对象:仅仅改造造血干细胞就能完成治愈。但绝大多数疾病并非如此,它们涉及的细胞不是能在体外改造的血细胞,采用基因治疗必须要越过靶向这些疾病组织的挑战。目前主流的基因治疗载体是AAV病毒载体,虽然AAV种类不少,不同AAV可以靶向不同器官,可当下能有效靶向的基本局限于肝脏、肌肉,再加上较为特殊的眼部以及造血干细胞。由于靶向器官的限制,基因治疗离为各种遗传病订制治疗方案还相差甚远。
更不可忽视的是安全性问题。近年来一些基因治疗确实如两个获批的镰状细胞病疗法一般,对过去医学上的绝症有治愈性效果,可这不意味着基因治疗不存在风险。在Lyfgenia的临床试验里有两位患者出现了白血病,推测原因是化疗清除造血干细胞导致,可是同为慢病毒载体的另一个基因治疗Skysona在临床试验里确实出现了3例可能由慢病毒载体重组导致的白血病[9]。而Casgevy也面临基因编辑脱靶的问题。
诚然,对于患有严重镰状细胞病的患者来说,这些基因治疗虽然伴有风险,但受益风险平衡上显然是受益远远占据上风。可是要进一步推广基因治疗,特别是走向患者更多的大众疾病,收益风险就不得不重新考量。
说到基因治疗以及人类基因组编辑,我们无法不提2018年的贺建奎基因编辑婴儿事件。考虑到包括基因编辑技术在内目前的技术局限 ,类似对种系细胞(影响到生殖细胞,涉及人类基因库的改变)的编辑在可预见的时间内仍然离实用非常遥远。
即便不考虑种系基因编辑,基因治疗安全性上的复杂性也不可小觑。2022年,一位杜氏肌营养不良患者在接受基于CRISPR的体内基因编辑治疗后死亡,事后研究显示这是使用的AAV载体在高剂量时导致的免疫反应造成[10]。
基因治疗常用的病毒载体带来不仅有此类直接的安全风险。在使用一个病毒载体的基因治疗后,人体不可避免会产生针对该载体的免疫反应,让该患者不能再使用同一载体的治疗方法。在强调基因治疗仅需一次治疗的“便捷”优势的同时,我们也应注意到基因治疗不仅是只需一次,还是只能做一次。因此,评估某基因治疗时不能只考虑成功后的好处,更要考虑如果不成功的后果。由于适合递送基因治疗的载体有限,一次失败的基因治疗还很可能意味着患者未来也无法接受有效的基因治疗。
这也是为什么基因治疗的疗效持久性、长期安全性必须受到更严苛的审核,例如两个镰状细胞病的基因疗法都会进行15年的临床试验受试者跟踪。
今年5月,关于备受瞩目的AI技术,OpenAI CEO Sam Altman在接受美国国会质询时表示如果这项技术出错,可能会出大错。从某种意义上说基因治疗也有相似处,如果出现差池,患者要面临的不仅是严重安全隐患,还会处于无法挽回的境地。因此,在看到基因治疗里程碑式进展的同时,我们并不能放下谨慎的态度。
参考资料:
1.https://
2.https://
3.https://
4.https://
5.https://
6.https://
7.https://
8.https://
9.https://
10.https://
0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 