在当下如火如荼的生物医药出海浪潮中,“出海”几乎成了一种业内刚需。生物医药企业的行业交流中,如若不提及出海,几乎便难以启齿。然而,深入探究便会发现,问题的根源并不在“出海”这一行为本身,而是企业究竟是从出口贸易的思维出发,为了解决自身诉求,要强行打开一个新的市场,还是,从公共健康的思维出发,真正去了解新市场中未被满足的需求究竟是什么,企业该如何去满足?
在经历了陪同中国企业访问沙特药监局;和陪同沙特药监局访问中国两次访问后,国际药物信息学会(DIA)全球董事李自力博士写下了如下两篇短文,文中提到了药企出海的两大关键因素:能否实现利己思维到利他思维的转变,以及,监管体系如何更好地接轨。知识分子现摘编如下。
撰文 | 李自力
● ● ●
(一)从出海1.0的出口贸易思维到出海2.0的公共健康思维
我作为DIA全球董事,参加了于2025年3月18-20日在瑞士巴塞尔举行的DIA欧洲年会。在欧盟药监局(EMA)专场上,听众给EMA局长Emer Cooke的两个问题尤为瞩目(见图):(1)在美国FDA陷入动荡之际,欧洲是否有机会接过全球监管领导权?实现这一目标需要具备哪些条件?(2)在审评/批准周期远长于FDA的情况下,欧洲如何在临床开发方面保持竞争力?

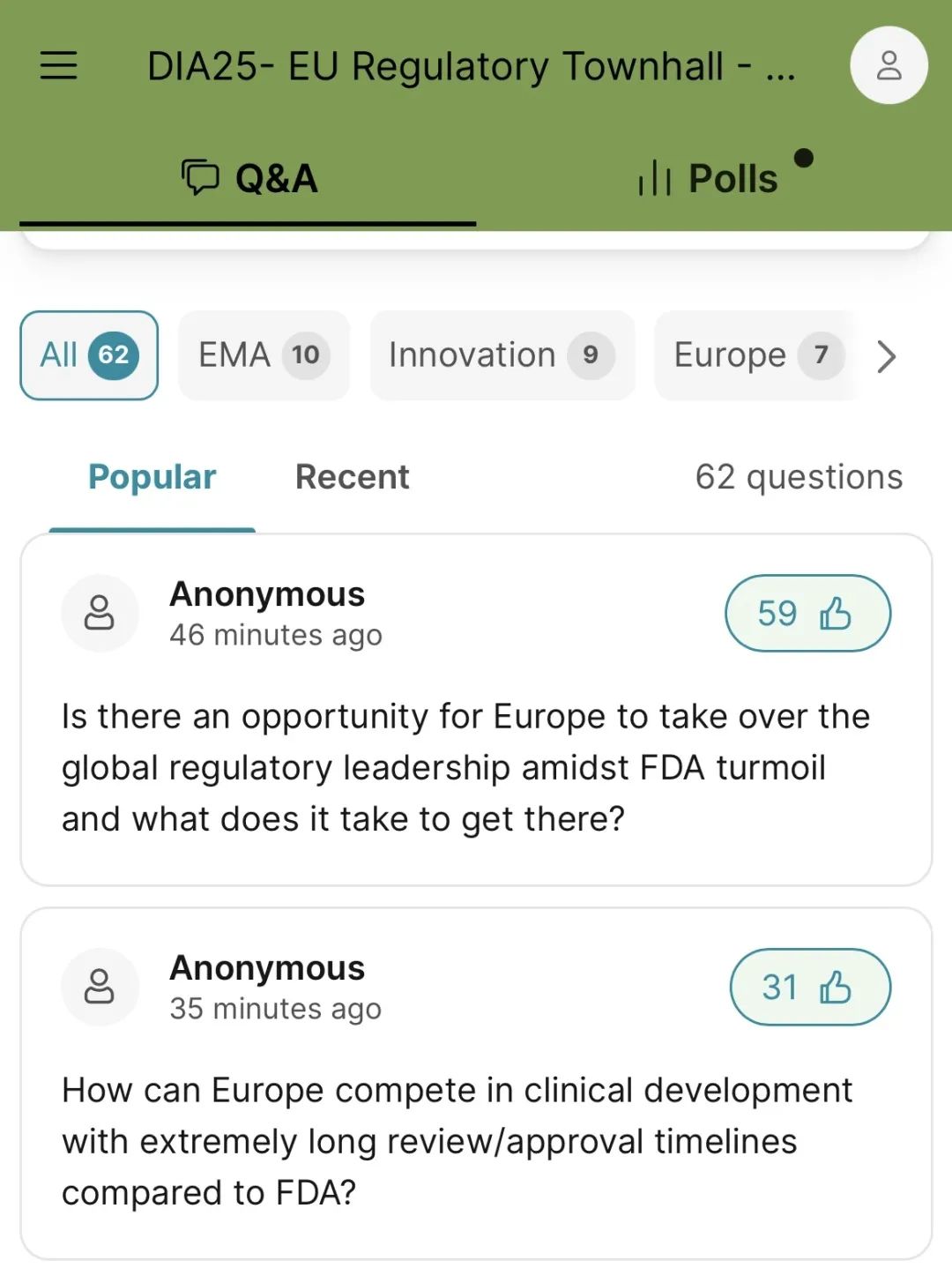
DIA一直在积极邀请Emer Cooke局长来参加DIA中国年会。每次她都是热情洋溢地同意线上演讲,却一直未答应亲自来到中国。上面两个问题,突然让我意识到,我们错了,因为我们只是关心DIA会议的需求,没有从深层了解和关注Emer Cooke局长和EMA的愿景、需求和压力。
从利己到利他的思维模式改变,让我想起了现在如火如荼的生物药“出海”热潮。同当年大跃进一样,“出海”变成了一种“时髦”。没有“出海”这个话题,会议都会觉得低人一等。其实“出海”不是问题,问题的本身,还是我们大部分企业还是处在“出海”1.0模式,或者单纯的贸易思维模式:只关注自己的需求,把产品卖出去或寻找新的融资渠道,而没有进行有效的市场调研,没有很好地研究目标市场在哪里,及其政策和临床需求。就像与人交流,只关注自己在说,没有很好的聆听,不做预习和功课。
我曾经陪同中国15家企业访问沙特药监局。会上大家问的,都是“我能不能不在沙特做临床试验?”“我在中国批准是不是就够了”。没有一个人问,沙特药监局关心的未满足的临床需求在哪里?我们的产品或解决方案如何帮助沙特提升研发创新能力?如何提升沙特的医疗健康水平?我们在沙特2030愿景和沙特药监的第4个五年计划中可以扮演什么样的角色?
如果你不关注别人的需求,你自己的需求也不会得到满足。新时代背景下的创新药出海,不同于原料药,不同于传统大宗商品。如果我们不从单纯的出口贸易思维(出海1.0),转化成以临床需求和国家政策为导向的公共健康思维(出海2.0),创新药“出海”就是空话和大话。
在探索中国创新药国际化的征途中,我们需要建立全球战略能力和视角,更多关注中国创新产品和技术如何满足未满足的临床需求,要以解决目标市场的诉求和全球供应链短缺为方向。
为此,DIA中国正在开展一个项目研究:突破传统思维,重塑全球创新药研发和注册新格局——共同探索出一个崭新的以中国创新为核心、以新兴市场需求为导向的研发和注册新理论、模式和路径,为中国创新药出海的2.0转型出谋划策。
这需要全球药监机构,特别是新兴市场药监的支持,需要志同道合的人一起努力。这次DIA欧洲年会上,沙特、巴西、埃及和其他新兴市场药监的积极参与,给合作带来希望。
(二)战略出海,药监先行:
从沙特SFDA之行看中国创新药全球化破局之道
近年来,中国创新药企业高举"出海"旗帜,积极布局新兴市场,一时间声势浩大。然而,真正实现"收益"的,往往只是组织海外活动的服务机构。因此,我曾在朋友圈提出质疑:中国创新药企真的准备好了吗?而新兴市场,又是否已为中国药企的到来做好准备?

近日,应沙特食品药品管理局(SFDA)负责药品事务副局长Adel博士邀请,我以顾问身份对SFDA进行了为期三天的访问。在与多位部长,尤其是主管药品审评的Jehad博士及各职能审评团队的深入交流中,我形成了以下几点初步观察:
第一,SFDA已意识到他们正面临新的挑战。随着中国创新药,特别是基因和细胞治疗产品的快速发展,依赖FDA或EMA批准作为基础的传统审评模式将不再适用。
SFDA将挑战视为提升监管能力的重要契机。作为国际人用药品注册技术协调会(ICH)管理委员会和药品检查合作计划(PIC/S)成员,并已通过WHO全球基准评估工具(GBT)成熟度等级4(ML4)认证,SFDA希望借助真实案例进一步提升其科学决策能力。
第二,SFDA正加快对中国监管体系的认知。当前他们对NMPA的审评程序、标准体系和中国临床试验质量尚不熟悉,也对中国企业的研发能力与合规文化了解有限。为此,他们决定派出主管部长出席2025年5月在上海召开的DIA中国年会,Adel副局长本人也计划参加10月在北京举办的DIA国际药监局长论坛。
战略出海,药监先行。我们应立足现实,推动监管机构间的深入了解与信任建设。信任的建立应从一线的审评与核查人员做起,通过适当产品试点,借鉴国际成熟经验,探索"同步审评""结果共享"等机制,逐步搭建起稳固的合作桥梁,为中国创新药高质量走向新兴市场创造坚实基础。
声明:原文首发于微信公众平台“国际药物信息协会DIA”,知识分子获授权转载。
0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 