阅读:0
听报道

- 导 读 -
在当代生物医学史上,有很多辉煌的瞬间。为解决一个科学或技术上的问题,科学家和研发人员们冥思苦想,试尽各种手段却不得其门而入。然而在某一瞬间,一个全新的思路、一个突如其来的想法在他们的脑海中闪现。这些想法被验证后让问题迎刃而解。
还有的时候,一个实验在屡次失败、几乎绝望的情况下会突然获得意想不到的成功。这些瞬间改变了个人的命运、公司的前途和科学技术的历史进程。它们可能是所有科研人员梦寐以求、苦苦追寻的那种时刻。它们是日积月累百转千回后的刹那爆发,是山穷水尽柳暗花明时的豁然开朗。
这篇关于瞬间的记录,讲述了华裔女科学家崔景荣博士发明创新抗癌药克唑替尼的故事。
撰文 | 金淘沙拣
迁 徙
来自陕西西安的崔景荣于1980年考入中国科学技术大学近代化学系,5年本科毕业后又直接升入本校攻读硕士学位。科大的8年不但让她建立起高等化学的扎实基础,也培养了她严谨的逻辑思维能力。1989年景荣赴美留学。她的先生李一山是科大的校友。两人于1994同一年从俄亥俄州大学(OSU)获得博士学位,景荣学的是有机化学,一山学的是生物化学。毕业后景荣先带着不满一个月的女儿搬到了北加州,在加州大学伯克利洛伦斯国立实验室做博士后研究。

图1. 崔景荣博士(2016年)图片由崔博士提供
一年以后,景荣从学术界转到了工业界,进入北加州湾区的一家生物技术公司工作。在随后的8年里,她因为家庭或工作的关系, 数次搬家,迁徙于南、北加州之间。
1999年,已在南加州圣地亚哥安家的景荣和一山带着两个女儿,又回到了北加州。一山进入加州大学伯克利攻读MBA,而景荣则开始在南旧金山市的一家名叫Sugen的生物技术公司工作。
读过《野蛮的生长激素》的朋友也许还记得,Sugen是由 “午夜劫案” 的主角之一、基因泰克的早期科学家 Axel Ullrich(我认为,他未来将会因Herceptin 获诺贝尔奖)于1991年联合创立的。Sugen是开发蛋白激酶抑制剂的先锋,拥有140个蛋白激酶或磷酸酶的知识产权。其研发管线中最著名的项目是舒尼替尼(Sunitinib)—— 一个抑制多种受体酪氨酸激酶(RTK)的小分子药。它就是后来于2006年由辉瑞推向市场的抗癌药索坦(Sutent)。
在景荣1999年加入Sugen时,Sugen和 Pharmacia & Upjohn 刚刚宣布并购协议。生物制药公司之间的并购经常发生,或许会给并购双方带来新的契机和协同效应,但对在职的科研人员来说,却意味着动荡和不稳定。不过1999年的这次并购后,Sugen的运营还保持着相对的独立,所受冲击远远不及几年后的第二场并购带来的天翻地覆。
药物猎手和设计师
被并购的时候,Sugen的一个科研项目是开发以c-MET为靶点的小分子抗癌药。癌症是由于人体的一些正常细胞经历了一系列基因突变后,脱离了机体的调控,无限制地繁殖而造成的。而各种不同的突变所起的作用是有轻重之分的,其中一些比较关键的是癌症驱动突变。这些致癌基因表达的蛋白或者加速细胞繁殖,或者阻止细胞凋亡,或者使癌细胞逃避免疫系统的攻击。因突变而过度活跃的受体酪氨酸激酶(RTK)就是最常见的一类致癌蛋白,而c-MET是RTK的一种。异常的c-MET信号传导几乎在所有的实体瘤中都被发现,参与或驱动癌变过程的多个步骤,包括癌细胞的繁殖和存活、血管生成、以及肿瘤转移等等。
当时工业界一直在寻找靶向c-MET的小分子抗癌药,然而众多公司千辛万苦却罕有成功。开发出任何激酶的抑制剂都是一个艰难的过程,而c-MET在我们彻底了解它之前更是一个困难的靶点。
作为抑制剂,一个小分子化合物首先需要与靶蛋白的特定区域紧密结合,锁定蛋白构象,让其无法完成下一步功能。小分子与蛋白结合的紧密程度取决于它与靶蛋白结合中心的关键氨基酸之间的相互作用。最常见的是非共价作用力,包括氢键、芳香环间的π-堆积、和疏水性相互作用等。化合物与蛋白的相互作用力越强, 其效价也就越强,完全抑制蛋白活性的所需药物浓度也就越低。但大部分效价强的抑制剂并不能成为一个好药。一个成功的小分子药还需要具有其它特性:一定的水溶性,使其作为口服药能被肠道吸收,能在血液中溶解、运输;一定的脂溶性,使其能穿过细胞膜和细胞内的靶点结合;在体内不容易被轻易降解、代谢,但又不能滞留时间过长;可以被批量生产等等。所有这些特性被统称为成药性。
本世纪初,制药公司的 “药物猎手” 团队寻找小分子药主要使用两种技术路线。第一种是建立庞大的化合物库,然后通过高通量筛选技术从中找到能结合靶蛋白的分子,再进一步甄别。库里的化合物可能来自大自然(植物、真菌、泥土等),更多的是通过化学合成方法形成的化学基团之间的不同组合物。这一技术能找到可结合靶蛋白的化合物,但其成药性往往不够理想。第二种是理性设计或基于靶蛋白结构的药物设计(SBDD),即根据靶蛋白酶与底物或辅因子(比如激酶与ATP)结合的三维晶体结构来设计能占据其底物或辅因子口袋的小分子。很多公司,包括Sugen,采用两种技术并行或相结合。理性设计更像一门艺术。它对药物设计师的要求比较高:科学家既需要拥有深厚的化学功底,通过口袋内的氨基酸来决定分子作用力的取舍和利用,还需要能够纵观全局,考虑候选分子的成药性。景荣就是这样一名顶尖的分子设计师。
进 展
和竞争对手相比,Sugen在c-MET项目上的优势是他们的研发管线里已经有了一系列的RTK抑制剂。其中一个即将进入临床阶段的候选药SU11248(SU代表Sugen)成为c-MET项目的奠基石。SU11248,也就是后来的舒尼替尼或索坦,能够高效抑制多种RTK,包括PDGFR、VEGFR和c-KIT等。Sugen团队以SU11248为基础衍生出一系列化合物,试图找到能够抑制c-MET的分子。在几经波折后,他们获得了初步成功,找到了2号化合物(即SU-11274,图2和文末视频)。2号在生物化学实验中显示出对提纯的c-MET酶有很强的抑制作用(IC50 = 10 nM或10纳摩尔,IC50越低,或pIC50(-Log10IC50)越高,表明抑制效价越强),但在细胞实验中抑制效价却降低了100倍—— IC50只有1μM或1微摩尔。
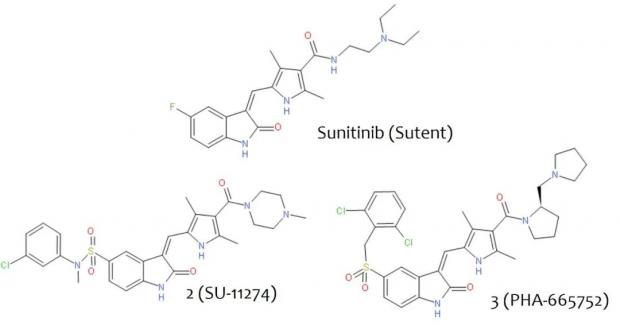
图2.通往克唑替尼路上的几个里程碑。景荣从2号或SU-11274开始做起,3号或PHA-665752是他们得到的第一个有高细胞活性的c-MET抑制剂,也是当时工业界细胞活性最好的c-MET抑制剂。
这种结果并不出乎意料。受体酪氨酸激酶在收到上游信号后,需要结合ATP分子,再把ATP的一个磷酸基团转给自己或其它蛋白,以完成磷酸化反应。Sunitinib 及其衍生物抑制激酶的主要机理就是与ATP竞争,钻进酶的ATP口袋中,占据ATP的结合空间使ATP无法与激酶结合,从而阻止激酶的下一步催化作用和信号传导。在细胞实验中,细胞里有很多ATP分子,2号化合物要和这些ATP竞争去结合RTK,抑制效价自然要降低数百倍甚至上千倍。
景荣1999年加入Sugen,第二年开始接手c-MET项目,成为该项目的化学负责人。她负责为项目制定目标和方略,同时亲自改造和设计新的分子。她的助手再按照她的想法把设计的化合物制备出来。之后,团队还要做各种实验来检测化合物的抑制活性。最后,他们根据新的化合物的活性来决定如何继续改造分子,新的一轮周期又重新开始,如此反复。化合物的制备有时也外包给别的公司。团队的目标就是在2号化合物的基础上设计出酶活性和细胞活性都高的分子。
景荣带领团队用了一年的时间终于优化出3号化合物,即PHA-665752(PHA代表Pharmacia)。3号的细胞活性大大提高,达到IC50=9nM,它在酶学实验中的活性也达到Ki=0.5nM。这意味着3号特异性地结合c-MET未激活时的构象。处于未激活状态的c-MET对ATP没有什么亲和力,所以3号在溶液里或细胞内都能有效地结合它,周围是否有高浓度的ATP对3号的抑制效价影响并不大。这恰恰是景荣和团队想要得到的—— 3号选择性地结合未激活时的c-MET,并锁定这种状态。3号的另一个优势是它的高选择性,它抑制c-MET的效价比抑制其它蛋白激酶的效价至少高出50倍。
3号在临床前实验中被广泛使用,确定了以c-MET为靶点治疗多种癌症的可行性。但3的成药性很差。它的分子量太大,超过了600,而理想的小分子药的分子量不应超过500;它组织渗透力较低,在水中的溶解性太差,在体内很快被降解代谢。景荣的下一个任务就是以3为模板,继续调整其化学结构,找到分子量小、脂溶性降低、成药性强的候选药。
困 境
“无法测量,就无法管理。” 如何判断下一代化合物比母代化合物更有优势?他们需要几个客观的指标来作为标杆。1997年,辉瑞制药的Lipinski发表论文总结了理想口服药的分子特性。从那以后,工业界和学术界制定了众多的综合参数指标,来帮助指导小分子药的结构优化。这些指标多用英文字母缩写来表示,对内行人来说都眼花缭乱:GE, LE, SILE, LLE, LELP, LipE, BEI, Fsp, SEI……景荣和她当时的团队(和以后在辉瑞的团队)主要依赖LipE。LipE (lipophilic efficiency)或亲脂性效率综合考虑了化合物的活性和亲脂性:
LipE = pKi(或pIC50) – cLogD
pKi或pIC50代表该化合物在溶液中或在细胞中对酶的抑制活性,而cLogD代表其脂溶性。LipE既考虑了化合物与靶蛋白的结合效价,又考虑了它的成药性。一个理想的候选药的LipE应该大于6。由于3号的脂溶性过高,虽然它的效价很高,它的LipE却只有4.85。优化3的主要量化目标就是将LipE提升到6以上。
到了这个节点,景荣和她的团队却陷入了困境。无论他们怎么改造3,添加或去掉某个基团,或改变某个原子,都无法再进一步。几个月过去了,他们还在优化3。一个又一个的新化合物被设计、合成出来,却又一个又一个被否定。2001年在挫败中结束。他们还是看不到希望。按景荣的话来说,如果一个典型的小分子药项目的发现阶段为期4年的话,那其中有3年半是在挫折和失败中度过的。
与大多数科研工作一样,药物的早期开发是 “熬” 出来的。日复一日的失败和灰心好像烈日下漫无边际、寸草不生的沙漠,炙烤着每个人的毅力和信心,而偶尔得来的胜利就像点缀于沙漠中的绿洲——宝贵而稀少,但又不能在此驻足太久。队伍还要找到下一个绿洲,直至走出沙漠,到达目的地。
突 破
事情的转机发生在2002年的春天。那一天,景荣终于收到了盼望已久的、由Pharmacia在意大利的团队提供的c-MET的激酶结构域(KD)结合了3号化合物的X射线衍射晶体结构。没有共晶结构的数据,他们优化药物结构的工作仿佛是在夜里摸黑前行,只能靠误打误撞,不能算是理性设计。但是获得一个蛋白的结晶也是一项很艰难的工作:首先要表达、提纯该蛋白,再不断摸索适合该蛋白的结晶条件,最后需要大量的计算。这里的每一步都不容易。
景荣忙完一天的工作后,带着晶体结构的几张图回到了家中。全家吃完饭、收拾利索后,她坐在沙发上,看着两个女儿在旁边玩。过了一会儿,她拿出了那几张图,仔细端详起来。女儿们的笑声和叽喳声逐渐听不到了,周围的一切仿佛都已消失,世界突然静了下来。她的眼中只有在空间中错落有秩、铺展开去的分子、原子和三维激酶结构。
景荣看到的是世界上第一个c-MET激酶与抑制剂结合的三维结构,它揭示了c-MET独一无二的非活化构象及3与之相结合的重要作用点。不同于其他激酶,c-MET激酶的激活环在非活性构象下伸进ATP的结合域,阻止了ATP的结合。3的核心骨架是由羟吲哚和吡咯环构成的。由于羟吲哚的C=O和吡咯环的NH形成分子内氢键,这个核心骨架成为一个处于同一平面的类四环结构。正是这种扁平结构才能有效地插进c-MET激酶的狭窄的ATP口袋中。羟吲哚的C=O和N-H和激酶铰链区的蛋白骨架形成了两个分子间氢键。3的一端的苄基通过含有磺酰基的联结链几乎转了180度,从而能够和c-MET激酶伸进ATP结合域中的激活环上的酪氨酸(Tyr-1230)形成了π-堆积作用力,进一步加强了3和酶的结合,将c-MET稳定在非活化的构象上。磺酰基上的O原子与蛋白骨干上的Asp-1222的N-H形成了第三个分子间氢键。3的另一端、吡咯环上伸出的酰胺取代基则延伸到激酶周围的溶剂中。简单地说,3与c-MET的结合主要依靠3个分子间氢键和一个独特的π-堆积作用力。
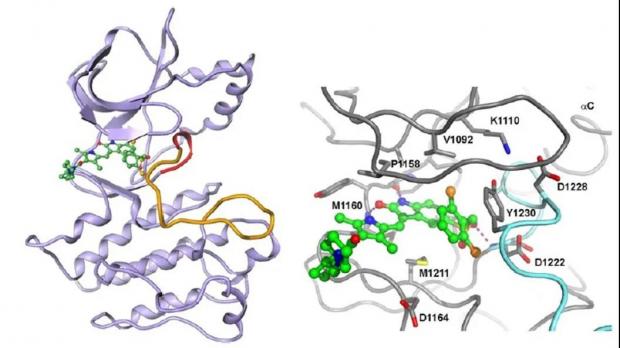
图3. 未磷酸化的、未活化的c-MET的激酶结构域与3形成的共晶结构。图片来源:参考资料5
景荣看到这个晶体结构的第一个感觉是,c-MET激酶具有非常独特的非活化构象。c-MET抑制剂不仅可以象ATP一样与铰链域相互作用,同时更重要和独特的是与激活环的作用。这也解释了一直以来c-MET抑制剂的研发困点。显然,3比较 “笨拙” 地堆放在ATP的结合域。羟吲哚和吡咯环形成的类四环结构过于庞大,横跨了整个ATP铰链区域,而迫使含有磺酰基的联结链以诡异的角度掉头,才能让2,6-二氯苯基与激活环上的酪氨酸(Tyr-1230)形成π-π堆积相互作用,但也因此让3的类四环结构偏离了最佳结合角度。另外,含有磺酰基的联结链占据了太大的分子量,完全可以简化。总之,3的整个结构相对于其功能来说,没有取得最佳效率,应该可以通过精简得到更有效的分子。
一个想法在景荣的脑海中逐渐清晰:用简单的2-氨基吡啶精简3的类四环核心结构,并进一步优化它和苄基之间的联结链。这种结构已完全跳出了3的框架。当然他们团队需要合成、测试一系列的化合物去验证这一思路。
景荣感到既兴奋又焦灼。她恨不得立刻回到实验室,召集团队,讨论下一步的计划。
也不知过了多久,她放下手中的几张图,从沉思中回到现实里。屋内,脆语连琐,嬉笑依旧。窗外,月朗星稀,花浓香溢。2002年春天的这个晚上,让景荣在不知不觉中完成了药物设计上的一次脱胎换骨的飞跃。
动荡中的前行
2002年5月,按照景荣新思路设计的以5-芳基-3-苄氧基-2-氨基吡啶为核心的一系列化合物的酶学数据出来了。虽然大多数化合物对c-MET的抑制活性降低不少,但这些分子和3号比,分子量降低了,成药性有所改善。其中几个化合物的活性数据更给团队带来了希望。药物分子优化从来都不是一帆风顺的,很多时候甚至会进一步退三步。每一个基团的改变或增舍都会带来很多变数。在蛋白三维结构的指导下,景荣分析了这一系列化合物的活性变化趋势后,认为这一新的方向是正确的。绿洲就在前方。
7月,景荣团队设计了更多的以5-芳基-3-苄氧基-2-氨基吡啶为骨架的化合物系列。双环羟吲哚被替换成单环的氨基吡啶,含有磺酰基的联结链被简化为醚基。他们委托一家公司去合成这些化合物,准备趁热打铁,沿着新方向深挖。
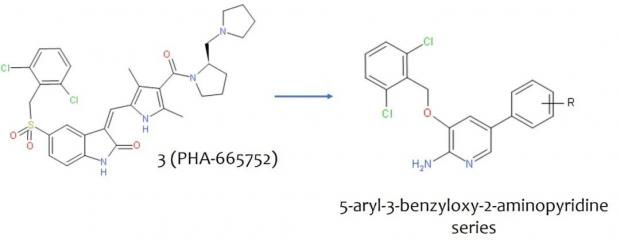
图4. 从3到5-芳基-3-苄氧基-2-氨基吡啶系列的跳跃
2002年7月15日,辉瑞宣布以600亿美元的价格收购Pharmacia,并计划用几个月的时间完成并购整合。辉瑞看重的是Pharmacia的镇痛和心血管药,包括Celebrex和Bextra,而对Sugen的管线项目并不重视。因此Sugen公司很有可能会被关闭。对每个Sugen的雇员来说,这一消息仿佛是晴天霹雳。大伙儿人心惶惶,开始四处投放简历,寻找下一步出路。
而此刻景荣领导的c-MET抑制剂正进入了关键阶段。5-芳基-3-苄氧基-2-氨基吡啶系列化合物能否有望挖掘出靶向c-MET的新款抗癌药将在这几个月揭晓。留给景荣团队的时间也只有这几个月了—— 他们在和时间赛跑。这一情形让人想起电影《泰坦尼克号》里的一幕:四个琴师在沉船之际、混乱之中,仍专心致志地拉好最后一支曲子。
2002年12月,景荣团队得到了5-芳基-3-苄氧基-2-氨基吡啶系列化合物的细胞数据。有几个成药性强的化合物显示了很好的苗头,LipE呈上升趋势。他们挑选了一个数据最好的候选药,开始进行动物实验。
2003年2月,那个候选药在小鼠实验中显示了良好的抗肿瘤活性,进一步坚定了景荣和同事们的信心。他们需要继续打磨这个候选药分子,将其结构进一步优化。但此时他们已经没有时间了。
2003年3月,Sugen公司正式关门解散。其知识产权虽然由辉瑞接手,但是将近400个职员中大部分将另谋出路,流落江湖。
抉 择
在动物数据出来之后,景荣就面临着一个艰难的抉择。是留在辉瑞,还是在北加州另找工作?辉瑞在北加州没有工作机会。她要想继续把c-MET项目做下去,需要向辉瑞在圣地亚哥的分部重新申请工作。一旦应聘成功,她需要搬回圣地亚哥。但如果不去辉瑞,很有希望的c-MET项目将被淹没在辉瑞众多的药物管线项目中。只有她在辉瑞,继续把这个项目做下去,继续宣传这个项目的潜力,这个候选药物才有可能在内部战略调整、组合平衡时不被挤掉。它就像她的一个孩子。她怎么放心把“孩子”交给别人呢?
但另一个选择同样让她为难。景荣已经在湾区安家落户——此前不久他们才搬进了新买的房子。而MBA毕业后的一山当时正在一家VC公司工作。两个女儿一个6岁,一个9岁,两人都很喜欢各自的学校和同学。北加州生物技术公司多如繁星,凭她的资历,景荣可以很快地找到下一份工作。他们可以说是过着最美满的生活。离开湾区去圣地亚哥工作意味着将打破这份美满,颠覆目前的一切。
景荣还是去辉瑞圣地亚哥面试了。不出意外,辉瑞给她发了聘书。但随之而来的是夫妻之间的多次反复讨论、甚至是争执。一山坚决不同意景荣搬回圣地亚哥。他很喜欢目前的工作,回到圣地亚哥将很难再有类似的机会。一家人在湾区生活得好好的,甚至会越来越好。为了一个前途未卜的候选药而牺牲这一切值得吗?
景荣还是坚持要去辉瑞继续这个项目。多次劝阻无效后,一山妥协了。他们卖掉了在湾区的房子。一山留在湾区租了间公寓。2003年的夏天,景荣带着两个女儿南下,再次把家安置在了圣地亚哥。
在之后的十年里,一山几乎每个周末都要往返于南北加州之间,与家人聚少离多。直到2013年,一山才从湾区完全搬回来。也就是在2013年,夫妻俩人在圣地亚哥联合创立了一家生物技术公司。此是后话,暂且不提。
和景荣一起离开湾区去辉瑞工作的还有跟她长期工作的两位化学师。Sugen公司将近400名雇员中,只有不到十分之一留在了辉瑞。
克唑替尼(Crizotinib)的诞生
景荣来到辉瑞后继续负责5-芳基-3-苄氧基-2-氨基吡啶候选药的分子优化工作。优化任何位置的任何基团都要设计、制备一连串的化合物,比较它们结构和活性的关系(SAR),从而找到适合该位置的最佳基团。分子优化工作可以被模块化——只要分子基本骨架确定,确定了某一位置的最佳基团后,团队再瞄准下一个位置,进行新一轮的SAR研究。每一轮所需要合成的化合物都至少要有十几个。

图5. 景荣和辉瑞的同事们在讨论数据。图片来源:参考资料1
2004年5月,景荣团队完成了优化工作,确认了最终的候选药分子—— 第63号化合物。从3到63的征程实际上远超过60个中间化合物。某一编号可能代表多个化合物,比如14系列至少有11个类似的分子。还有很多中间化合物并没有编号,也没有记载在文献中。
63号,或PF-02341066(PF代表辉瑞)的分子量只有450.34,酶活性达到Ki=1nM,细胞活性达到IC50=8nM,LipE为6.14。与3相比,63保持了高活性,但成药性大大提高。它后来被命名为Crizotinib或克唑替尼。文末视频简要介绍了克唑替尼诞生的历程,及它还有3与c-MET的结合机制。
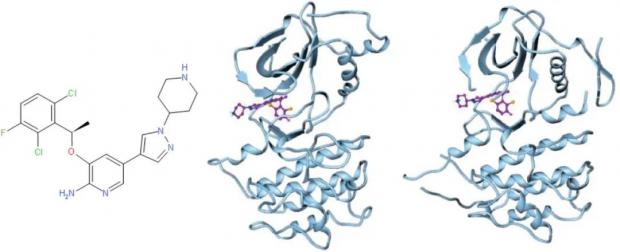
图6. 克唑替尼。右边两图分别为克唑替尼与MET和ALK形成的共晶结构。图片来源:参考资料7
在后续的研究中,克唑替尼被发现对激酶有高度的选择性—— 它高特异性地抑制c-MET,ROS和ALK(间变性淋巴瘤激酶),但对其它激酶的细胞抑制活性却很低。这预示着克唑替尼在临床中的安全性会很好。
2006年4月,克唑替尼进入一期临床试验。正如预估的一样,克唑替尼显示了良好的耐受性和安全性。
赛可瑞(Xalkori)的上市
2007年,日本和中美合作的两个团队分别独立地发现,一种ALK融合基因—— EML4-ALK—— 是4-7% 非小细胞肺癌(NSCLC)中的驱动致癌基因。而克唑替尼可以抑制EML4-ALK酶,在理论上可以治疗EML4-ALK阳性的非小细胞肺癌。在马萨诸塞州综合医院(MGH)和科罗拉多大学的帮助和建议下,辉瑞决定将克唑替尼转向ALK阳性的肺癌。在还没有动物肺癌模型数据的情况下,辉瑞依然扩展了还在进行的一期临床试验,引进了ALK融合基因检测的步骤,预先选择带有融合ALK基因的NSCLC患者,专注评估克唑替尼对这些NSCLC的疗效。
在这个一期临床试验中,克唑替尼在119名融合ALK基因阳性的NSCLC患者中取得了61%的客观缓解率(也就是说,61%的患者中肿瘤或者完全消失,或者明显萎缩)。在随后的二期试验中,克唑替尼在前136名融合ALK基因阳性的NSCLC患者中取得了50%的客观缓解率。凭借这些数据,克唑替尼在2011年8月26日被美国FDA批准上市。
克唑替尼的商品名为赛可瑞或Xalkori。赛可瑞被认为是肿瘤药物研发史上开发速度最快的药物之一,从驱动基因的确认到靶向药物上市只有短短4年的时间。但其实在2007年前,克唑替尼已经经历了7、8年的艰辛开发过程。

图7. 2011年10月,在赛可瑞上市启动会议上,景荣和参加了临床试验的肺癌患者、辉瑞的同事的合影。图片来源:
赛可瑞上市的一个重要意义在于,它是个体化治疗和精准医疗的理念在癌症中的成功应用。FDA在批准赛可瑞的同时,也批准了其伴随诊断方法—— 由雅培生产的检验ALK断裂的FISH检测试剂盒。赛可瑞成为最早通过肿瘤分子标志物决策、针对癌症患者亚群的治疗方式之一。
2013年2月,赛可瑞获得中国国家食品药品监督管理局的批准,进入中国市场。从临床试验的数据看,赛可瑞可能更适合亚裔患者。在同等剂量下,赛可瑞在亚裔患者平均体内浓度比其他患者高。在临床试验中,亚裔患者对赛可瑞响应率更高,无进展生存期(PFS)更长。
2017年,赛可瑞全球销售额上升至峰值,达到将近6亿美元。
续写传奇
2011年,崔景荣博士及其辉瑞公司的克唑替尼化学团队被授予第38届美国国家年度发明家奖。
除了克唑替尼,景荣在辉瑞还成功地设计了克唑替尼的替代药物—— Loratinib或劳拉替尼。和克唑替尼相比,劳拉替尼的优势是它能穿越血脑屏障,可用于治疗转移到脑中的继发性肿瘤。另外,它还能抑制对克唑替尼产生耐药性的突变ALK蛋白。在今年9月发布的三期临床数据中,在ALK阳性的NSCLC患者中,劳拉替尼无论是在客观缓解率还是无进展生存期上都远优于克唑替尼。劳拉替尼在2015年被FDA批准治疗二线或三线的ALK阳性NSCLC。辉瑞正在扩展它的适应症。
景荣设计劳拉替尼的故事也非常具有传奇色彩。以后有机会希望能把这段故事写在另一篇文章中。
2013年,景荣离开辉瑞,和彻底回到圣地亚哥的一山联合创立了 Turning Point Therapeutics 生物技术公司。作为科学创始人,她为公司设计、研发了四个新的候选药,其中三个已进入临床阶段。
2019年4月,Turning Point Therapeutics 在纳斯达克成功IPO。在挂牌交易的第一天,公司的股票价格上扬61%。
2020年6月,景荣从 Turning Point Therapeutics 辞去了所有职务。她创立的丰富管线为公司的发展奠定了良好的基础。公司可以在专业人才的管理下完成临床试验,为癌症病人带来新的希望。而她希望可以有更多的时间专注研究目前癌症药物开发的盲点,开始下一个征程。
回顾过去,景荣对家人有很多歉疚。她说自己不是一个合格的母亲,没有花很多时间陪伴两个女儿。即使在她们身旁时,她大部分时间人在心不在,脑子里还会在琢磨实验的事儿。她觉得自己非常自私,为了c-MET抑制剂项目执意南下,把先生孤孤单单一个人撂在北加州。或许正是由于她的 “不合格” 和 “自私”,或许其实是她的专注和执着,景荣才能创造出一个接一个的传奇,让世界上成千上万的患者受益。一个创新药的诞生,不仅仅需要几个辉煌瞬间,更需要坚持和牺牲、汗水与泪水。
- 致 谢 -
几年前我第一次听到科大师姐崔景荣博士发明赛可瑞的故事,就想把它写下来。结果拖了几年才如愿以偿。感谢景荣在电话里花了很多时间耐心地回答我的问题。感谢她对我的初稿提出的很多宝贵意见。这段药物研发史远比我第一次听到的故事更曲折、更动人。感谢师姐给我这个机会,把它记录下来。
参考资料
1. Rockoff, J. D. (2013) How Computers Are Helping Drug Companies Find New Medications in The Wall Street Journal
2. Shultz, M. D. (2013) Setting expectations in molecular optimizations: Strengths and limitations of commonly used composite parameters, Bioorg Med Chem Lett. 23, 5980-91.
3. Lipinski, C. A. (2004) Lead- and drug-like compounds: the rule-of-five revolution, Drug Discov Today Technol. 1, 337-41.
4. Lipinski, C. A., Lombardo, F., Dominy, B. W. & Feeney, P. J. (2001) Experimental and computational approaches to estimate solubility and permeability in drug discovery and development settings, Advanced drug delivery reviews. 46, 3-26.
5. Cui, J. J., McTigue, M., Kania, R. & Edwards, M. (2013) Chapter Twenty-Five - Case History: Xalkori™ (Crizotinib), a Potent and Selective Dual Inhibitor of Mesenchymal Epithelial Transition (MET) and Anaplastic Lymphoma Kinase (ALK) for Cancer Treatment in Annual Reports in Medicinal Chemistry (Desai, M. C., ed) pp. 421-434, Academic Press.
6. Garber, K. (2003) Sugen falls as casualty of Pfizer–Pharmacia merger, Nature Biotechnology. 21, 722-723.
7. Ou, S. H., Bartlett, C. H., Mino-Kenudson, M., Cui, J. & Iafrate, A. J. (2012) Crizotinib for the treatment of ALK-rearranged non-small cell lung cancer: a success story to usher in the second decade of molecular targeted therapy in oncology, Oncologist. 17, 1351-75.
8. Cui, J. J., Tran-Dube, M., Shen, H., Nambu, M., Kung, P. P., Pairish, M., Jia, L., Meng, J., Funk, L., Botrous, I., McTigue, M., Grodsky, N., Ryan, K., Padrique, E., Alton, G., Timofeevski, S., Yamazaki, S., Li, Q., Zou, H., Christensen, J., Mroczkowski, B., Bender, S., Kania, R. S. & Edwards, M. P. (2011) Structure based drug design of crizotinib (PF-02341066), a potent and selective dual inhibitor of mesenchymal-epithelial transition factor (c-MET) kinase and anaplastic lymphoma kinase (ALK), J Med Chem. 54, 6342-63.
9.
10.
文章来源于礼来亚洲资本
话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。




 京公网安备 11010502034662号
京公网安备 11010502034662号 