阅读:0
听报道
撰文 | 玉 宝
责编 | 叶水送
● ● ●
白血病患者Emily Whitehead可以说是CAR-T细胞治疗的代言人。最近美国两组科研团队在实验室同时成功地诱导出造血干细胞,为未来治疗这类疾病,提供了又一可能的方法。
北京时间5月18日,Nature杂志同时发表两篇论文,介绍美国两组科研团队在实验室通过转录因子诱导的方法,生成了造血干细胞样细胞,之所以称为造血干细胞“样”细胞,是因为其在小鼠体内可分化成血细胞,与血液干细胞在分子和功能层面仍有差别。
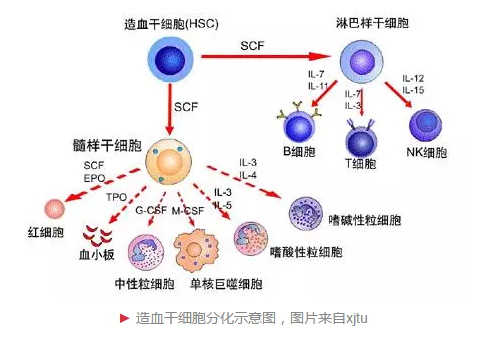
血液细胞的生发和转化,要靠造血干细胞。造血干细胞是所有血细胞的原始细胞,若功能异常则会发生凝血异常、白血病等血液疾病。与全能性干细胞相比,造血干细胞为专能性干细胞,主要分化为红细胞、白细胞、血小板等血细胞,它具有干细胞自我更新和不断分化的特点。
胎儿期的造血干细胞主要产生位置依次是:卵黄囊(2-3周)、肝脏和脾脏(2-3月)和肝脏、骨髓(5月-出生)。出生后,主要的造血部位在骨髓。不过,今年三月,一篇Nature论文颠覆了教科书的观点——肺不仅是呼吸器官,还具有造血功能,人体内一半多的血小板在肺部生产。就血液细胞来说,也存在“一专多能”的现象,如红细胞不仅可以运输氧,也是人体重要的免疫细胞。

在上述本周发表的最新论文中,哈佛大学附属波士顿儿童医院George Daley实验室人工制备了造血干细胞,用的7个转录因子分别是ERG, HOXA5, HOXA9, HOXA10, LCOR,RUNX1以及SPI1。实验采用的诱导策略是:首先通过干预形态素(Morphogen)信号通路将人体多能干细胞转化为生血内皮细胞,然后通过7个转录因子,血管内皮细胞被诱导成造血干细胞样细胞。这些造血干细胞样细胞连续移植入两代小鼠体内,都具有分化成为髓系、B细胞和T细胞的能力。

在同期发表的另一篇论文中,康奈尔大学医学院Shahin Rafii实验室,使用成年小鼠内皮细胞作为初始材料,用了4个转录因子Fosb, Gfi1, Runx1和Spi1,外加一个血管分泌因子,诱导内皮细胞去分化,变成造血干细胞样细胞。然后利用干细胞环境信号使造血干细胞成熟。此种方法所得的干细胞具有造血干细胞的几乎所有特征:移植入受体体内,可以分化成多种类型的血细胞。
笔者认为,两个团队的工作令人鼓舞,但这两篇文章采用的诱导技术仍需要进一步改进:提高干细胞的诱导效率、更安全的转录因子载体或工具(如CRISPR-Cas9)、解决移植后的成瘤性问题、以及造血干细胞样细胞的促分化。从而把造血干细胞样细胞变成真正的造血干细胞。对于造血干细胞样细胞的表观遗传情况,也值得进一步研究。
两个实验室的研究工作,不仅是血液学领域的重大突破,也是干细胞研究的一大进展。毋容置疑,从实验室的基础研究到临床应用有一定的距离,通过一个个这样的研究进展,距离正在一点点缩小。
在未来,上述研究有望实现个性化的白血病疗法,源于病人自身的造血干细胞就可治疗白血病;这或将解决当今骨髓库骨髓紧张、配型困难等问题。这两项进展对于细胞疗法、药物筛选和白血病治疗等可能产生很大的推动。
参考文献
Ryohichi Sugimura et al. Haematopoieticstem and progenitor cells from human pluripotent stem cells. Nature. 2017.
Raphael Lis. Conversion of adultendothelium to immunocompetent haematopoietic stem cells. Nature. 2017.

话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。




 京公网安备 11010502034662号
京公网安备 11010502034662号 