阅读:0
听报道

如何采取负责任的态度和措施,保证科学的纯洁和廉正?| 图源:
编者按
最近,相继出现的两篇文章对简单的敲除或者表达某个基因可以让某些细胞转变成神经元提出质疑。这给如火如荼的神经再生领域泼了盆凉水,不仅引发激烈辩论,同时也给神经退行疾病的治疗前景蒙上了一层阴影。
由于声称有希望治疗一些神经退行病变,如帕金森病、青光眼等,神经再生的研究进展得以 “出圈” 受到民众和投资者的关注。同时,因为脊髓损伤和再生领域,面临的问题难度大而且实验相对复杂,经常出现声称的 “突破性发现”,让人真假莫辨。
如何采取负责任的态度和措施,保证科学的纯洁和廉正?本刊邀请到约翰·霍普金斯大学医学院教授周峰泉对神经再生领域进行深入的评述并辅以详实的案例展示,他认为,在科研中,面对不同的结果,装作漠不关心是错误且缺乏远见的。
撰文|周峰泉 钱诚
责编|邸利会
据世界卫生组织统计,截至2007年,全球每6人之中就有1人罹患某类神经系统疾病。随着各国步入老龄化社会,神经系统疾病,特别是与衰老相关的神经退行病变势必影响越来越多的人。
阿尔兹海默、帕金森、青光眼、黄斑退行性病变,渐冻人(肌萎缩性脊髓侧索硬化症)已为人们熟知;此外还有中风,脑外伤,脊髓损伤等急性病变,糖尿病或者肿瘤放化疗造成的诱发型神经损伤等等。
然而,残酷的是,这些疾病,目前却没有任何有效的治疗方案和方法。为什么这么难呢?
1 成人中枢神经系统没有自然再生能力
神经系统通过传导电信号实现认知思考,调配运动,感受世界。除去大量的辅助细胞,负责最主要传导工作的是神经细胞,也叫神经元。
除了细胞体,神经细胞还有一根修长的轴突用以传导信号。神经细胞的轴突可以汇集成束,绵延很长的距离。轴突可以很长,但它和细胞体是贯通的,仍然是一个细胞,这意味着神经细胞内部出现问题继而死亡,受到外部创伤,受到不利细胞外环境和周围细胞影响的几率显著增加。
恰恰不幸的是,不同于其它某些组织(比如皮肤),成年人类的中枢神经系统没有自然再生能力(见《知识分子》文章 “伤脑筋,成年后人脑海马区神经元不再更新”),鲜有自发地从干细胞产生新的神经细胞,受损的轴突又不能自发重新生长回到原有目标。也就是说,中枢神经不仅仅只会越用越少,而且一旦出现问题往往是恶性循环,加速退变。
是什么诱发了中枢神经疾病?毫无疑问,衰老是一个综合且重要的因素。这可以是神经细胞内部问题导致的(比如细胞器功能障碍,细胞代谢负担加重,整体上基因表达平衡和染色质稳定性出现了变化等等),也可以是外部因素,或者内外因素发生了复杂的动态过程(比如长期的炎症反应等等)。
需要强调的是,各类中枢神经系统疾病共通的结局,无一例外经历了渐进的轴突损失和最终不可逆转的神经细胞死亡,这也是这些疾病能够造成不可逆功能障碍的根本原因。比如,急性外伤或者脑中风可以迅速造成大量神经细胞死亡。大多数慢性退行性病变均显示出不同脑区神经轴突和细胞或多或少,或快或慢的数量减少。
2 来自斑马鱼视网膜的启发
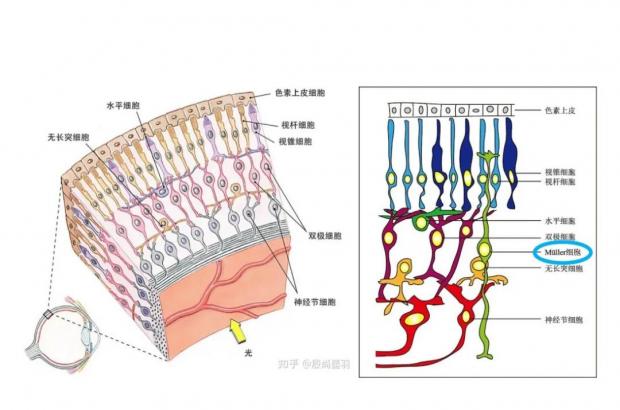
双眼的位置虽然存在于大脑之外,但视神经自眼球起始向脑内区域投射,从谱系特质与髓鞘外环境来看,视网膜内神经细胞属于中枢类别。
同样,人类视网膜神经细胞不存在自发再生,很多视觉功能障碍也源自衰老,退行病变与外损伤造成的神经细胞损失。
青光眼是人类头号致盲因素,是一种不可逆疾病。高眼压或者视网膜神经细胞对于眼压的敏感是青光眼的显著标志,也是造成视网膜神经节细胞和视神经死亡的主要原因之一。据统计,青光眼的病理进程可以通过降低眼压30-50%来阻断。
除了青光眼这类眼科疾病,源于眼球与大脑通过视神经的这种直接联系,新研究显示,眼部有望作为窗口来进行老年痴呆症和帕金森症的早期诊断——眼部的位置很有利于观察和非手术型接触。科研人员对这种策略寄予了很大希望。
非常有趣的是,与人眼不同,斑马鱼的视网膜乃至整个眼球在受到损伤之后可以自发完全组织再生。这源于斑马鱼穆勒胶质细胞(Müller cells)感应损伤刺激后退分化到类似于视网膜前体细胞的状态,迁移到视网膜各层,重新分化产生神经节神经元、视锥、视杆细胞、双极细胞等等。
沿进化树看,禽类还部分保有这种神奇功能,幼年禽类的视网膜可以一定程度上自发再生。可高等哺乳动物,特别是人类成熟的神经系统就完全丢失了这种能力。
这一方面提示可以通过探索斑马鱼视网膜的奥秘,推动再生医学和制药进展;另一方面也暗示,出于人类神经系统的体量和复杂程度,自然再生这个功能,想必会造成一些新的无序的神经联结,可能是随进化被舍弃掉的。
3 中枢神经再生,我们准备好了吗?
之前一些比较传统的治疗方案,旨在缓解一些神经紊乱的症状,或者依赖某种原理减慢与阻断神经病变进程,但是这些方法都无法填补显著减少的神经数量。
近年来,细胞重编程获得蓬勃发展。通俗地讲,重编程就是人为操纵某种细胞进行谱系变换,转变到另一种细胞的身份、状态,并且执行功能。
细胞重编程给再生医学提供了新的理论基础。如今,中枢神经再生主要有3个策略。
第一种是干细胞移植,就是将多能干细胞分化成新生神经从而填补损失的神经细胞。
第二种是胶质细胞转分化,就是将存在于神经细胞减少的脑区,或者视网膜之中高丰度的其它类型细胞直接在组织原位身份转换成为新的神经细胞,比如大脑中的星形胶质细胞或者视网膜中的穆勒胶质细胞,等等。
胶质细胞转分化的策略有很多优势,比如无需大型手术,胶质细胞理论上在损伤和人为操控的情况下能够先分裂增殖,这样既能填补显著减少的神经细胞,又能维持胶质细胞本身的辅助功能。所以细胞转分化理论上确实是个很不错的理想途径。
第三种策略是施用转基因或者药物,尽可能将受损的原有神经细胞保护下来,再促使这些损伤神经细胞本身的轴突重新延伸出去与目标连接。
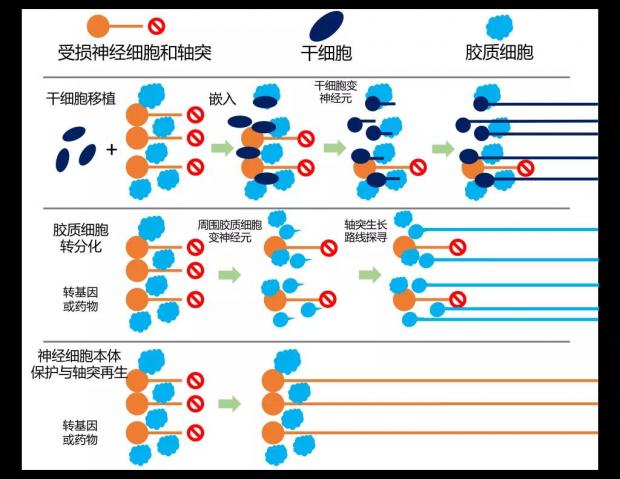
值得强调的是,在上述三种进程的中后期,不管是新生出来的神经细胞,还是保护下来的原有神经细胞,都必须经历快速地远距离轴突延伸,体内路线探寻,髓鞘再生和突触再形成——这才具备了神经功能恢复的生理结构基础。
基于当前人类科技,很难想象上述一系列历程可以被单基因或者单种药物操控。
同样,不像胚胎发育时期的体量,成年人类中枢神经的距离和各类成年时期细胞外环境,也势必给行进的轴突前沿带来巨大的未知性和阻挠。
颇具代表性的,上调NeuroD1基因经历了很多体外细胞实验的论证,显示这种操控有能力将胶质细胞转换成为神经元细胞。自然而然,多个实验室开展了小鼠体内实验,并且报道高表达NeuroD1可以将皮层或者纹状体星形胶质细胞转换成新生神经细胞,存在有效的轴突再投射和神经功能恢复。
另一个最近比较热门的研究是下调Ptbp1基因实现胶质细胞-神经元细胞转分化,例如在纹状体敲降Ptbp1与上调NeuroD1基因有类似的转分化效果。在小鼠视网膜敲降Ptbp1则获得了比较复杂的结果,有的实验室发现穆勒胶质细胞被转分化变成视神经节神经元和双极细胞,有的实验室发现穆勒胶质细胞被转分化变成了视锥细胞。
然而,最近登刊的几篇文章再次考察了上述结论,并得出了否定的结果。
德州大学西南医学中心的张春立教授实验室在Cell 发文,用小鼠体内实验,通过谱系追踪发现在皮层或者纹状体的星形胶质细胞特异性高表达NeuroD1或者敲降Ptbp1,均无法成功转分化成为神经元细胞。
他们认为,其它实验室先前发表的研究结果可能是因为一种特殊的实验假象而造成错误的解读。
具体来说,张春立教授实验室的研究结果表明,原来大家经常用来在胶质细胞中特异性表达NeuroD1基因或者敲低Ptbp1基因的病毒载体AAV-GFAP启动子丧失胶质细胞特异性,而错误地标记了旧的原有神经元细胞。是什么原因造成的特异性丢失目前尚不清楚,有人质疑可能是因为实验中所用的病毒滴度太高。
但近期,约翰斯-霍普金斯医学院的Seth Blackshaw教授实验室,利用遗传谱系示踪和单细胞测序谱系追踪,通过传统基因敲除方法(不涉及使用病毒)明确地展示了去除Ptbp1无法将视网膜的穆勒胶质细胞,或者皮层、纹状体的星形胶质细胞转变成神经元。
我们希望这些不同的研究结果可以通过正常交流、合作,以及其它实验室的独立重复实验得到解决,毕竟,科学研究的终极目标是去伪存真,造福人类。
4 如何解决科研的争议?
在科学研究中,同样的研究得到不同的结果是很正常而且普遍的。生命科学目前还停留在实验科学阶段,由于实验条件、样品、动物、仪器设备、实验技术略有不同而得到完全不一样的结果,也不意外。
那么,如果遇到这种情况怎么解决呢?是互相指责,争论,还是装作漠不关心——反正文章已经发了,荣誉、经费也到手了,实验结果的对错,有什么关系呢?其实,这样的态度和解决问题的方法是错误且缺乏远见的。
从个人事业看,这种做法会损伤一个人在其学术领域内的名声和信誉;如果是作为导师,还会误导学生在未来学术发展的判断力甚至伤害他们的人生观。
从社会的角度上看,如果利用错误的实验结果获得风险投资并针对疾病开发治疗药物,则是对宝贵社会资源的巨大浪费。
针对学术争议,目前学术界广泛认可的做法一般有三种:
一是实验室自我更正;二是得出不同结果的实验室相互交流并找出问题所在;第三种是由独立第三方的一个或多个实验室尽量按照同样的实验条件进行重复。
我想提及几个在神经损伤、修复和再生领域的故事, 也许大家可以思考并判断哪种做法最为合适。
第一个故事是关于脊髓再生研究中的一个重要发现,我作为旁观者亲身参与了故事的开端。
众所周知,成年哺乳动物中枢神经损伤以后无法再生,所以人们在车祸或者体育运动过程中脊髓损伤后的主要症状就是半身瘫痪,目前基本上没有治疗手段。
在上世纪90年代,瑞士的 Martin Schwab 实验室发现,在中枢神经系统中的一类神经胶质细胞里可能存在抑制神经再生的蛋白。他们用这种含有这种蛋白的提取物作为抗原,研制开发了一个名称为IN-1的单克隆抗体。当把生产这个抗体的细胞移植到脊髓损伤的小鼠体内,他们发现小鼠的神经再生能力增强了,甚至有一些功能性的恢复 [1, 2]。
一个重要的问题就是,这个IN-1抗体的抗原到底是哪个蛋白质?2000年,在 Nature 杂志上同时有三篇文章报道了这个抗体的抗原是一个叫Nogo的蛋白质。那么如果能在小鼠中把这个编码Nogo的基因去掉,是不是小鼠脊髓损伤后再生能力就会增加呢?
大概是在2002年,也是我做博士后的第2年,有一篇关于Nogo基因敲除后脊髓再生研究的文章送到了我博后导师手里进行审稿,准备在Cell 杂志发表。来自耶鲁大学实验室的研究发现,Nogo基因敲除小鼠脊髓损伤以后有非常明显的神经纤维再生现象,而且有显著的运动功能恢复。
当时,大家一致认为这是神经再生领域的一个突破性发现,应该得以发表。但是有趣的是,在我们的审稿意见还没有返还给杂志编辑之前,Cell 杂志社又送来了另一篇来自于斯坦福大学的研究文章,同样也做了一个Nogo基因敲除小鼠模型,却发现这个小鼠在脊髓损伤以后没有看到明显的神经再生。这与耶鲁大学的结论正好相反。
作为审稿人,我们无法判断到底谁的结论是正确的,因此我们当时的意见就是希望这两个实验室能够相互沟通,然后找到得到不同结论的原因。
这个故事的结局是什么呢?
据说,耶鲁和斯坦福两个实验室进行了一些讨论和交流,而且互相交换了各自做出来的Nogo基因敲除小鼠。来自斯坦福的研究坚持了原来的结论,认为在敲除Nogo基因后小鼠脊髓再生并没有得到增强。而来自耶鲁大学的研究者发现他们实验中有几只年纪比较大的小鼠没有看到很好的神经再生现象,因此认为敲除Nogo基因可以促进年青小鼠的神经再生和功能恢复。最终这两篇文章并没有发表在Cell 杂志上,而是2003年同时发表在Neuron 杂志上 [3, 4]。在同一期杂志里还发表了另一篇来自瑞士 Martin Schwab 实验室的研究 [5],其结论与耶鲁大学研究基本一致。
当然故事到此并没有结束。
后来,斯坦福大学研究者用来自耶鲁大学的老鼠重复了他们的实验。他们发现如果在实验最后一步使用荧光染料标记再生神经纤维的时候发生泄漏,会观察到脊髓损伤远端有许多类似再生的神经纤维,因此推测耶鲁大学实验室看到的神经再生也许是荧光染料泄露造成的 [6]。
2005年,斯坦福大学实验室又在PNAS 杂志上发文表明,基因敲除编码Nogo蛋白的受体的基因也不能促进小鼠脊髓损伤后的神经再生 [7]。2010年斯坦福大学文章的第一作者在加州大学圣地亚哥分校自己实验室发表论文证明,同时敲除包括Nogo在内的三个编码神经再生抑制蛋白的基因也无法促进小鼠脊髓再生 [8]。
目前神经再生领域内的一致观点是,单纯敲除某一类再生抑制基因并不能有效促进中枢神经系统神经再生——
首先,神经系统内目前至少有三大类神经再生抑制蛋白,而Nogo蛋白只代表其中一类;其次,成年哺乳动物中枢神经元丧失了神经再生的内源动力,因此即使在外部环境允许的条件下也不能有效再生。
第二个故事也与脊髓损伤再生相关。
在脊椎损伤后,除了断掉的神经纤维重新生长,另外一个办法就是将神经干细胞移植到损伤的脊髓内,并让它们分化为神经元从而进行功能修复。
2012年,加州大学圣地亚哥分校的一个神经再生实验室在Cell 杂志上发表文章,报道了一项重大进展 [9]。他们发现,移植到损伤的脊髓内神经干细胞通过各种细胞生长因子刺激可以成功分化为神经元并向头尾两端长出很长的神经纤维。最重要的是,这些新长出来的神经纤维就可以作为一个桥梁在损伤处连接上下两端原有的神经组织,从而部分修复脊髓损伤造成的运动功能丧失。
这一研究结果得到了神经再生领域内的所有科研人员的密切关注。那么,结果是否确实可靠,可以重复实现呢?
加州大学尔湾分校的一个实验室按照这篇文章的具体方法重复了这一实验 [10]。他们重复的结果发现,移植的神经干细胞的确能分化为神经元并长出神经纤维。但是这些新神经元及其纤维却不能和脊髓内原有的神经组织形成功能性连接,所以没有观察到任何运动功能恢复。
虽然我们不知道为什么两组实验结果不一样,但是起码表明对于任何实验手段相对复杂且结果很好的研究不能盲目相信,要有存疑的概念。
第三个故事是关于如何通过细胞移植修复由视网膜感光细胞(视杆和视锥两种感光细胞)退化或死亡而导致的失明。
伦敦大学学院眼科学系 Robin Ali 教授实验室在此研究领域于2006年和2012年在Nature 杂志上发表了两篇相关文章 [11,12]。他们发现,如果将初步分化的视杆前体细胞移植到成年小鼠正在退化的视网膜里,这些前体细胞会整合到原有的视网膜中并分化成有功能的视杆细胞,从而修复视觉功能。
许多其他实验室用类似的方法也得到了相同的结果。因此领域内一致认为,这是一个有临床应用前景的方法。
但是,在2016年 Robin Ali 教授实验室经过一系列实验发现,前面这些研究中普遍认为来源于移植细胞的有功能的视杆细胞其实是原视网膜里已经丧失功能的宿主细胞 [13]。
那么这些旧的视杆细胞是如何恢复功能并同时拥有移植细胞特异标记的荧光蛋白的呢?真正的原因是通过细胞与细胞间的细胞质交换。带有荧光蛋白标记的移植细胞通过细胞质交换可以把蛋白质和信使RNA转移给原来的宿主细胞。如果转移的细胞质中含有损伤/疾病中宿主细胞缺少的功能蛋白质, 如peripherin-2和rhodopsin等,那么这些宿主细胞就会重新恢复功能。
同年另一篇研究文章 [14] 也发现了同样的移植-宿主细胞间的细胞质交换。
虽然后面的研究从表面上看好像是推翻了从前的研究结论,但实际上细胞质交换有可能是一种更好更有效的修复视网膜感光细胞功能的方法。
当然为了更好的保证科学研究的准确性和可重复性, 需要各方面的共同努力,包括科学研究人员自己和科研经费管理部门。
前两个故事都在脊髓损伤和再生领域,由于面临的问题难度大而且实验相对复杂并涉及到大量活体动物实验,该领域经常有 “突破性发现”,但实际上许多发表的文章难以让人信服。
因此,2014年由美国迈阿密大学医学院脊髓再生研究中心的几位专家牵头,联合全世界几十个从事神经再生研究的实验室,发表了一篇文章 [15],其中明确而详细列地建议了今后在发表脊髓损伤与再生研究的文章中必须要写出的一些实验条件和实验过程,从而增加该领域科学研究的透明度与可重复性。
另外,美国政府医药健康领域的主要经费管理机构NIH曾在2007年专门划拨了一笔经费资助脊髓损伤和再生研究实验技术的培训以及对某些重要发表成果进行独立重复实验。
这些都是一些好的 “拨乱反正” 的措施,值得借鉴。
参考文献:
[1] Bregman BS, Kunkel-Bagden E, Schnell L, Dai HN, Gao D, Schwab ME. Recovery from spinal cord injury mediated by antibodies to neurite growth inhibitors. Nature 1995, 378: 498-501.
[2] Schnell L, Schwab ME. Axonal regeneration in the rat spinal cord produced by an antibody against myelin-associated neurite growth inhibitors. Nature 1990, 343: 269-272.
[3] Kim JE, Li S, GrandPre T, Qiu D, Strittmatter SM. Axon regeneration in young adult mice lacking Nogo-A/B. Neuron 2003, 38: 187-199.
[4] Zheng B, Ho C, Li S, Keirstead H, Steward O, Tessier-Lavigne M. Lack of enhanced spinal regeneration in Nogo-deficient mice. Neuron 2003, 38: 213-224.
[5] Simonen M, Pedersen V, Weinmann O, Schnell L, Buss A, Ledermann B, et al. Systemic deletion of the myelin-associated outgrowth inhibitor Nogo-A improves regenerative and plastic responses after spinal cord injury. Neuron 2003, 38: 201-211.
[6] Steward O, Zheng B, Banos K, Yee KM. Response to: Kim et al., "axon regeneration in young adult mice lacking Nogo-A/B." Neuron 38, 187-199. Neuron 2007, 54: 191-195.
[7] Zheng B, Atwal J, Ho C, Case L, He XL, Garcia KC, et al. Genetic deletion of the Nogo receptor does not reduce neurite inhibition in vitro or promote corticospinal tract regeneration in vivo. Proc Natl Acad Sci U S A 2005, 102: 1205-1210.
[8] Lee JK, Geoffroy CG, Chan AF, Tolentino KE, Crawford MJ, Leal MA, et al. Assessing spinal axon regeneration and sprouting in Nogo-, MAG-, and OMgp-deficient mice. Neuron 2010, 66: 663-670.
[9] Lu P, Wang Y, Graham L, McHale K, Gao M, Wu D, et al. Long-distance growth and connectivity of neural stem cells after severe spinal cord injury. Cell 2012, 150: 1264-1273.
[10] Sharp KG, Yee KM, Steward O. A re-assessment of long distance growth and connectivity of neural stem cells after severe spinal cord injury. Exp Neurol 2014, 257: 186-204.
[11] MacLaren RE, Pearson RA, MacNeil A, Douglas RH, Salt TE, Akimoto M, et al. Retinal repair by transplantation of photoreceptor precursors. Nature 2006, 444: 203-207.
[12] Pearson RA, Barber AC, Rizzi M, Hippert C, Xue T, West EL, et al. Restoration of vision after transplantation of photoreceptors. Nature 2012, 485: 99-103.
[13] Pearson RA, Gonzalez-Cordero A, West EL, Ribeiro JR, Aghaizu N, Goh D, et al. Donor and host photoreceptors engage in material transfer following transplantation of post-mitotic photoreceptor precursors. Nat Commun 2016, 7: 13029.
[14] Santos-Ferreira T, Llonch S, Borsch O, Postel K, Haas J, Ader M. Retinal transplantation of photoreceptors results in donor-host cytoplasmic exchange. Nat Commun 2016, 7: 13028.
[15] Lemmon VP, Ferguson AR, Popovich PG, Xu XM, Snow DM, Igarashi M, et al. Minimum information about a spinal cord injury experiment: a proposed reporting standard for spinal cord injury experiments. J Neurotrauma 2014, 31: 1354-1361.
话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。




 京公网安备 11010502034662号
京公网安备 11010502034662号 