 云南虫化石
云南虫化石
编者按
7月25日,中国科学院院士、西北大学教授舒德干向《知识分子》投稿,就7月8日Science杂志发表的一项研究距今5.18亿年的澄江生物群云南虫的工作,提出了不同看法(争鸣 | 舒德干:被热炒的云南虫,究竟是不是脊椎动物?)。对此,该论文的联合通讯作者、南京大学地球科学与工程学院教授姜宝玉近日来稿,对舒文做了回应。
《知识分子》坚持理性,保持公平,鼓励理性的学术争鸣,也相信真理越辩越明。争鸣来稿请寄:
撰文 | 姜宝玉
《知识分子》于7月25日发表了《争鸣|舒德干:被热炒的云南虫,究竟是不是脊椎动物?》一文。文中,西北大学舒德干院士对我们2022年7月8日发表于Science的论文[1](以下简称 “论文”)进行了评述(以下简称 “评述”)。现在,由我代表研究团队对 “评述” 中的要点做简单回应。
首先,感谢 “评述” 对 “论文” 表达了肯定和鼓励。“评述” 中指出,“文章面世后,被国内各大媒体炒得沸沸扬扬,给学界和公众造成了明显的误导”。一些媒体转载我们官网新闻,一些媒体转载境外的新闻或Science同期发表的评述文章,甚至包括一些采访过我们的新闻中,可能使用了一些不够严谨的表达方式,对此我们表达歉意。同时,“评述” 也从论文 “微观结构的多解性” “论证的逻辑性” 和 “证据的科学性” 三方面对论文提出了质疑。由于 “评述” 中没有对 “微观结构的多解性” 展开讨论,我这里仅就后两方面的质疑做些说明,供舒院士和广大读者讨论。
一些基本概念
由于 “论文” 的核心内容之一是讨论云南虫在生命树上的系统发生位置,在说明之前,我先简单介绍生物系统发生关系(生命树)中涉及的一些基本概念,便于大家理解。
系统发生框架反映了生物类群之间的亲缘关系和生物演化的过程,是现代演化生物学普遍采用的自然分类体系 [2]。在对重要生物类群起源和早期演化的研究中,一个重要难题是推测现生物种的最后共同祖先(Last Common Ancestor,LCA或Most Recent Common Ancestor,MRCA)具有哪些性状特征。为了方便讨论生物类群起源和早期演化,演化生物学家提出了冠群、干群和总群等概念 [3,4]。
冠群(crown group)指某一生物类群所有现生物种的最后共同祖先和该祖先产生的所有后代,包括所有现存的和已灭绝的后代(图1)。某一冠群和与它演化关系最近的冠群也存在一个最后共同祖先,而由这一祖先分异出的两个分支则被称为这两个冠群分别对应的总群(total group)。总群中除去冠群物种之后,早于冠群分异的、已灭绝的物种,就是相应冠群对应的干群(stem group)。大家在一些生物演化科普中看到某某类群的祖先类群通常指某一冠群的干群。
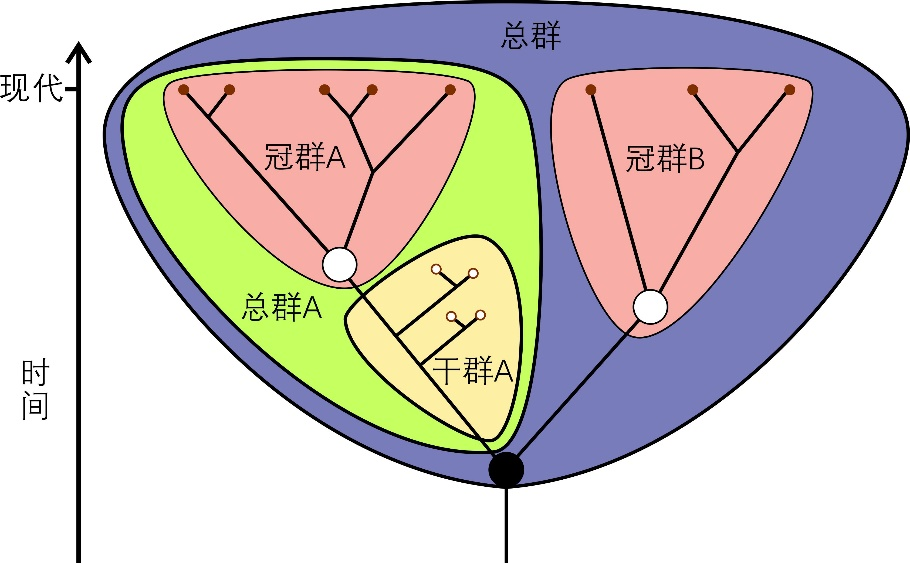 图1 冠群、干群和总群的示意图。图中展示A和B两个冠群、冠群A对应的干群和总群、以及A和B两个冠群构成的总群。红点表示现生类群,小白点表示化石类群,大白点表示相应冠群的最后共同祖先,大黑点表示两个冠群的最后共同祖先 | 修改自维基百科用户Mattbierner和Peter coxhead()(CC BY-SA 4.0)。
图1 冠群、干群和总群的示意图。图中展示A和B两个冠群、冠群A对应的干群和总群、以及A和B两个冠群构成的总群。红点表示现生类群,小白点表示化石类群,大白点表示相应冠群的最后共同祖先,大黑点表示两个冠群的最后共同祖先 | 修改自维基百科用户Mattbierner和Peter coxhead()(CC BY-SA 4.0)。
论证的科学逻辑
“评述” 依据 “任何较高等的类群起源,都应该是由一系列较低等类群,也就是它们的祖先类群,是经历了连续的基因创新,以及由基因创新引发的相关器官构造创新,才一步一步进化来的” 这一生物进化基本逻辑,指出 “绝不能因为某些低等类群,为后代的高等类群创造了某些基因和基础器官,就得出结论说 “前者就是后者”,或者说 “低等动物就是高等动物”。
为了说明这种逻辑关系,“评述” 中列举了三个例子。第一个例子认为两栖类的一支演化出爬行动物,而爬行动物的一支演化出鸟类。第二个例子提出 “3000万年至5000万年以前,是由某一类非常原始的小猴子” 演化出古猿,而古猿演化出人类。第三个例子列举了半索动物演化出脊索动物,脊索动物演化出脊椎动物。“评述” 中描述的这种简单化的演化关系是不严谨的,不符合系统发生分析反映出的系统发生关系。以与“论文”相关的半索动物为例,半索动物在后口动物系统树中早已偏离了向脊椎动物冠群演化的支系(图2)。也就是说,半索动物无法演化出脊索动物和脊椎动物,脊索动物是由脊索动物和半索动物的最后共同祖先演化而来。与此类似,两栖类早已偏离向羊膜动物冠群演化的路径,无法演化出爬行动物和鸟类。同时,生物的演化也不存在从低级到高级这样的演化顺序。
在这三个例子中,“评述” 认为不能将两栖类称为鸟类,不能将猴子称为人类,也不能将半索动物称为脊椎动物。“评述” 将上述三个例子列举的逻辑关系与 “论文” 联系起来,是因为 “评述” 认为,“云南虫及其同类进化到脊椎动物的过程是:先由低等的 ‘无脊索动物’,如云南虫,半索动物门,古虫动物门等门类中的某一支,首先进化成具有脊索的 ‘低等脊索动物’(包括头索动物,尾索动物)。再继续进化,便创造出头脑,创造出脊椎,最终成为脊椎动物。这个基本演进路径科学家搞得相当清楚了。” 由于这里没有列参考文献,不清楚这里认为这种基本演进路径搞得相当清楚的科学家是指哪些学者。关于古虫动物(vetulicolians)和云南虫(yunnanozoans)与现生半索动物、脊索动物和脊椎动物之间的系统发生关系,在绝大多数最新的、有关脊椎动物起源的文献中,都被认为有争议的 [5–7],这一点在 “论文” 的引言部分已有说明:云南虫在不同研究中被置于脊椎动物干群 [8,9]、头索动物 [10]、半索动物 [11]、后口动物干群 [12]、甚至原始的两侧对称动物 [13]。
生物演化涉及众多类群和性状的复杂过程,无法简单地用从低级到高级的“进化”来描述。系统发生分析就是综合不同生物类群的众多性状特征数据,采用适合的软件和算法,反演重建生物演化的过程。“论文” 的系统发生分析采用了舒院士等2017年发表的两篇论文[14,15]中的相关性状数据和有关分析方法,并在此基础上充分考虑了当前研究中化石解剖学构造解释上的不确定性和争议,采取了保守的性状编码方式(见 “论文” 发表的附件表格),利用当前研究中常用的以概率模型为基础的贝叶斯推断法,得出了云南虫最可能位于图2所示的演化位置。
当然,如果对解剖学性状采用不同观点的解释和数据编码,或者采用不同的系统发生分析方法和模型 [16,17],可能会得出与 “论文” 结果有差异的系统发生关系,这是比较和论证不同演化假设中常见的现象。
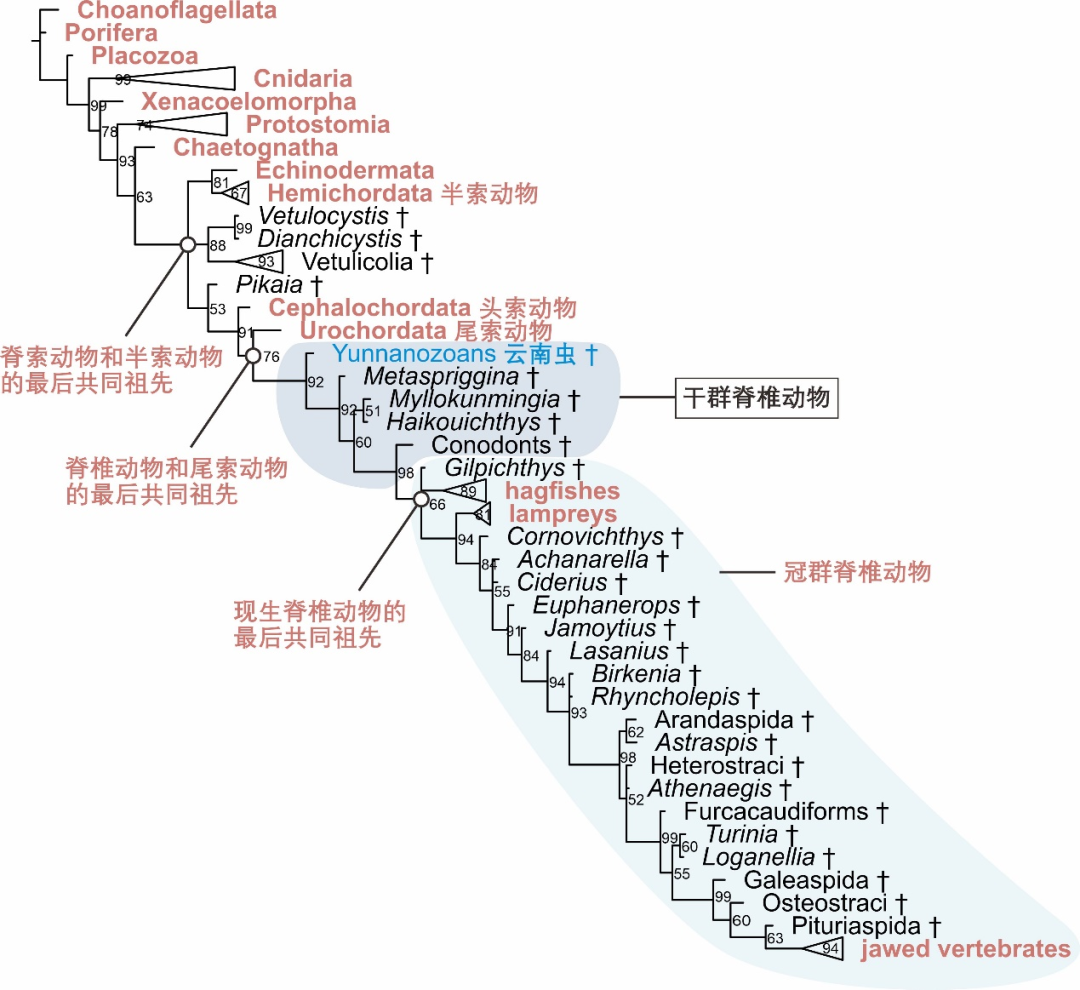 图2 “论文” 中得到的系统发生树。现生类群显示为红色,灭绝类群用剑标(†)表示,部分类群合并表示。节点旁的数字表示后验概率(百分比表示)。
图2 “论文” 中得到的系统发生树。现生类群显示为红色,灭绝类群用剑标(†)表示,部分类群合并表示。节点旁的数字表示后验概率(百分比表示)。
脊索动物包括头索动物、尾索动物和脊椎动物。分子系统发生研究表明,脊椎动物和尾索动物之间的关系最近,而头索动物属于脊索动物中最早分异出来的一支 [18]。将前面提到的冠群、干群的概念应用到脊椎动物起源的问题中,可以看出脊椎动物的冠群包括现生的圆口纲和有颌类。而脊椎动物的干群,则包括在脊椎动物总群支系上、位于脊椎动物和尾索动物最后共同祖先和冠群脊椎动物之间的所有已绝灭类群(图2)。“论文” 通过系统发生分析揭示,云南虫类的演化位置处于脊椎动物的干群之中,并且是目前已知分异最早的脊椎动物干群支系(图2)。“论文” 从未将半索动物、头索动物或尾索动物称为脊椎动物。
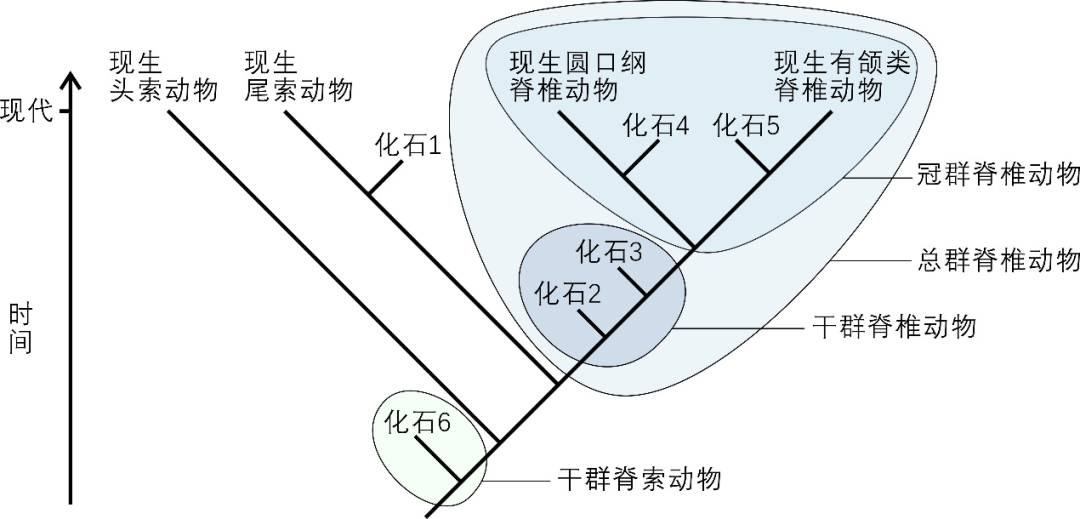 图3 脊索动物系统发生树示意图 | 根据文献[4]绘制
图3 脊索动物系统发生树示意图 | 根据文献[4]绘制
证据的科学性
“评述” 认为,“云南虫除了具有鳃裂外,不具备其余关键的五个创新特征,即没有脊索,没有肌节,没有肛后尾,没有脊椎骨,也没有头脑眼。所以,云南虫与脊椎动物毫无关系。”
首先,许多重要生物类群的起源与演化研究表明,冠群拥有的一系列性状特征往往是在该类群起源和早期演化中逐步获得的 [19]。某一类群的干群物种,往往只具有其冠群的少数性状特征,代表了演化过程中的过渡类型。云南虫不具有冠群脊椎动物的一些性状特征,也无法否定云南虫属于干群脊椎动物。
其次,化石曾经是活着的生物。生物从死亡、腐烂到被掩埋,最后变成化石,会经历漫长的地质时间和复杂的生物、化学和物理变化 [20]。在这个过程中,很多生物特征会消失,或者留下的证据没有被观察到,所以化石保存的特征远少于现生动物。因此,化石中缺失的特征是无法确定曾经是否存在的,尤其是软组织特征 [5]。云南虫化石也存在类似的情况。云南虫化石的许多宏观结构,不同研究团队有不同的解释。例如:
1 脊索。脊索动物的脊索是由含有胶原蛋白的外鞘和内部的细胞组成的 [21]。虽然不容易腐烂 [6],但是可能因为不容易碳化,脊索在化石中并不常见 [20]。化石圆口纲脊椎动物希罗卡似盲鳗(Myxinikela siroka)[22,23]、蒙大拿哈迪斯蒂鳗(Hardistiella Montanensis)[24]、詹格尔双鳗(Pipiscius zangerli)[25,26]、甚至许多耳材村海口鱼(Haikouichthys ercaicunensis)标本 [27,28] 都没有观察到脊索。不能因为没有观察到脊索就否认这些化石是脊索动物。前人也提出了云南虫脊索的解释 [8–10, 29, 30],虽然存在争议,但是还不能简单地定论云南虫没有脊索。
2 肌节。肌节是分段的躯干肌肉,并不是所有脊索动物都有的特征。头索动物和脊椎动物拥有形态不同的肌节,而尾索动物没有肌节 [31]。所以,不能根据没有肌节来断定云南虫不是脊索动物。云南虫背部的分节被前人解释为肌节,也发现有肌肉纤维的构造 [8–10, 29, 30]。尽管存在争议,但是不能轻易否认已有的肌节证据。即使将来新的证据证明背部分节是表皮结构,也不能排除云南虫在表皮之下肌节曾经存在的可能性。
3 肛后尾。云南虫的躯干后面存在明显的突出物 [8,9,32]。该结构被前人解释为肛后尾 [8,9],仅有少数学者对该解释提出了质疑 [33]。
4 脊椎。脊椎是附着在脊索上分节的骨骼或者软骨。所有的圆口纲脊椎动物中,只有现生七鳃鳗、现生的黏盲鳗属(Eptatretus)的尾部 [34]和有争议的化石圆口纲寻常塔利怪鳗(Tullimonstrum gregarium)[35] 有脊椎,现生的盲鳗属(Myxine)[36] 和其他所有圆口纲化石都没有发现脊椎。不能因为这些脊椎动物没有脊椎就说它们不属于脊椎动物。
5 头脑眼。关于头,根据拉马克(Lamarck, 1801)[37]的定义,脊椎动物同义词是有头类(Craniota Haeckel, 1866或Craniata Lankester, 1877)[38, 39],意味着它们都有骨质或者软骨的头颅。头颅包括包围大脑的脑颅和包围咽腔的咽颅。无脊椎动物中的头索动物和半索动物也有支撑咽腔的鳃部结构,但都不是由软骨组成的。“论文” 提供了云南虫具有咽部软骨的证据,说明云南虫具有了由软骨支撑的咽腔——原始咽颅。根据传统上脊椎动物的定义,云南虫已经具有了关键的脊椎动物特征。
大脑主要由柔软的神经组织组成,同时也是腐烂最快的器官之一 [6],大多数脊椎动物化石都没有保存大脑。关于眼睛,脊索动物有很多种眼睛,头索动物和尾索动物身体前端都具有微小的感光器官,大部分脊椎动物则具有相机型眼 [40]。但是,很多脊椎动物也不具有明显的眼睛。比如最早分化出来的现生脊椎动物盲鳗,它们的眼睛没有晶状体和黑色素,完全被皮肤覆盖 [41]。化石长吻特提斯盲鳗(Tethymyxine tapirostrum)也没有观察到眼睛 [42]。事实上,前人曾经报道过云南虫标本上具有眼睛构造 [8,9,30],只是保存眼睛的标本很少,才存在争议。如果云南虫的眼睛或者感光器官像盲鳗或者头索动物那样不明显,很难在化石中保存或找到眼睛的痕迹。
此外,“评述” 后记中提到,“新文章将云南虫归入脊椎动物的主要微观构造证据是,它与后者具有相似的 ‘细胞软骨’”,“该性状具有多解性和不确定性,很可能广泛出现于众多无脊椎动物类群”。“论文” 并没有否认无脊椎动物也有软骨,文中也举出了头索动物口须软骨的例子 [1]。“论文” 提供的主要微观证据不是云南虫具有细胞软骨,而是云南虫具有了脊椎动物特有的特征——鳃弓软骨,这也是 “论文” 的核心证据。
科学研究需要不断探索
我非常感谢舒院士亲自对 “论文” 中和媒体宣传中存在的问题提出批评,也尝试对舒院士提出的一些质疑表达了不同观点。我身边几代令人尊敬的科学家一直用身体力行的方式教育我,要严谨地对待科学问题,大胆假设,小心求证,我谨记于心。科学研究需要不断探索,作为一支相对年轻的科研团队,我们尝试采用多学科交叉的方法,为解决长期以来存在的争议问题,提供一些形态学和超微结构方面的证据。在这一过程中,我们肯定存在这样或者那样的不足。
“论文” 的结论仅代表我们的观点,一定有很多学者持有不同观点。希望 “论文” 能起到抛砖引玉的效果,吸引同行们在学术领域发表各自的观点。这样未来会有更多的同行关注这一充满魅力的领域,一定会发现更多的新证据。新证据也许证明我们的结论是不准确的,但我们还是希望,我们发现的这些证据是有价值的。最后,也感谢《知识分子》编辑部能给我们这样一个机会,向舒院士和广大读者表达不同的学术观点。
参考文献:
1. Q. Y. Tian, F. C. Zhao, H. Zeng, M. Y. Zhu, B. Y. Jiang, Ultrastructure reveals ancestral vertebrate pharyngeal skeleton in yunnanozoans. Science. 377, 218–222 (2022). E. O. Wiley, B. S. Lieberman, Phylogenetics: Theory and Practice of Phylogenetic Systematics, Second Edition (John Wiley & Sons, Inc., Hoboken, NJ, USA, 2011). G. E. Budd, S. Jensen, A critical reappraisal of the fossil record of the bilaterian phyla. Biol. Rev. 75, 253–295 (2000). R. P. S. Jefferies, “The origin of chordates-a methodological essay” in The Origin of Major Invertebrate Groups, M. , Ed. (Academic Press, London, 1979), pp. 443–477. P. C. J. Donoghue, M. A. Purnell, Distinguishing heat from light in debate over controversial fossils. BioEssays. 31, 178–189 (2009). R. S. Sansom, S. E. Gabbott, M. A. Purnell, Non-random decay of chordate characters causes bias in fossil interpretation. Nature. 463, 797–800 (2010). P. Janvier, Facts and fancies about early fossil chordates and vertebrates. Nature. 520, 483–489 (2015). J. Y. Chen, D. Y. Huang, C. W. Li, An early Cambrian craniate-like chordate. Nature. 402, 518–522 (1999). J. Mallatt, J. Y. Chen, Fossil sister group of craniates: predicted and found. J. Morphol. 258, 1–31 (2003). J. Y. Chen, J. Dzik, G. D. Edgecombe, L. Ramsköld, G. Q. Zhou, A possible Early Cambrian chordate. Nature. 377, 720–722 (1995). D. G. Shu, X. L. Zhang, L. Chen, Reinterpretation of Yunnanozoon as the earliest known hemichordate. Nature. 380, 428–430 (1996). D. G. Shu, S. Conway Morris, Z. F. Zhang, J. N. Liu, J. Han, L. Chen, X. L. Zhang, K. Yasui, Y. Li, A new species of yunnanozoan with implications for deuterostome evolution. Science. 299, 1380–1384 (2003). R. A. Dewel, Colonial origin for Eumetazoa: major morphological transitions and the origin of bilaterian complexity. J. Morphol. 243, 35–74 (2000). (SICI)1097-4687(200001)243:1%3C35::AID-JMOR3%;2-%2314. Q. Ou, J. Han, Z. F. Zhang, D. G. Shu, G. Sun, G. Mayer, Three Cambrian fossils assembled into an extinct body plan of cnidarian affinity. Proc. Natl. Acad. Sci. U.S.A. 114, 8835–8840 (2017). J. Han, S. Conway Morris, Q. Ou, D. G. Shu, H. Huang, Meiofaunal deuterostomes from the basal Cambrian of Shaanxi (China). Nature. 542, 228–231 (2017). M. N. Puttick, J. E. O’Reilly, D. E. Pisani, P. C. J. Donoghue, Probabilistic methods outperform parsimony in the phylogenetic analysis of data simulated without a probabilistic model. Palaeontology. 62, 1–17 (2019). P. A. Goloboff, A. Torres, J. S. Arias, Weighted parsimony outperforms other methods of phylogenetic inference under models appropriate for morphology. Cladistics. 34, 407–437 (2018). F. Delsuc, H. Brinkmann, D. Chourrout, H. Philippe, Tunicates and not cephalochordates are the closest living relatives of vertebrates. Nature. 439, 965–968 (2006). D. H. Erwin, Novelty and innovation in the history of life. Curr. Biol. 25, R930–R940 (2015). L. A. Parry, F. Smithwick, K. K. Nordén, E. T. Saitta, J. Lozano-Fernandez, A. R. Tanner, J. B. Caron, G. D. Edgecombe, D. E. G. G. Briggs, J. Vinther, Soft-bodied fossils are not simply rotten carcasses - toward a holistic understanding of exceptional fossil preservation. BioEssays. 40, 1700167 (2017). G. Annona, N. D. Holland, S. D’Aniello, Evolution of the notochord. EvoDevo. 6, 1–13 (2015). S. E. Gabbott, P. C. J. Donoghue, R. S. Sansom, J. Vinther, A. Dolocan, M. A. Purnell, Pigmented anatomy in Carboniferous cyclostomes and the evolution of the vertebrate eye. Proc. R. Soc. B Biol. Sci. 283, 20161151 (2016). T. Miyashita, A Paleozoic stem hagfish Myxinikela siroka — revised anatomy and implications for evolution of the living jawless vertebrate lineages. Can. J. Zool. 98, 850–865 (2020). P. Janvier, R. Lund, Hardistiella Montanensis n. gen. et sp. (Petromyzontida) from the Lower Carboniferous of Montana, with remarks on the affinities of the lampreys. J. Vertebr. Paleontol. 2, 407–413 (1983). D. Bardack, E. S. Richardson, New agnathous fishes from the Pennsylvanian of Illinois. Fieldiana Geol. 33, 489–510 (1977). T. Miyashita, R. W. Gess, K. Tietjen, M. I. Coates, Non-ammocoete larvae of Palaeozoic stem lampreys. Nature. 591, 408–412 (2021). D. G. Shu, H. L. Luo, S. Conway Morris, X. L. Zhang, S. X. Hu, L. Chen, J. Han, M. Zhu, Y. Li, L. Z. Chen, Lower Cambrian vertebrates from south China. Nature. 402, 42–46 (1999). X. G. Zhang, X. G. Hou, Evidence for a single median fin-fold and tail in the Lower Cambrian vertebrate, Haikouichthys ercaicunensis. J. Evol. Biol. 17, 1162–1166 (2004). J. Dzik, Yunnanozoon and the ancestry of chordates. Acta Palaeontol. Pol. 40, 341–360 (1995). J. Y. Chen, “The origins and key innovations of vertebrates and arthropods” in Earth and Life (Springer Netherlands, Dordrecht, 2012), pp. 239–379. T. Onai, The evolutionary origin of chordate segmentation: revisiting the enterocoel theory. Theory Biosci. 137, 1–16 (2018). P. Y. Cong, X. G. Hou, R. J. Aldridge, M. A. Purnell, Y. Z. Li, New data on the palaeobiology of the enigmatic yunnanozoans from the Chengjiang Biota, Lower Cambrian, China. Palaeontology. 58, 45–70 (2015). D. G. Shu, S. Conway Morris, Response to comment on “A new species of yunnanozoan with implications for deuterostome evolution.” Science. 300, 1372–1372 (2003). K. G. Ota, S. Fujimoto, Y. Oisi, S. Kuratani, Identification of vertebra-like elements and their possible differentiation from sclerotomes in the hagfish. Nat. Commun. 2, 373–376 (2011). V. E. McCoy, E. E. Saupe, J. C. Lamsdell, L. G. Tarhan, S. McMahon, S. Lidgard, P. Mayer, C. D. Whalen, C. Soriano, L. Finney, S. Vogt, E. G. Clark, R. P. Anderson, H. Petermann, E. R. Locatelli, D. E. G. Briggs, The ‘Tully monster’ is a vertebrate. Nature. 532, 496–499 (2016). K. G. Ota, Y. Oisi, S. Fujimoto, S. Kuratani, The origin of developmental mechanisms underlying vertebral elements: implications from hagfish evo-devo. Zoology. 117, 77–80 (2014). J.-B. de M. de Lamarck, Système des animaux sans vertèbres ou tableau général des classes, des ordres et des genres de ces animaux (L’auteur, 1801). E. Haeckel, Generelle Morphologie der Organismen (1866). E. R. Lankester, Memoirs: notes on the embryology and classification of the animal kingdom: comprising a revision of speculations relative to the origin and significance of the germ-layers. J. Cell Sci. s2-17, 399–454 (1877). S. N. Bradshaw, W. T. Allison, Hagfish to illuminate the developmental and evolutionary origins of the vertebrate retina. Front. Cell Dev. Biol. 10, 1–20 (2022). E. M. Dong, W. T. Allison, Vertebrate features revealed in the rudimentary eye of the Pacific hagfish (Eptatretus stoutii). Proc. R. Soc. B Biol. Sci. 288, 1–21 (2021). T. Miyashita, M. I. Coates, R. Farrar, P. Larson, P. L. Manning, R. A. Wogelius, N. P. Edwards, J. Anné, U. Bergmann, A. R. Palmer, P. J. Currie, Hagfish from the Cretaceous Tethys Sea and a reconciliation of the morphological–molecular conflict in early vertebrate phylogeny. Proc. Natl. Acad. Sci. 116, 2146–2151 (2019).
0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 