阅读:0
听报道

导语:
在10月28日-29日举行的2017未来科学大奖颁奖典礼暨未来研讨会活动,一场主题为“生物医学 绝症不绝?”的分论坛吸引了两位全球顶尖华人科学家王晓东和谢晓亮做主旨演讲。他们演讲的主题分别关于生和死。以下为二人的演讲全文。
王晓东:我有信心,大多数绝症会绝迹

● ● ●
今天跟大家一起回答这样一个题目——绝症不绝,对于这个题目,我有两个感受。第一,绝症听起来是挺让人担心的一件事;其次,绝症又不(会灭)绝,这让我们更加失望。我们希望什么?不光是绝症灭绝,而且最好绝症会消失。
我们之所以面临着各种各样的绝症,在我看来,有四个非常重要的原因。当然,这里我只讲影响很多人的具有普遍性的疾病。
首先,世界上有“聪明的病毒”。为什么说它聪明?病毒是一种非常微小的微生物,用电子显微镜放大几万倍才能看到,它跟我们的身体共进化多年。它非常聪明,生活目的是侵染我们,会给我们造成不适和疾病。在过去很长一段时间,有些病毒感染是一种绝症。即使现在,还有一种病毒,影响了我们很多很多人,后面我也会提到。
其次是“善变的癌症”。为什么说癌症“善变”?癌症的发生是我们身体内部的细胞发生了变化。癌症的诱因多种多样,包括各种环境与基因因素,甚至可能是在“躺着中枪”的情况下发生了基因方面的突变,结果使我们自己的细胞“叛变”开始攻击我们身体正常的细胞。在过去的很多年里,癌症是一种绝症。经过多年的科学研究,人类在预防、治疗癌症方面有了很大的进步。或许未来有一天,我们也可以预防和治愈癌症。那么人类的寿命就可以再次提高到一个新的台阶。
第三种绝症是损伤的神经。随着岁月的流逝,我们很多的神经细胞最后都会受到损伤。因为多数神经细胞不可再生和补充,神经细胞的损伤就会造成功能性的丧失。为什么它们会有损伤?为什么我们的神经细胞会离我们而去?现在仍是未解之谜。但我仍有信心,在我们的有生之年,可以对神经退行性的病变进行预防,甚至找到治疗的办法。
即使把这些眼前的疾病都治好了,人类的平均寿命提高到两百年,我想还会有新的问题出现,这是人类作为一个活的有机体所必须面临的新问题。从这一点来讲,我们研究生物医学的人可能永远不会失业,我们永远在路上。所以,如果台下的小朋友将来要选择职业的话,欢迎参加生物医学研究的科学队伍。
聪明的病毒:从艾滋病到乙肝
说起病毒,在并不遥远的过去,艾滋病是一种令人“谈艾色变”的绝症。在上世纪80年代中期,也是我去美国留学的时候,艾滋病才刚刚开始,起初并不知道是什么引起的。一旦得了艾滋病就是绝症,很多人因此离世。
这令我想起一件现在回想起来都非常让人不舒服的事。在上世纪90年代,我们从海外回国探亲的人,入关回国时每个人都要抽一管血,交钱自费检查艾滋病。外国人免查。所以中国后来艾滋病的传染,一点不是我们这些留学生带回来的。
现在艾滋病对人类来讲已经谈不上是绝症了。科学的发展揭示了引起艾滋病的是HIV病毒。我们也知道了它如何侵染我们的细胞,如何在细胞里面复制,最后又如何组装成新的病毒感染新的细胞。现在,我们对它的“生活史”已经了如指掌。也正因为我们了解了它,就可以针对它如何侵染细胞,如何在细胞里的基因组里整合,如何复制组装成新病毒,开发出针对各个步骤的药物。
不仅如此,这样的药物经过一代代改进,正变得越来越好。现在得艾滋病、感染HIV病毒,已经不是一个绝症。虽然还不能根治,但可以无症状多年生存。正是因为有生物医学的基础研究、应用研究,再到药物开发以及最后的临床应用,现在艾滋病已经是完全可以控制的一种疾病,不再是一个绝症。我们的华裔医学家何大一教授发明了鸡尾酒疗法,把几种针对HIV复制各个步骤的药放在一起进行治疗,为艾滋病的治疗做出了重大贡献。
另外一种我们国人深受其害的病毒是造成乙型肝炎的乙肝病毒。它是一个小病毒,但却引发了非常大的问题。为什么说是一个小病毒?相对于造成艾滋病的HIV病毒来讲,乙肝病毒的基因组非常小,病毒基因组只编码一个酶,而不像HIV病毒基因组编码了好几个酶,所以我们能对HIV病毒“多管齐下”。但乙肝病毒仅编码了一个酶,且我们对它在细胞内怎样感染和复制都所知甚少。因此,我们对乙肝病毒的治疗方法并不多。
目前,全球共有两亿四千万人感染了乙肝病毒,在中国,最近的数字显示约有八千万人被感染。相较于全球三千五百万艾滋感染者,乙肝病毒感染者的数目要大得多。而且,全球每年约有一百万人会死于跟乙肝病毒感染有关的疾病,这相当于每年爆发一场大型战争。
此外,全球感染乙肝病毒的地区大都集中在不发达地区,欧美感染的很少。感染人数最多的是什么地方呢?中国和“一带一路”地区。所以,针对乙肝病毒的研究在欧美并不是一个热点,也不是一个重点,不像HIV病毒。那么,我们中国人对乙肝的病毒研究,就愈发紧迫和重要。
最近,我们北京生命科学研究所李文辉老师在乙肝病毒领域做出了重大发现,他们发现在肝脏内有一个负责胆酸进行肝肠循环的受体,同时也是乙肝病毒进入肝脏细胞的受体。什么是肝肠循环?我们吃了油腻的食物后,肝脏会分泌胆酸,用来溶解和帮助消化这些油腻的食物。这些胆酸到肠道以后并不是都排出去了,多数是通过肝肠循环被肝细胞重新吸收了。
那么,胆酸如何回到肝脏细胞呢?需要通过一个叫做钠离子牛磺胆酸的转运受体。李老师的研究组发现这个受体其实就是乙肝病毒进入肝细胞的一个途径。有了这样的一个受体,我们对乙肝研究的途径就打开了。因为以前很少,或者是说没有途径。为什么?一个原因是乙肝病毒很小,基因组也很小,它只有一个逆转录酶;另一个问题是乙肝病毒并不感染常用的试验动物,除了感染人、大猩猩、黑猩猩以外,连猴子都不感染。人、大猩猩、黑猩猩都不是我们常用的实验动物。
不仅如此,我们很难在体外建立稳定的感染。发现了受体就可以建立这样的一个能被感染的细胞系,在体外可以连续培养的癌细胞株上完全实现重复乙型肝炎病毒的生活史,进而可以更深入地在分子水平上了解它们如何入侵细胞、在细胞里面如何被复制,从而在这个基础上开发药物。
知道了受体还针对了乙肝病毒做人类遗传学的研究。为什么?在这里我也要给大家戳穿一个谜:在很长一段时间里,人们总有一个疑问,为什么中国人容易得乙肝?是不是中国人基因组的问题导致容易得乙肝?综合研究发现其实并不是基因组的问题。但是我们通过遗传学的研究发现了一个基因的多态性,有这个多态性的人是不感染乙肝的,中国人在基因水平不比别的人种更容易感染乙肝,而且我们有一部分中国人抗乙肝感染。那么我们中国乙肝大国之名更可能是生活习惯所赐。
有了这样的手段,中国现在对乙肝病毒这样的一个世界难题,在研究和药物开发上就有了在我看来世界领先的地位。其实,在上世纪80年代末、90年代初乙肝病毒的蔓延情况,比现在要厉害很多。为什么?因为当时没有乙肝疫苗。现在多数情况下,尤其是小朋友们感染乙肝的已经非常非常少了。正是因为科学家开发出了预防乙肝的疫苗,而且我们大家都能接种到乙肝疫苗。新的感染就相对少多了。
但是乙肝的问题在于世界上有两亿多人,中国有八千多万人已经感染。其中多数是慢性的感染,并不是新的感染。而已有的感染病毒没有办法被清除。随着时间的推移,很多感染乙肝的人会肝硬化,最后会变成肝癌。下一步,虽然我们将来能够把病毒引起的乙肝彻底根治,癌症的问题又出现了,那又是一个绝症。
善变的癌症
我们对癌症的研究、治疗和预防怎么走?最有效的仍是疫苗。乙肝疫苗大大减低了感染率,尤其是对年轻的人群,会减低他们未来的肝癌发病率。最近的HPV疫苗也能够大大降低HPV的感染以及宫颈癌的发病率。
如果得了癌症怎么办?如果在早期发现,用手术切除。转移了怎么办?我们现在有放化疗。化疗就是用对细胞有毒的药物去把癌细胞给毒死。当然,化疗的问题是特异性不强,在毒死癌细胞的同时,很多正常的细胞有时候也会被毒死,而且会产生抗药性。而放疗是用高能射线去杀死癌细胞,但是如果癌细胞转移到很多细小的地方不能定位,就很难完全用放疗治疗。
最近也有所谓的靶向治疗。之所以有癌细胞是因为有基因的突变,那么,如果说我们能够找到造成癌细胞基因突变的基因,针对这样的基因设计一个药物,把癌细胞依赖生存的突变基因产物抑制住,癌细胞就会被杀死或诱导分化成正常细胞,“改邪归正”。这就是靶向治疗。靶向治疗的问题是初期可能有效,但后来没有被完全杀死的癌细胞又发生了变化,癌细胞会变得抗药,肿瘤就会长回来。
最近一个激动人心的、有效的新治疗方法是肿瘤免疫治疗。肿瘤免疫治疗的基础是什么呢?就是动员我们身体里的免疫系统去杀癌细胞。我们的免疫系统其实就是我们身体里面的“解放军和武警”,他们是用来对抗外来的侵染和我们“内部叛变”的。对叛变的癌症来讲,我们的免疫系统是可以对其进行剿灭的。
肿瘤免疫治疗其实和抗病毒的思路很像。首先癌细胞要被免疫系统认出来是癌细胞。癌细胞基因的突变会产生新的蛋白,新的蛋白一产生,我们的免疫系统就知道这个“人”不是“我们的人”,前方负责“杀敌”的免疫T细胞可以跟癌细胞接触,然后把癌细胞杀死。
除了管杀伤的T细胞,人体的免疫系统还有一个庞大的后援部队,比如说我们有“侦察兵”,能够侦查癌细胞在哪。有战争动员机制,一旦发现病变,我们的前方战士就会从少数变得很多,另外免疫系统还可以把他们送到判断有病变的地方。所以,癌症免疫治疗不光为我们提供了一种新的治疗方法,也给我们提供了新的策略来对付癌症。
虽然现在可能还是一个公众“谈癌色变”的时代。但是,我很有信心,如果现在癌症还能称得上是绝症的话,它肯定会很快被我们“灭绝”掉。
如果癌症治好了,各种感染也治好了,我们都活得很长,但是,随着年龄的不断增长,会伴有一个最大的危险:就是我们的神经会莫名其妙死掉,进而引发像阿尔兹海默症这样的疾病,这些疾病不光对病人本身造成很大的痛苦,病人的家庭和社会也都会有很大的负担。
损伤的神经
以另一种我们称为渐冻症的疾病为例,控制我们肌肉运动的神经元逐渐消失了,最著名的渐冻症病人是霍金,运动神经元的消失使得他不能动了,但是思维仍很清晰,这跟阿尔兹海默症不一样,后者是思维的退化。渐冻症思维很清晰,像霍金,还能思考黑洞是怎么回事。霍金现在几乎所有的肌肉都不能动了,仅能控制眼皮,所以眼皮的神经元是最后消失的。

另外,我们中国人最大的神经杀手是中风,中风也会杀死神经元。那么,怎么样治疗?虽然现在治疗退行性疾病的手段还非常少,目前的药物和物理治疗主要是弥补损失掉的神经元功能。但根本的治疗方式还是切断神经元死亡的诱因。如果我们能够找到这个诱因,就可以延缓神经元的死亡。此外,我们还可能用神经干细胞以及神经系统里面的非神经细胞,即所谓的胶质细胞,把它们变成新的神经细胞(神经元)来替代死去的神经元。
我有信心,科学家可以在我们有生之年把大多数这样的问题解决,我们可以有比现在平均水平更久的寿命。当然,到时候可能还会有更多的问题。绝症不绝,一是我们要通过我们的科学研究,让目前的绝症绝迹;另外随着我们寿命越来越长,新的绝症还会出现。未来大奖,面向未来,我们永远在路上。我就分享到这里,谢谢大家!
谢晓亮:避免单基因遗传病,从随机到精准

● ● ●
谈到生命不外乎生和死,晓东讲的“绝症”,好像都跟死有关。我今天要和大家谈谈“生”,也就是“生殖”。
俗话说“龙生九子,九子不同”,这句话的科学根据是什么?遗传学家孟德尔用他著名的“豌豆试验”揭示了遗传法则。可惜直到他去世以后,人们才意识到他的伟大。不久前,我有幸参观了孟德尔曾经工作过的修道院,这是他当年做实验的豌豆地。孟德尔通过这个实验证明每个豌豆都有两个等位基因,分别来自于上一代。
我们现在知道人类也有类似的等位基因。在人体细胞的细胞核里有 46 条染色体,23 条来自于父亲,23条来自于母亲,染色体的主要成分是遗传物质DNA。大家都知道,二十世纪最伟大的生物学发现是沃森和克里克的DNA双螺旋结构。DNA有四种碱基 A、T、C、G, A 与 T 配对,C与 G配对。简单地说碱基ATCG排列的序列决定了遗传信息,也就是基因。人与人相比绝大部份碱基序列都是相同的,只有千分之一的碱基是不同的。除了碱基的差异,还有一个重要的区别是基因拷贝数的差异,细胞中某个基因的拷贝数一般是二,因为一个来自父亲,一个来自母亲,而癌细胞的基因拷贝数经常不是二。这些碱基序列的差别和基因拷贝数的差别,决定了我们各自的不同。
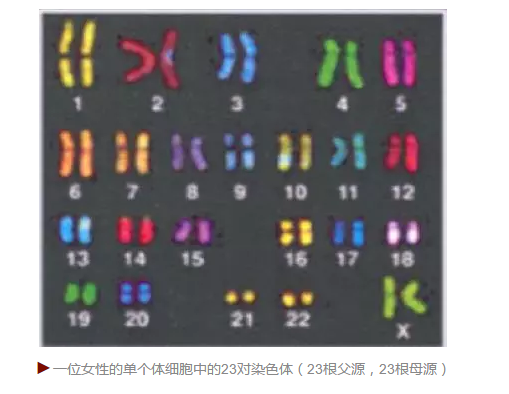
一个细胞的23对染色体共有30亿个碱基对。这23对染色体的序列就是人类基因组。2001年人类基因组计划的完成是人类历史上的一个里程碑。当时测的基因组是几个人的综合,而不是一个人的。尽管如此,人类基因组计划还是提供了非常多的重要信息,比如说科学家以前推测人类大概有十万个基因,实际上测出来是两万个。人类基因组计划当时耗资30亿美金。而十年前发生的DNA测序技术的革命中,新一代测序仪层出不穷,使得测序的价钱迅速下降,比半导体工业的指数衰减还要快。现在要测一个人的基因组,只需要1000美金,一天之内就可以完成。新一代测序仪使得个体化医疗成为可能。
个体化医疗
什么是个体化医疗呢?简单的说就是通过测定个人的基因组来了解病因,提出一个治疗或预防的个体化方案。
个体化医疗最有名的例子是2013年5月13日安吉丽娜朱莉宣布她切除了自己的乳房,因为她携带一种有缺陷的 BRAC1基因,使得她有87%的几率患乳腺癌,50%的几率患卵巢癌。非常凑巧的是,那天我正好在美国NIH开会,讨论如何让携带遗传性疾病的父母避免把致病基因传给下一代,这里不只有技术问题还有伦理问题。当时我的实验室发明了一种新技术,有可能实现这个目标。安吉丽娜朱莉的情况是,即使她携带的BRAC1基因传给下一代,下一代也并不一定得癌,因为癌的发生是遗传和环境因素共同决定的。那伦理问题是为什么父母可以决定一个还没有出生孩子的命运。不管怎样,四年过去了,在美国和中国,有些父母已经这样做了。
而与安吉丽娜朱莉的情况不同的是,目前已知有6000多种的单基因遗传疾病,这些致病基因一旦传给下一代,100%的几率会发病。其中大部分致病基因人们通过测序已经知道了其特有的碱基突变或基因拷贝数变化的位点。不管哪个国家、或哪种宗教,避免这些单基因遗传性疾病在伦理上都是可以接受的。
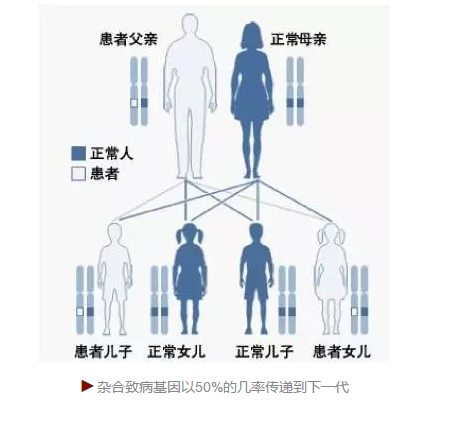
在单基因疾病患者(或携带者)的一个双倍体的体细胞里,一般致病基因来自患者的父方或母方,两个等位基因是杂合的。 如果患者想生小孩,其单倍体的生殖细胞(精子或卵子)会有两种可能性:一个携带,一个不携带那个致病基因基因。因此下一代会有50%的机率携带那个致病基因。这是一个随机事件,这就是命!如果这件事发生在一个豌豆上,或许不重要,但是如果发生在携带致病基因的父母身上,你可以想象他们的精神压力和经济负担。
MALBAC 技术
我们的新技术是什么呢?你给我一个人的单细胞,我就能告诉你它的基因组。为什么要测单个细胞的序列?原因之一是每个单细胞的基因组都不一样,比如说,人类生殖细胞分裂时的随机重组使得每一个生殖细胞都不相同。但以前的技术不够灵敏不够精准,无法使我看到它们的区别。
首先要把单细胞中的微量的DNA 经过单细胞基因组扩增,然后再测序。以前的单细胞基因组扩增利用PCR技术。PCR曾经获得诺贝尔奖,广泛应用于生物和医学领域,它具有单分子的灵敏度,但用于放大整个基因组时,有的基因放大倍数高,有的基因放大倍数低。这种不均匀性是因为PCR是指数放大。
我们的新技术是一种单细胞全基因组扩增技术,称为MALBAC,它不是传统的指数放大,而类似于线性放大。我们只拷贝原始DNA,把放大的产物保护起来,不做拷贝的拷贝。经过五次准线性放大后,再用PCR做指数放大,这就避免了主要由于PCR前几个周期产生的偏差,使全基因组放大更均匀。这个工作是我在哈佛大学的博士后钟铖航与博士生陆思嘉和我共同发明的。陆思嘉博士毕业后毅然回国创业,用MALBAC技术造福于国内百姓。
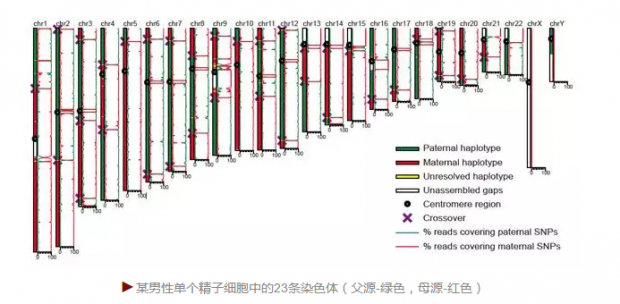
我们当年利用MALBAC技术做的第一件事是测量单个精子细胞的序列,精子细胞是有23条染色体的单倍体。我们直接观察到单个精子细胞在每一条染色体上的crossover。红色的DNA来自于精子供者的母亲,而绿色的DNA来源于供者的父亲。红绿DNA的区别仅是千分之一的碱基的不同。 不同精子细胞的染色体crossover(红绿交接)位点是不一样的,这就是为什么兄弟姐妹基因组都不一样,也就是“龙生九子,九子不同”的原因。
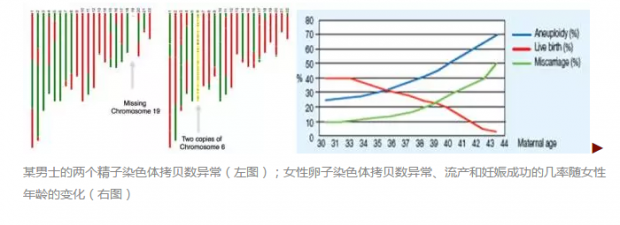
这个实验精子的供者是位华人教授,他的学生比他更好奇他的精子是否正常。从图中看,左边这个精子不正常,缺乏第19号染色体,而右边的精子也不正常,有两根第六号染色体。好在这位教授还算正常,因为每个正常男子都有~5%这样染色体拷贝数异常的精子,原因是精子产生过程中染色体分裂的异常。而这5%的几率是不随男子年龄而变化。与此相反,卵子染色体不正常的几率会随女性年龄的增长而快速增加。无论精子,还是卵子,染色体拷贝数异常都会导致流产、死胎、胎儿畸形及唐氏综合征等遗传疾病。如图中红线所示,随着女性年龄的增长,生殖的成功率急剧下降。随着中国“二胎”政策的开放,很多高龄女性正面临这个问题。
MALBAC 婴儿的诞生
中国第一例“试管婴儿”是北京大学第三医院张丽珠教授1988年完成的。当时她比世界第一例“试管婴儿”晚了10年。我的团队有幸与张教授的接班人乔杰教授、北京大学汤富酬教授合作,将单细胞的测序技术应用于试管婴儿植入前胚胎筛查,以选择正常胚胎植入母体。
这是一颗体外培养的受精卵,有三种方法来鉴别她是否适合植入母体。第一种方法,我们用激光在细胞膜上打一个小洞,毛细管在受精卵外吸出两个极体细胞。这两个极体细胞本来也会被降解,不参与随后的生物过程。我们通过这两个极体的测序而推测受精卵的基因组是否正常,是否可以植入母体。第二种方法是取受精卵滋养层的细胞,是目前临床用得最多的方法。如图所示受精卵会分裂为2个细胞,然后变成4个、16个……在受精后的第五天,等受精卵分裂成二百多个细胞时,从滋养层活检取出几个细胞进行测序,从而推测受精卵的基因组是否正常。去年我们与亿康基因陆思嘉,无锡妇幼保健院蔡立义,南京军区总医院姚兵合作,在PNAS上报道了第三种办法。我们通过检测培养液中的游离的DNA来了解胚胎是否正常。这是因为胚胎在快速的生长过程中,一些胚胎的DNA会进入培养液。我实验室的初步结果表明这个办法不仅无创而且更加精准。
滋养层活检:
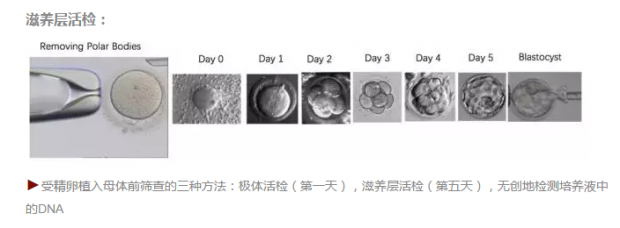
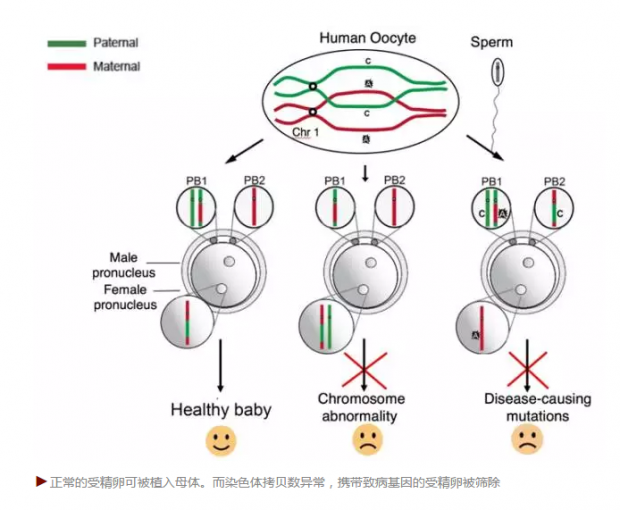
如下图所示,当卵子和精子结合后,左边的图显示的是正常的受精卵,可以植入母体。中间的图显示受精卵染色体拷贝数异常的情况;右边的图显示单基因遗传性疾病的情况——父亲或母亲的某一个致命的点突变传递到受精卵内。这后两种情况受精卵被筛除。与以前的技术不同,MALBAC 可以同时检测到后两种情况。
我们完成的单基因遗传性疾病的第一个病例是男方的遗传性多发性外生性骨疣(HME)。该男士从小由于软骨瘤每两年要做一次手术,只是因为他的EST2基因上存在一个单碱基突变。找到我们之前,他通过全基因组测序,明确知道他携带该致病基因而且来源于父系,有50%的几率传给下一代。虽然他妻子基因组正常,由于年龄较大,染色体拷贝数不正常几率会比较高。
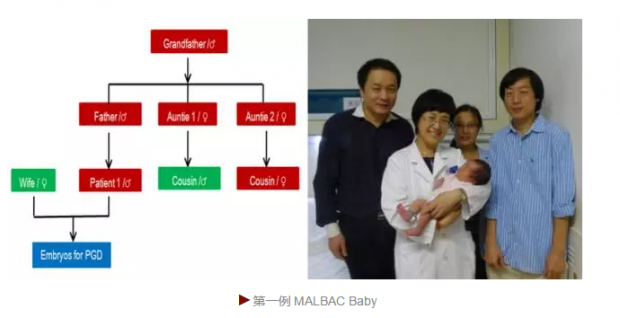
这对夫妻人工授精后的有18个受精卵,八枚染色体异常,七枚携带致病的点突变,而七枚既没有染色体异常,也没有致病的点突变,其中一枚胚胎被选择植入母体。2014年九月十九日,世界上第一例MALBAC Baby诞生了,是个完美的女孩儿。我们去看她的时候,她一声都没有哭,还一直给我笑脸。
这个表格展示的是常见的几种单基因遗传疾病。单基因遗传性疾病不同于安吉丽娜朱莉的BRCA1基因缺陷,单基因疾病一旦传递给下一代,100%的几率会发病。这样的家庭特别需要MALBAC技术。我想强调的是,整个过程我们并没有对生殖细胞进行基因编辑,而是筛选那些没有携带致病基因的胚胎。
迄今为止,在中国超过300多个单基因遗传疾病家庭已受益于MALBAC技术,成功避免了单基因遗传疾病的后代传递。
平衡易位携带者的福音
最后和大家介绍我们最新的工作,国际首例阻止平衡易位的MALBAC Baby,是与郑州大学第一医院孙英蒲团队和亿康基因陆思嘉团队合作完成的,相关文章刚刚在美国PNAS上发表。平衡易位是人类中最多的一类染色体结构畸变,这幅图片显示的是一个男性携带者的DNA,第七号染色体中的一段接到第十五号染色体上,而整个基因组的DNA的拷贝数时没有改变,这就是所谓平衡易位。这个疾病在新生婴儿中的发生率约为0.2%,平衡易位的携带者本身没有特别表象,但想要小孩儿的时候就出现问题了。平衡易位患者的染色体的结构与正常染色体不同,导致精子或者卵子异常,不孕或流产,或有缺陷的新生儿。

该患者与妻子共有7个胚胎,除了第2个胚胎,其余6个胚胎的染色体拷贝数都不正常,不能移植。第二个胚胎染色体拷贝数正常,胚胎有可能完全正常,也有可能是平衡易位,但原来的技术无法区分这两种情况。我们的新技术可以区分,结果是正常,非平衡易位携带者。这是世界上第一例避免平衡易位的 MALBAC Baby,出生前羊水穿刺就已经证明了胎儿正常。迄今为止,已有15名平衡易位携带者在郑州大学第一医院迎来了正常的 MALBAC Baby 诞生。
总结一下, 虽然我们没有利用CRISPR 技术对生殖细胞进行编辑来改变父母或婴儿的基因(伦理上现在不能被接受),我们可以精准地避免了单基因遗传疾病的后代传递。
迄今为止,在中国已有超过300多个单基因遗传疾病家庭已受益于MALBAC技术,成功地阻止了单基因遗传疾病传给婴儿。与此同时,大约三千对夫妇得到了植入前胚胎基因组的精准筛查,有效避免了染色体拷贝数异常,从而提高了妊娠成功率。这对目前享受二胎政策的高龄女性尤其重要。
最后,我建议大家想生小孩儿时要提前做基因检测。很多人觉得自己正常不用做,但是基因表达经常是隐性的。即使夫妻双方的表型都正常,子女也未必能正常。
DNA是以单分子的形式存在于每个细胞中,因此基因组的变化是随机发生的,生命充满了随机性。我们的MALBAC Baby是精准战胜随机的一个生动案例,有什么比一个细胞更精细?比一个碱基更准确?
谢谢大家!

话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。




 京公网安备 11010502034662号
京公网安备 11010502034662号 