阅读:0
听报道
摘要
酵母是一种单细胞真核生物,基于自身诸多优势而成为生物化学、遗传学和细胞生物学的重要研究模型。借助酵母无细胞体系阐明了酶的功能、酶的构成、辅酶特性、tRNA结构和真核转录机制等。酵母作为模式生物在细胞周期、囊泡运输、细胞自噬、端粒保护、蛋白质折叠、未折叠蛋白应答、DNA损伤应答、雷帕霉素靶点和组蛋白调节等重大发现中做出了根本性贡献。许多科学家也因此荣获诺贝尔奖。本文全面介绍酵母在科研中的应用价值。
撰文|郭晓强 黄卫人 (深圳市第二人民医院)
● ● ●
生命科学的研究一方面依赖于科学家高超的逻辑思维、严密的实验设计和熟练的动手操作能力,另一方面还有赖于合适的研究体系和完美的研究对象。生命科学的迅猛发展捧红了大量的模式生物,而酵母(Yeast)是其中最耀眼的明星。科研人员借助酵母的无私奉献洞察诸多生命奥秘,因此,在科学家获得的荣誉中也理应有酵母的一份功劳。
1 概述
酵母是一种单细胞真核生物,大部分采取对等分裂,少数通过出芽形式。 酵母作为模式生物拥有诸多优势: 简单性,比多细胞模式生物简单;复杂性,比细菌又多出细胞核;易观测,单倍体和多倍体共存,突变体表型明显;易操作,可用发酵模式增殖;多样性,同源重组增加基因变异,有利于后续筛选。集众多优点于一身的酵母当仁不让地成为生命科学研究的“宠儿”。
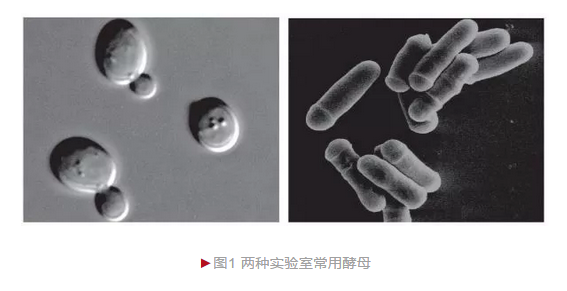
自然界已发现酵母1500多种,而实验室最常用的两类是酿酒酵母(Saccharomyces cerevisiae)和裂殖酵母(Schizosaccharomyces pombe)(图1),尤以前者应用最广。酿酒酵母,又称面包酵母或芽殖酵母,广泛应用于物质代谢、周期调控、囊泡运输、细胞自噬和细胞衰老等研究;裂殖酵母主要应用于细胞周期调控、DNA损伤应答和DNA复制等研究。
2 研究简史
酵母(主要指酿酒酵母)的应用源远流长。几千年前,人类就已在无意中应用到酵母,如碾碎的葡萄在水中可进行发酵,而直到19世纪才通过实验证明这种效果主要由葡萄表皮携带的酵母完成,人们因此有目的地将具有发酵活性的成分添加到谷物、麦芽等用于造酒、酿醋等。
酵母真正进入科学家的视野始于现代科学的兴起阶段。1680年,荷兰科学家列文虎克(Anton van Leeuwenhoek)首次在显微镜下观察到酵母。 19世纪,随着大量酵母的制备和应用,对它的研究逐渐成为科研焦点。法国微生物学家巴斯德(Louis Pasteur)严格地用实验证明,酒精发酵是酵母工作的结果——在存在酵母且缺乏氧气前提下蔗糖可被转变为乙醇和二氧化碳。德国化学家李比希(Justus von Liebig)则提出,发酵过程实际是酵母内酶催化的结果,并将这种酶称为酵素。当时出现“活力论”观点, 认为生命和非生命之间存在无法逾越的鸿沟,酵素只能在活酵母内发挥活性。这一论点于1897年被德国化学家毕希纳(Eduard Buchner)的“无细胞酵母体系”所否定,并开创酵母无细胞研究领域。
20世纪30年代,酵母开始作为模式生物登上遗传学舞台。当时经典遗传学家利用豌豆、果蝇和玉米等取得了一系列重大的进展并奠定了遗传学基础,但许多研究者认为它们过于复杂,因此独辟蹊径开始寻找替代物。 1933年,丹麦生物学家温厄(Øjvind Winge)观察到酵母具有易保存、 易培养等优点,因此决定将酵母开发为遗传学模式生物。他利用显微操作对酿酒酵母的生活周期进行了全面描述,证明酵母通过交配实现遗传物质的交换,其性状分离符合孟德尔规律。
温厄的研究工作为酵母遗传学的发展奠定了基础,他因此被誉为“酵母遗传学之父”(图2)[1]。此外,美国遗传学家林德格伦(Carl Lindegren)也尝试将酿酒酵母作为模式生物,完成酵母培养、遗传操作、 性状筛选等工作,成为后续诸多研究的基础。1946年,瑞士遗传学家利奥波德(Urs Leupold)在温厄鼓励下研究裂殖酵母,筛选到多株不同配型的酵母株。 随后几十年,利奥波德阐明裂殖酵母遗传突变和阻遏蛋白,构建出第一张遗传图谱,成为裂殖酵母领域的奠基人[2]。
20世纪60年代,酵母逐渐成为生命科学领域的重要模型。美国遗传学家谢尔曼(Fred Sherman)借助酵母突变体,一方面证明了遗传密码的通用性,另一方面还鉴定出起始密码子AUG和三个终止密码子UAA、UAG和UGA。谢尔曼还制备出大量的酵母突变体,建立新型筛选方法,强化酵母模式生物的地位。70年代,谢尔曼与芬克(Gerald Fink)合作开办冷泉港酵母分子生物学讲习班,一方面讲授酵母遗传学、细胞生物学的基础理论和实验操作,另一方面谢尔曼还以身作则传授青年学子思考、从事和享受科学的方式。谢尔曼影响了几代酵母遗传学家,如谢克曼(Randy Wayne Schekman)等。英国动物学家米基森(John Murdoch Mitchison)则将裂殖酵母应用于细胞增殖和周期调控的研究,被誉为酵母细胞生物学的先驱。20世纪70年代,酵母生物学的发展迎来黄金时代,科学家借助酵母先后阐明了细胞周期调控、细胞囊泡运输、端粒功能、细胞自噬、蛋白质折叠机制、未折叠蛋白应答、组蛋白调控等众多生命现象,并因此诞生多位诺贝尔奖获得者。

►图2 酵母遗传学与细胞生物学先驱
1990年,人类基因组计划的实施也推动了酵母基因组研究的步伐。1996年,酿酒酵母的基因组测序完成, 这是完成的第一个真核生物基因组; 2002年,进一步完成裂殖酵母的基因组测序。酵母基因组测序的完成进一步推动了酵母生物学的全面发展。2014年,纽约大学酵母遗传学家伯克(Jef Boeke)完成酿酒酵母染色体Ⅲ的人工全合成,从而使酵母的研究达到新高度。
3 无酵母细胞体系
20世纪上半叶是经典生物化学的时代,而下半叶则是分子生物学的天下。 在生物化学时代(亦称代谢时代),酵母最大的用途在于提供体外反应体系。
3.1 无细胞酵解的发现

毕希纳是一位有机化学家,他研究酵母的初衷在于探索酵母的医用价值。 毕希纳与助手用研磨方法破坏慕尼黑酿酒酵母的外部结构以释放内含物, 将酵母匀浆进一步过滤后除去未碾碎成分,即可制备出纯净酵母汁。由于一次制备的酵母汁数量过大,需进行保存。当时常用防腐剂是高浓度蔗糖。当毕希纳将蔗糖加入酵母汁后,意外地发现溶液中产生大量气泡,经分析表明它是二氧化碳。这一现象意味着酵母汁可使蔗糖转化出二氧化碳,而这恰恰是发酵过程(图3)。这一实验清晰地表明酵素可在无活酵母情况下拥有催化活性,因而宣布“活力论”破产。1907年,毕希纳由于“无细胞发酵的发现”而独享诺贝尔化学奖。毕希纳的发现具有重大的哲学意义, 阐述了“生命是一个化学过程”。这一信念成为20世纪生命科学的指导思想,并推动代谢生物化学和分子生物学迅猛发展,时至今日,体外实验仍是生命科学领域最重要的研究体系。从这个角度而言,1897年应看作生物化学元年,而酵母在其中的贡献功不可没。
3.2 辅酶的发现
毕希纳的实验仅表明酵素可在体外发挥催化功能,但作用方式不详。 1904年,英国生物化学家哈登爵士(Sir Arthur Harden)和同事杨(William John Young)决定进一步研究酵素的作用机制。已知酵母汁加热煮沸后催化活性消失,而哈登等将煮沸后的酵母汁与催化能力极低的过期酵母汁混合后意外地发现催化能力加强,这表明一种热稳定物质对于酵母汁的活性具有重要影响。为证明这种热稳定性物质的特性,哈登采用超滤法将酵母汁分为两部分:可透过的小分子物质和不可透过的大分子物质。两者单独检测均无酶活性,重新混合则酵解能力恢复。将两者分别煮沸后加入过期酵母汁,发现只有小分子物质具有增强效应,说明其具有耐热性;两者不煮沸分别加入、则大分子物质活性增强能力更高,说明它是主要催化部分。结合这一系列结果,哈登确定酵素并非单一成分,而由两部分构成——不耐热大分子物质和耐热小分子物质(辅酶)[3]。随后瑞典化学家冯歇尔平(Hans von Euler-Chelpin)进一步确定辅酶的构成。
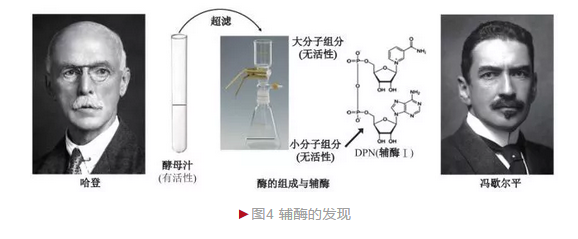
冯歇尔平敏锐地意识到辅酶研究的重要性和简单性(比大分子物质易研究),因此着手这一课题。他从大量酵母汁提取获得200个单位酶活性粗提液,进一步浓缩成85 000个单位酶活性的高纯度酶,这一操作可最大程度地减少杂质影响。冯歇尔平最终分离得到高纯度的辅酶,并借助化学分析手段确定辅酶的组成。它由三部分构成,分别为戊糖、碱基和磷酸,是一种二磷酸吡啶核苷酸(Diphosphopyridine nucleotide,DPN),后称辅酶Ⅰ。1929年,哈登和冯歇尔平由于“酶的组成和辅酶的发现”而分享诺贝尔化学奖(图4)。
3.3 黄素氧化酶的发现
生物氧化是机体最重要的化学反应之一,是能量代谢的基础。1932年, 德国生物化学家瓦伯格(Otto Heinrich Warburg, 1931年诺贝尔生理学或医学奖获得者)与同事在酵母中发现一种黄色氧化酶(黄酶),并确定氧化酶由两部分构成,即黄色色素和载体蛋白。后证实黄色色素含核黄素, 即维生素B2。然而补充核黄素或维生素B2到载体蛋白却无法恢复酶活性,说明黄色色素与核黄素并非相同物质。1934年,瑞典生物化学家特奥雷尔(Axel Hugo Theodor Theorell)在瓦伯格实验室完成酵母黄色氧化酶两部分的分离和纯化,而最关键在于获得结晶,意味着获得的两种物质纯度极高。两者单独均无活性,但混合后催化能力恢复,从而完成真正意义上的酶拆分和再结合实验。对色素部分的分析表明,其并非单纯核黄素, 而是核黄素单磷酸(Flavin mononucleotide, FMN)。这一结果很好地解释了当初的实验现象。1955年,特奥雷尔由于在“氧化酶本质和作用方式方面的发现”而获诺贝尔生理学或医学奖(图5)。

3.4 酵母丙氨酸-tRNA序列的测定
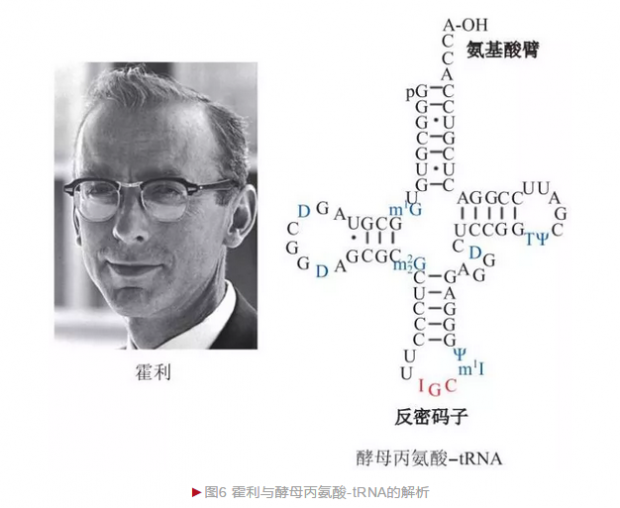
20世纪60年代,美国生物化学家霍利(Robert William Holley)决定通过解析tRNA结构而理解其生物学功能。由于酵母获取便利而成为研究对象,霍利花费3年时间共从100kg酿酒酵母获得200g酵母tRNA粗提物,最终获得1g高纯度酵母丙氨酸-tRNA。霍利采用和桑格胰岛素测序类似的策略, 首先将酵母丙氨酸-tRNA利用两种识别位点不同的核酸内切酶水解出不同片段的寡核苷酸,完成寡核苷酸测序后再采用序列重叠法将短片段拼接出完整序列。1965年,霍利完成76个核苷酸的酵母丙氨酸-tRNA全序列——这是人类破译的第一种核酸分子, 还进一步获得二级结构,发现tRNA含有氨基酸臂和反密码子环[4](图6)。反密码子与mRNA上密码子通过互补配对保证氨基酸准确定位,对理解蛋白质翻译过程具有重要意义。1968年,霍利等三位科学家由于在“破译遗传密码”方面的贡献而分享诺贝尔生理学或医学奖。1981年,中国科学家王德宝等在世界上首次完成酵母丙氨酸-tRNA的人工合成,提升了中国在该领域的国际地位。
3.5 真核转录机制的发现
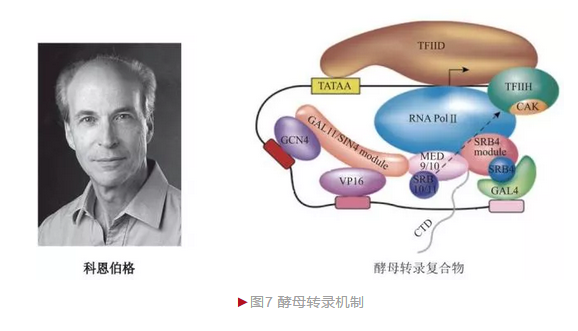
基因转录是最基础的生物学问题之一,对理解DNA的基因表达和调控具有重要意义。真核生物三种RNA聚合酶负责不同RNA的转录,其中负责mRNA转录的RNA聚合酶Ⅱ调控最为精细。20世纪70年代,美国生物化学家科恩伯格(Roger David Kornberg)决定阐明这一过程。
尽管真核生物转录复杂,但科恩伯格从复杂中寻找简单,他选择最简单的真核生物——酿酒酵母作为研究对象,制备出无酵母体外转录体系, 奠定后续研究的基础。科恩伯格利用体外转录体系,在验证前期mRNA转录需RNA聚合酶Ⅱ和通用转录因子的基础上,发现中介复合物(Mediator)也发挥关键作用。为更好地理解真核mRNA转录详细机制,科恩伯格决定解析转录复合物结构。随后十几年,科恩伯格克服真核转录复合物结晶难以及动态捕获、成像技巧和数据分析等各方面的难题,最终于2001年在分子水平解析了真核转录机制[5](图7)。科恩伯格一方面获得2.8 Å分辨率包含10个亚基的酵母RNA聚合酶Ⅱ结构,从而理解转录基本过程;另一方面还获取包含RNA聚合酶Ⅱ、模板DNA和产物RNA在内的转录延伸复合物, 从而解析转录动态过程。进一步研究后他还阐明了酵母转录中多个步骤的分子机制,包括启动子识别、转录起始、核苷酸添加、转录延伸、核苷酸选择、转录终止等,从而对转录机制的理解有了本质的提升。转录机制的阐明对许多过程如发育、分化、凋亡和疾病如癌症、炎症和代谢性疾病等有了新的理解。
2006年,科恩伯格由于“真核生物转录分子机制”的阐明而独享诺贝尔化学奖。清华大学施一公教授研究剪接体结构也以酵母为材料,出发点在于系统简单。
4 理想模式生物
分子生物学时代, 酵母成为阐述许多基本生物学问题的重要模式生物。
4.1 细胞周期
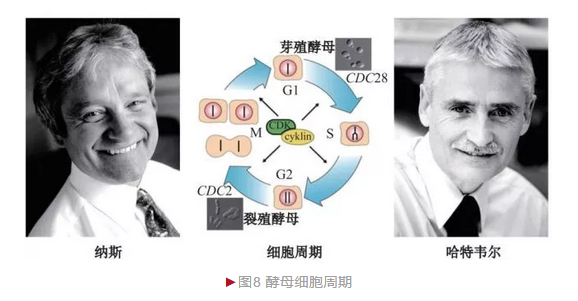
真核生物细胞周期(Cell cycle)一般分为细胞间期(G0)、有丝分裂期和胞质分裂期(M)。有丝分裂期还可进一步分为细胞生长1期(G1)、DNA合成期(Synthesis, S)和细胞生长2期(G2)。20世纪60年代末,美国生物学家哈特韦尔(Leland Hartwell)决定以酿酒酵母为材料研究细胞周期,从而掀起从传统酵母遗传学向细胞生物学过渡的大幕。
哈特韦尔采用经典遗传学方法诱导大量酵母突变体,从中筛选细胞周期异常突变体作为实验材料。哈特韦尔发现100多种酵母基因与细胞周期相关, 统称细胞分裂周期(Cell divisioncycle,CDC)基因[6],其中CDC28基因最为关键,它的突变造成酵母停滞G1期而无法进入S期,因此称为“起始”基因。
哈特韦尔的成功激发英国细胞生物学家纳斯(Paul Nurse)也进入细胞周期领域。纳斯选择裂殖酵母作为模式生物。 相对于芽殖酵母,裂殖酵母采取均等分裂产生两个子细胞,这种模式更类似哺乳动物细胞。纳斯也鉴定出大量裂殖酵母细胞分裂周期基因,除部分与芽殖酵母相同外,还有自身特有基因,特别是CDC2,该基因突变造成酵母无法从G2期进入M期。 1987年,纳斯采用回补实验还鉴定出酵母CDC2同源蛋白——细胞周期蛋白依赖激酶1(Cyclin dependent kinase1, CDK1)[7],说明细胞周期过程的保守性。
细胞周期在生殖和发育等过程中发挥关键作用,其异常与癌症相关。 2001年,哈特韦尔和纳斯等三位科学家由于“细胞周期关键调节蛋白”发现而分享诺贝尔生理学或医学奖(图8)。
4.2 端粒保护
端粒(Telomere)是20世纪30年代在真核生物中发现的一种染色体末端特殊结构。70年代末,美国分子生物学家布莱克伯恩(Elizabeth Blackburn)以四膜虫(Tetrahymena thermophila)为材料借助桑格DNA测序发现染色体端粒区含有大量六核苷酸(CCCCAA)串联重复, 但不清楚它的生物学意义。1980年的一次学术会议上,布莱克伯恩与哈佛医学院佐斯塔克(Jack William Szostak)相识, 决定合作揭开这一奥秘。
布莱克伯恩和佐斯塔克发现酵母染色体端粒区自身独有重复序列(TG1-3),证明了布莱克伯恩结果的可靠性。和布莱克伯恩合作前,佐斯塔克已发现酵母存在少量小染色体,它们为线性结构,极不稳定。当发现酵母也存在端粒结构后,他们一起将四膜虫端粒重复结构添加到酵母小染色体末端, 结果发现杂合染色体稳定性极大提升(图9)[8]。这一结果一方面证明端粒的生物学功能(保护染色体避免降解),另一方面说明结构保守性(四膜虫端粒在酵母内发挥活性)。佐斯塔克实验室还制备出端粒生成异常的酵母突变体。这些酵母虽可正常生长,但随着细胞分裂而导致端粒快速缩短,酵母出现衰老,证明端粒具有保持长寿的功能。
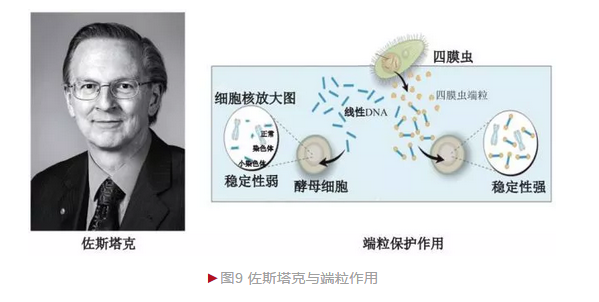
2009年,佐斯塔克和布莱克伯恩等三位科学家由于“端粒、 端粒酶及在染色体保护机制方面的发现”而分享诺贝尔生理或医学奖。
4.3 囊泡运输
20世纪70年代,研究人员借助形态学和细胞生物学方法观察到细胞内存在频繁的物质运输,且整个过程由囊泡(Vesicle)介导完成。1975年,美国生物学家谢克曼决定利用酵母研究囊泡的运输机制。谢克曼筛选到大量酵母突变体,部分突变体为温度敏感型——低温下正常生存,但高温致死。 谢克曼对两株酵母突变体观察后发现,细胞内由于运输异常而出现囊泡大量积累(图10)。谢克曼将引起两株酵母囊泡运输异常的基因称为“分泌基因”, 命名为secl和sec2[9]。谢克曼和学生随后通过更大规模的突变体筛选获得23个囊泡运输相关基因。遗传学和生物化学分析表明囊泡运输是一个高度保守的过程,哺乳动物(包括人)都存在酵母同源基因。因此,谢克曼在酵母囊泡中的发现成为理解哺乳动物囊泡机制的基础。
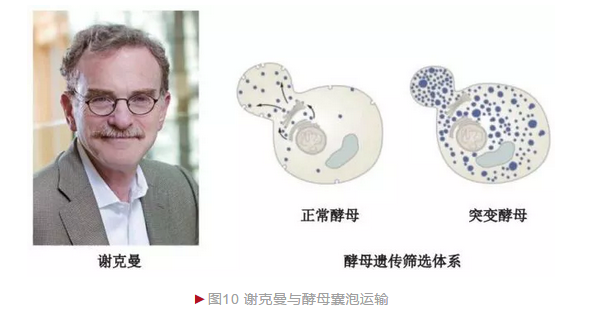
囊泡运输是一个关键的生物学过程,可完成蛋白质等“货物”的精确定位, 是神经系统信号传导、免疫系统细胞因子分泌,以及内分泌系统激素生成和作用发挥等生理过程完成的基础。它的异常是糖尿病和帕金森综合征等发生的原因之一。2013年,谢克曼与另外两位科学家由于“细胞内主要运输体系——囊泡运输调节机制的发现”而分享诺贝尔生理学或医学奖。
4.4 细胞自噬
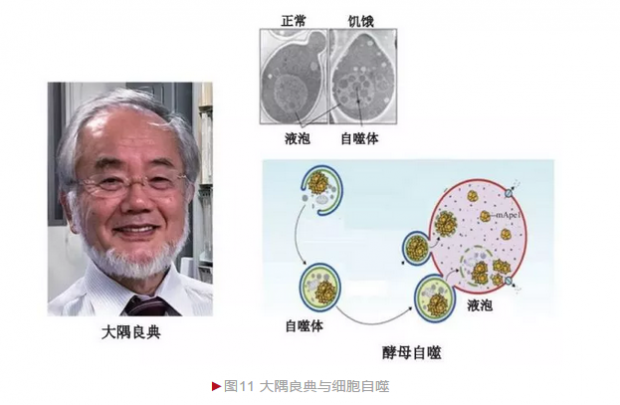
1963年,比利时细胞生物学大师德迪夫(Christian de Duve)首先提出“自噬”(Autophagy)概念,即细胞将自身成分或外源蛋白整合入溶酶体进行彻底降解或“废物”再利用的过程。1988年,日本细胞生物学家大隅良典(Yoshinori Ohsumi)决定利用酵母研究细胞自噬。
利用酵母研究自噬的最大障碍在于细胞太小,借助光学显微镜较难区分亚细胞内的精细结构。大隅良典认为自噬是一个动态过程,正常情况下细胞发生数量有限,不宜观察。然而当自噬过程异常而引发积累,则在显微镜下容易观察。大隅良典首先诱导出大量酵母突变体,随后采用饥饿培养法以增加酵母自噬的发生,结果发现突变酵母出现大量泡状聚集(图11)[10]。这一实验一方面说明酵母适合自噬研究,另一方面还鉴定出第一种自噬基因。大隅良典随后开展更大规模的筛选,最终发现15个酵母自噬基因,从而奠定了自噬的研究基础。随着深入研究并陆续解析酵母自噬基因的生物学功能,他最终勾画出自噬发生的基本轮廓。更重要的是,细胞自噬在真核生物高度保守,而人类也存在酵母自噬基因同源物,因此酵母自噬研究为理解人类发育和疾病发生提供了重要范式。自噬现象和机制的研究意义在于对许多疾病的发生有了新认识,为新疗法的开发带来希望。自噬是一个基本的生物学过程,它的异常与肿瘤、帕金森综合征、糖尿病等多种疾病的发生相关,因此有望开发药物通过增加或减少自噬的发生而达到缓解甚至治愈疾病的目的。2016年,大隅良典由于“自噬机制的发现”而独享诺贝尔生理学或医学奖。
4.5 蛋白伴侣
20世纪60年代初,美国国立卫生研究院生物化学家安芬森(Christian Anfinsen)以核糖核酸酶为材料证明蛋白质一级结构(氨基酸序列)决定空间结构,而空间结构决定功能,即著名的“安芬森定则”。安芬森因此分享1972年的诺贝尔化学奖。后续大量的实验证明了安芬森定则的正确性,但核糖体上刚翻译出的线性蛋白质如何折叠出复杂空间结构还是一个未解难题。
20世纪80年代,美国遗传学家霍维茨(Authur L. Horwich)应用分子生物学新工具研究遗传性疾病。鸟氨酸氨甲酰转移酶(OTC)基因突变是一种性连锁高血氨遗传病的原因,患病男婴常夭折。OTC基因定位于X染色体, 蛋白却在线粒体发挥作用。1983年,霍维茨克隆到大鼠OTC基因, 并准备研究OTC蛋白线粒体的定位机制。他考虑到哺乳动物复杂性而选择酵母作模式。霍维茨将人OTC基因转入酵母,发现人OTC蛋白可准确定位到酵母线粒体并发挥生物学功能,证明了模型的可行性。霍维茨随后与德国慕尼黑大学哈特(Franz Ulrich Hartl)合作筛选到一种酵母突变体,此时人OTC蛋白不再拥有正常功能;从酵母文库筛选到热激蛋白60(Hsp60)可弥补这种缺陷[11]。Hsp60在生物体内普遍存在,亦称伴侣蛋白(Chaperone),主要辅助蛋白质完成正确折叠。正是Hsp60基因突变破坏OTC蛋白折叠而无生物活性。
伴侣蛋白的发现丰富和完善了安芬森定则,体内大部分蛋白折叠需伴侣蛋白的协助,尤其在高温或胁迫等情况下意义更为重大(图12)。需指出的是,真核生物蛋白质折叠采取类似机制完成,具有高度保守性。伴侣蛋白在蛋白质折叠中的功能及机制的阐明一方面深化了对蛋白质空间结构形成的理解,另一方面还具有重要的临床价值。细胞内蛋白质错误折叠可造成多种疾病如早老性痴呆、帕金森综合征、亨廷顿氏舞蹈病和疯牛病等的发生, 因此相关研究将对提升这些疾病的治疗水平具有重要价值。霍维茨和哈特也因此分享众多科学荣誉, 包括2011年拉斯克基础医学奖等。
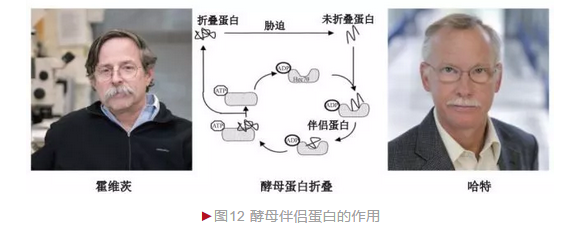
4.6 未折叠蛋白应答
蛋白质空间结构的正确折叠对细胞生命具有重要意义,营养缺乏等环境胁迫下未折叠蛋白数量增加可诱导细胞启动应答机制以降低损伤、度过难关, 它们被称为未折叠蛋白应答(Unfolded protein response, UPR)。1988年,研究人员发现葡萄糖缺乏可造成哺乳动物细胞蛋白质错误折叠并诱发伴侣蛋白BiP表达增加,但哺乳动物的复杂性使研究BiP诱导机制困难重重。
1989年,日本科学家森和俊(Kazutoshi Mori)决定另辟蹊径利用酵母研究UPR过程。酵母存在BiP同源基因,并且在环境胁迫下也表达增加。森和俊发现酵母BiP同源基因上游存在一个UPR调节序列,并在此基础上构建出一个简单、精妙的UPR基因筛选体系。他将UPR调节序列整合到b-半乳糖苷酶基因上游并转入酵母,通过蓝白斑实验快速确定未折叠蛋白应答。 森和俊首先诱导转基因酵母突变,从中可筛选到UPR相关基因。这个方法学革新极大地加速了研究进程。不久加州大学圣地亚哥分校瓦尔特(Peter Walter)也加入研究行列。
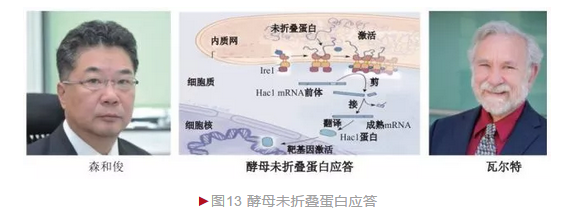
1993年,森和俊和瓦尔特两个团队几乎同时筛选到酵母未折叠蛋白应答过程第一个关键分子——肌醇需求蛋白1(Ire1)[12-13]。Ire1是一种蛋白激酶,定位于内质网膜,内质网内侧感知未折叠蛋白,内质网外侧(细胞质侧)激活下游分子。1996年,两小组又鉴定出Hac1,并证明它以一种独特的方式参与UPR。一般蛋白激酶通过催化自身或下游蛋白磷酸化而发挥生物活性,激活的Ire1却诡异地产生一个RNA内切酶结构域, 将无翻译活性的Hac1的mRNA中间部分准确切除,随后借助一种tRNA连接酶将两端连接,产生成熟mRNA并翻译出Hac1蛋白(图13)。Hac1是一种转录因子,可进入细胞核调节URP相关基因表达,从而启动应答。后续研究表明,UPR过程在酵母和哺乳动物中高度保守,因此酵母结果为其他研究提供重要借鉴。
未折叠蛋白应答是生物在不利环境下通过调整基因表达模式和代谢变化来维持内稳态而增加适应性的机制,因此在细胞发育、分化、激素分泌和抗体生成等过程中发挥关键作用。未折叠蛋白应答异常可导致糖尿病、肥胖、 神经退行性疾病和癌症等多种疾病的发生。森和俊和瓦尔特也凭借这一奠基性的贡献获得许多重大奖项,包括2014年美国拉斯克基础医学奖等。
4.7 细胞生长信号转导
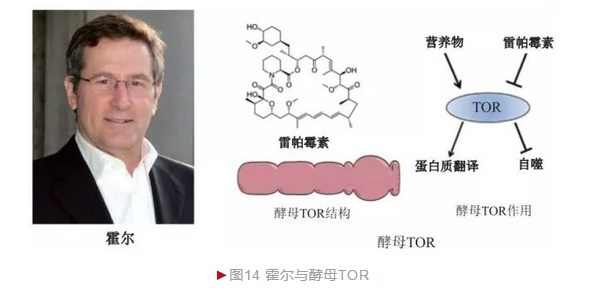
自然界的生物时刻面临各种环境胁迫如温度变化、营养状况等影响,因此机体如何感知外界环境信息并传递到细胞内以启动相应应答机制是基本的科学问题之一。瑞士细胞生物学家霍尔(Michael Nip Hall)决定以酵母为材料研究该问题。霍尔从药物分子入手,探索实验室常用免疫抑制剂环孢菌素、雷帕霉素(Rapamycin)和FK506等对酵母生长的影响。借助成熟的酵母遗传学技术,霍尔筛选到针对三种化合物产生抗性的酵母突变体,并进一步分析这些突变体确定它们的作用靶点。1991年,霍尔小组从酵母中鉴定出两种雷帕霉素靶点(Target of rapamycin, TOR),分别命名TOR1和TOR2[14]。正常情况下它们作为酵母细胞生长、分裂和自噬等过程的核心调节蛋白。进一步研究发现,TOR是一种细胞内蛋白激酶,一方面感知环境营养状况(如氨基酸缺乏等),一方面则通过催化下游底物磷酸化最终控制细胞增殖(图14)。不久,几家研究小组同时从哺乳动物中鉴定出酵母TOR同源蛋白,称为mTOR(mammalian TOR)。抑制mTOR活性可降低免疫应答,1999年,雷帕霉素被FDA批准用作器官移植中排斥反应抑制剂。mTOR活性还被生长因子和胰岛素信号等激活,抑制mTOR活性具有类似卡路里限制效应,因此雷帕霉素饲养小鼠具有延长寿命的功效。霍尔由于酵母TOR的重大发现而荣获多项科学大奖,包括美国生命科学突破奖(2014年)和加拿大盖尔德纳国际奖(2015年)等。
4.8 DNA损伤应答
外界环境可造成生物DNA损伤和突变,而生物体有一套完整的DNA修复机制以减少DNA突变,从而引发一个基本科学问题: 机体如何感知DNA损伤并启动修复应答?美国遗传学家埃利奇(Stephen Joseph Elledge)借助酵母为材料揭开了这一谜团。
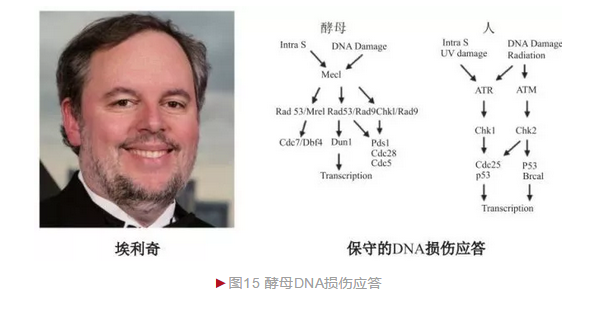
埃利奇在读博士期间研究细菌DNA损伤及修复,进入斯坦福大学开展博士后研究时决定拓展到真核生物,并选择酵母作为模式。埃利奇最初想在酵母中寻找细菌DNA损伤修复同源基因,却意外发现一种酵母独有DNA损伤基因——核糖核苷酸还原酶2(Ribonucleotide reductase 2,Rnr2),并发现DNA损伤后Rnr2基因表达急剧增加,因此Rnr2基因表达增强与否就成为衡量酵母感知DNA损伤的重要指标。埃利奇借此从大量酵母突变体中筛选到特定DNA损伤应答缺失体,进一步鉴定出多种DNA损伤应答相关基因。最早鉴定出一种可进入细胞核发挥作用的蛋白激酶DUN1[15],并且其磷酸化程度对应答基因表达具有重要影响,从而证明蛋白磷酸化修饰参与DNA损伤应答。埃利奇随后又鉴定出多种蛋白激酶,最著名的如Mec1等,后续证明Mec1与人DNA损伤相关因子ATM高度同源,特别是广泛研究后表明酵母和人的整个应答过程基本一致(图15)。埃利奇的先驱性贡献极大拓展了对真核生物DNA损伤应答的理解和认识,为许多疾病如癌症等的治疗提供了新选择。埃利奇已获盖尔德纳国际奖(2013年)、拉斯克基础医学奖(2015年)和生命科学突破奖(2016年)等。
4.9 组蛋白调控功能
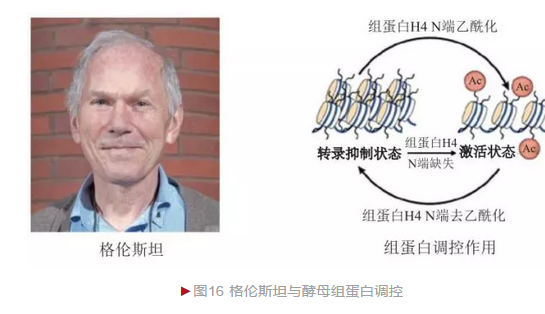
组蛋白是染色体基本组分之一。20世纪80年代前,主流观点普遍认为其仅仅参与染色体高级结构的形成,而不具有其他功能,是一种“惰性”物质。 1975年,格伦斯坦(Michael Grunstein)开始研究组蛋白的作用,并最终选定酵母作为模式生物。
格伦斯坦采用基因突变使酵母组蛋白功能完全缺失造成酵母致死,然而这一结果无法判断是因为组蛋白影响基因表达还是破坏染色体结构造成的。 格伦斯坦改变策略,将组蛋白H4的N端部分氨基酸去除,观察发现染色体无明显结构异常,酵母也可正常生存,但有性生殖能力丧失[16]。进一步分析发现,原本影响正常生殖的沉默基因被重新激活,造成生殖紊乱,从而说明组蛋白H4的N端具有转录抑制作用(图16)。这是首次在活体内证明组蛋白与基因表达之间的因果关系。格伦斯坦研究还发现,当组蛋白H4的N端赖氨酸乙酰化后,原本的抑制作用消失,部分沉默基因出现转录激活,从而说明组蛋白乙酰化具有转录激活效应。1996年,两个小组鉴定出可逆组蛋白乙酰化对基因表达的调节作用,验证了格伦斯坦结果的正确性。组蛋白翻译后修饰是重要的表观修饰方式,在基因表达调节、异染色体形成等多个方面发挥重要作用,其异常可造成癌症、糖尿病等多种疾病的发生。格伦斯坦在组蛋白表观调节领域做出了一系列奠基性的贡献。
4.10 其他
酵母还有其他应用, 如:卡路里限制与长寿,组蛋白去甲基化酶Sir2的长寿作用;酵母还成为帕金森综合征等的研究模型;蛋白质相互作用的酵母双杂交体系等。限于篇幅,这里不再拓展。
5 前景与展望
模式生物是大多数生命科学研究不可或缺的一环,选择一种理想的模式生物往往是成功的开始。至今,酵母作为模式研究已获近十项诺贝尔奖,而且还有多项成果有望将来登顶,突显了酵母对生命科学发展的重要推动作用。当然,作为单细胞的酵母也有不足之处,它主要用作研究一些基础生命科学问题,如细胞生物学,原因在于酵母本身就是一个细胞,而对多细胞生物的一些复杂问题如学习记忆、器官发生等问题则基本无效。总之, 酵母作为一种模式生物发挥了自身巨大的科研价值,随着新技术和新理论的出现,酵母的应用范围会更广泛。
注:本文转载自上海《自然》杂志,经授权转发。该杂志创刊于1978年,由上海大学主办。
参考文献
[1] SZYBALSKI W. My road to Øjvind Winge, the father of yeast genetics
[J]. Genetics, 2001, 158(1): 1-6.
[2] FANTES P A, HOFFMAN C S. A brief history of Schizosaccharomyces
pombe research: a perspective over the past 70 years [J]. Genetics,
2016, 203(2): 621-629.
[3] HARDEN A, YOUNG W J. The alcoholic ferment of yeast-juice. Part
II. The conferment of yeast-juice [J]. Proc R Soc B, 1996, 78(526):
369-375.
[4] HOLLEY R W, APGAR J, EVERETT G A, et al. Structure of a
ribonucleic acid [J]. Science, 1965, 147(3664): 1462-1465.
[5] CRAMER P, BUSHNELL D A, KORNBERG R D. Structural basis
of transcription: RNA polymerase II at 2.8 angstrom resolution [J].
Science, 2001, 292(5523): 1863-1876.
[6] HARTWELL L H, CULOTTI J, REID B. Genetic control of the celldivision cycle in yeast. I. detection of mutants [J]. Proc Natl Acad Sci
USA, 1970, 66(2): 352-359.
[7] LEE M G, NURSE P. Complementation used to clone a human
homologue of the fission yeast cell cycle control gene cdc2 [J]. Nature,
1987, 327(6117): 31-35.
[8] SZOSTAK J W, BLACKBURN E H. Cloning yeast telomeres on linear
plasmid vectors [J]. Cell, 1982, 29(1): 245-255.
[9] NOVICK P, SCHEKMAN R. Secretion and cell-surface growth are
blocked in a temperature-sensitive mutant of Saccharomyces cerevisiae
[J]. Proc Natl Acad Sci USA, 1979, 76(4): 1858-1862.
[10] TAKESHIGE K, BABA M, TSUBOI S, et al. Autophagy in yeast
demonstrated with proteinase-deficient mutants and conditions for its
induction [J]. J Cell Biol, 1992, 119(2): 301-311.
[11] CHENG M Y, HARTL F U, MARTIN J, et al. Mitochondrial heatshock protein hsp60 is essential for assembly of proteins imported into
yeast mitochondria [J]. Nature, 1989, 337(6208): 620-625.
[12] COX J S, SHAMU C E, WALTER P. Transcriptional induction of
genes encoding endoplasmic reticulum resident proteins requires a
transmembrane protein kinase [J]. Cell, 1993, 73(6): 1197-1206.
[1]3 MORI K, MA W, GETHING M J, et al. A transmembrane protein with
a cdc2+/CDC28-related kinase activity is required for signaling from
the ER to the nucleus [J]. Cell, 1993, 74(4): 743-756.
[14] HEITMAN J, MOVVA N R, HALL M N. Targets for cell cycle arrest
by the immunosuppressant rapamycin in yeast [J]. Science, 1991,
253(5022): 905-909.
[15] ZHOU Z, ELLEDGE S J. DUN1 encodes a protein kinase that controls
the DNA damage response in yeast [J]. Cell, 1993, 75(6): 1119-1127.
[16] KAYNE P S, KIM U J, HAN M, et al. Extremely conserved histone
H4 N terminus is dispensable for growth but essential for repressing
the silent mating loci in yeast [J]. Cell, 1988, 55(1): 27-39.

话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。




 京公网安备 11010502034662号
京公网安备 11010502034662号 