阅读:0
听报道

撰文 | 文海军,王宏毅,贺雄雷,吴仲义 翻译 | 何东明 责编 | 蒋海宇
早前有研究指出,近九成肿瘤生物学论文的实验结果不能重复。最近,eLife期刊上刊登了五个详细的重复性研究,将这一数字证实。研究结果的不可重复常被归咎于人为因素,因而认为可以避免。但是其原因也可能是生物学上的,以致这些研究本质上就无法重复。肿瘤研究的可重复率低,将深刻地影响到临床的方案,同时也反映出肿瘤生成多样的进化通路。
背 景
可重复性是实验科学的基础。尽管多种因素困扰着不同研究领域,影响的程度也不尽相同,肿瘤研究却显得首当其冲。早前一个报告指出,53个发表的肿瘤研究,只有6个的结论可被重复。可重复率低至10%,让人担忧。该报告同时还指出,极低的可重复率也是制药工业界的普遍经验。
这么低的重复率引起了特别关注。因为那些成果一般都发在高影响因子杂志上,所以它们对肿瘤的临床与基础研究正有着实质的影响。通过这篇评论,我们首先回顾对研究结果可重复性的最新评估。第二,我们将探讨造成这低重复率的根本原因。尽管低重复率常被归咎于人为因素,但实际上是有更深层生物学原因的。第三,哪些研究应该能重复,哪些研究本质上就不可重复,我们应做一个明确的划分。第四,我们为如何应对结果不可重复提出了一些建议。
可重复性评估的最新消息:肿瘤重复性研究项目
肿瘤重复性研究项目(RP:CB)是为了严格地解决可重复性这个问题而发起的。它选了高影响因子期刊上 30个肿瘤研究进行可重复性研究。因为不能重复大都是由于技术因素,该项目的重要贡献之一就是排除了这些明显原因的可能性。正式重复研究之前的注册报告会概述重复实验的设计。实验设计被审议并通过后,重复性研究才开始进行。因为双方都同意可重复性原则,所以重点放在确保实验材料与方法被准确复制。
第一批研究报告已经发表。可重复性在报告里指“治疗方案的可操作性与可重复性”,因为这些原论文都包含了一个治疗方案。按eLife编辑部的说法,其中两个研究“可重复重要部分”,一个“不可以重复”,余下两个“难以判读”。另一个新闻报告把整体结果描述成“混乱如泥”。我们认为这些判读过于谨慎了,从更为常规的角度看,五个研究中有四个都该被判为“不可重复”,一个“难以判读”(如下表所示)。
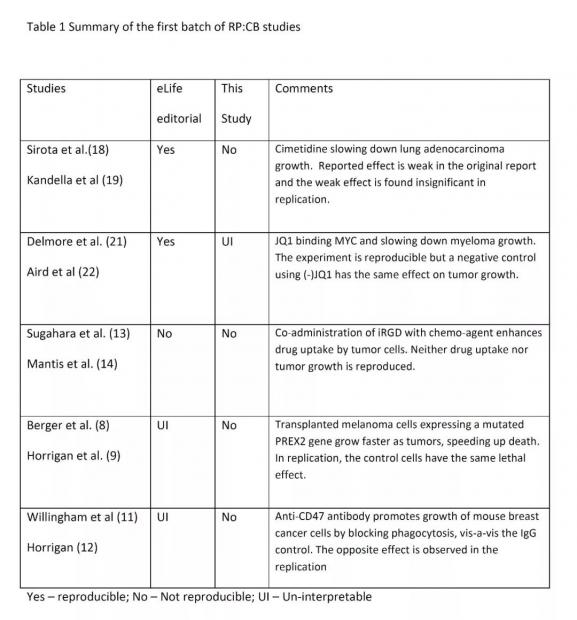
我们就从eLife编辑部认为难以判读的两个报告说起。两个实验被定为难以判读是因为其对照组的不可重复。对照组不能被重复与实验本身不能被重复其实并无大异,我们因此把这两个研究判定为“不可重复”。在Berger等人的论文中,PREX2基因在人黑色素瘤中普遍发生了突变(107个中有15个)。进一步地,引入了PREX2突变的人黑色素细胞进行的异体成瘤实验发现,实验小鼠的无瘤生存期显著缩短。Horrigan等人在重复性研究中,引用了近期的研究。这些研究并不支持人黑色素瘤中普遍发生了PREX2基因突变这个说法。并且,Horrigan等人不能证实PREX2突变能降低无瘤生存率,因为没有突变的对照组的死亡速度也是一样快(1周)。这与原论文中公布的9周中位生存期结果相反。
在另一个研究中,Willingham等人指出,CD47蛋白在多数癌症细胞膜是过表达的。由于CD47信号通路会阻止巨噬细胞对癌细胞的攻击,因此阻断CD47通路,可使经注射了MT1A2癌细胞的免疫活性小鼠中原位乳腺肿瘤的大小比对照组减少约10倍。而在Horrigan等人的重复研究中,肿瘤的大小离奇地在CD47处理组与IgG处理的对照组中逆转过来了。Horrigan指出,肿瘤的大小是高度可变的。通常,在同一种处理条件下可有5倍的差异变化。在肿瘤进化中,这种高度的可变性也很普遍,但常常被视为噪音了。应该指出的是,Willingham等人通过将人肿瘤细胞移植到免疫缺陷小鼠中也获得了类似的结果。Horrigan报告说,异种移植实验仅在一些后续研究中得到了重复。
报告中被判为一定不可重复的,是Sugahara等人的研究。他们发现用iRGD多肽处理肿瘤可使肿瘤细胞对药物的通透性增加。在他们的研究中,肿瘤是由异体移植的前列腺癌细胞所生成。Mantis等人不能重复出该结果,但过去别的研究报告认为这结果是可重复的。所以 Sugahara等人的工作虽然 eLife无法重复,但这工作并没有特别不可靠之处。
对于其余两项宣称“本质上可重复”的研究,有一项在大多数情况下是不会被认为是可重复的。Sirota等人的在细胞系上进行药物研发的生物信息学分析发现,西咪替丁可作为抗肺腺癌细胞的有效分子。虽然相同的趋势在Kandela等人的重复研究也能看到,但与对照组的差异并不显著。如Dang所说,其原因是Sirota等人报道的西咪替丁的作用太弱,而不具有生物学意义上的显著性。总体而言,与平均值的小差异相比,以这样的组内差异很难得出西咪替丁可成为治疗肺癌的有效新药。
5项研究中唯一可重复的是Delmore等人的研究。 在原研究中,他们报道小分子(+)- JQ1通过下调MYC的转录并减少多发性骨髓瘤的大小,从而改善异种移植小鼠的存活情况。 虽然Aird等人成功重复出了该结果(有一些变化),但使用不影响MYC转录的对映异构体(-)- JQ1的阴性对照组得到了与(+) - JQ1相同的生物学效应。鉴于阴性对照也会产生相同的效应,我们建议将原研究定为难以判读。
不能重复的原因
五次重复实验证实了先前报告中6/53的重复率。以前的报道暗示了是技术(甚至伦理)失误是导致低重复率的原因;然而,它们所提及的因素在整个生物学科中都很常见。而且,人们对RP:CB的悉心投入,也说明在重复性研究的努力应是充分的。因此,下面我们来寻求生物学的解释。
实验研究能否重复,取决于复制实验的测量结果能否符合原实验。 投掷硬币时,连续五次看到同一面的重复率不会高于10%。 在癌症生物学中,重复性意味着肿瘤发展过程对应于高度受限的过程,类似于组织的发育。但是,如果肿瘤发展循着进化的路径,那么结果就可能变化很大。进化过程往往包含多个步骤,需要一系列的遗传变化。而这些变化又都由随机因素控制,包括突变的出现,随机漂变和不同选择压力。由于每一步又都受前一步的影响,因此早期的小偏差也可能产生迥异的结果。
S. J. Gould在他的《奇妙的生命》一书中提出了进化本身的再现性问题。他好奇如果我们回卷“生命的磁带”,进化是否会遵循相同的轨迹重新展开(另见康威•莫里斯)。“将生命磁带卷回”到寒武纪大爆发当然只是幻想,但不断重复的进化过程确实存在,最好的例子可能就是癌症的进化了。因此RP: CB的注册/复制报告,以及编辑意见和评论中都没出现“进化”一词,实在让人摸不着头脑。
可重复的进化过程等同于趋同进化。在趋同进化中,生物重复地“选择”了一条有主导优势的进化路径。在趋同进化的范畴中,表型与基因型的区别尤为重要。自然界中,表型趋同是常见的。表型的趋同也是病理学家定义肿瘤恶性的基础。然而关键问题是:构成表型基础的基因型是否也有那样的趋同性呢?肿瘤生物发表论文中对体细胞突变、基因表达、靶向治疗不断引证,显然是认为基因型也有趋同性。
在这种背景下,大型研究项目TCGA(美国癌症基因体图谱计划)曾试图寻找肿瘤中经常突变的基因。结果是,肿瘤细胞的基因型趋同性比所希望的要低得多。比如说,12种癌症中,只有两个基因(TP53和PIK3CA)在超 10%的案例中发生突变。TP53是人基因组上的一个特殊分子,而PIK3CA 基因很长。对一特定癌症而言,肿瘤共有的高突变(在多于10%的情形中突变)的基因数一般只有10个左右。在如此低的基因趋同性下,二个同样类型的癌症往往只有少数的突变基因相同,甚至是一个没有。这些观察说明,即使开始条件相近,肿瘤也会循着不同进化轨迹发展。即使是从同一个起点(来自同一个人)开始的癌细胞,也会进入不同进化轨迹,产生丰富的基因多样性,因而对同一治疗产生不同响应。
TCGA项目反映出来的现象在自然群体中是同样存在的。尽管可观察到像回声定位基因这样的特别的基因趋同现象,但这很少见。对于并不涉及到有高度特化结构的生物,生物分子的多样性机制依然起效,于是基因型趋同将不会发生。例如,对高纬度的西藏,埃塞俄比亚,安第斯高原的居民来说,他们在高原环境的低氧适应性方面的基因突变是不同的。最近,为了寻找这一现象的分子趋同机制的大型基因组测序分析发现,这些相关的突变遍布了人的整个基因组。这再一次说明,即使在相同的环境下的多个基因组,分子趋同性还是不常见的,而其涉及的信号甚至很少超过实验结果的背景噪音。
尽管如此,癌症发展和生物体趋同进化是可以观察到的,只是条件非常严格:必须得有一个决定性的进化途径来介导最后结果的产生。比如,当实验生物体的基因非常简单(比如病毒),那么基因进化的可选择方式就只有少数几种。或者,当对特定遗传变化的选择压力很强时,则可能会出现分子趋同的结果。为此,Wu等人推测,“液体肿瘤”里,选择压力就可能特别高,因为具有增殖优势的细胞在里面可以迅速而广泛地扩散。确实,慢性粒细胞白血病,以其特征性BCR-ABL异位融合作为一个诊断标准,就是肿瘤在基因水平上进化趋同的一个最好例子。总的来说,当充分考虑了肿瘤进化的表型多样性与基因多样性的本质,以及哺乳动物基因组的复杂性的时候,我们可以推断出肿瘤发展过程的分子趋同性是个例,而非普适原则。
诚如TCGA所揭示的,真实情况下肿瘤发生分子趋同的可能性很低。但人们依旧期望,当大部分的实验条件受到控制时,他们能在小鼠身上发现高程度的趋同现象。如今,即使在简单的模型里,RP:CB项目也证实了进化的不可预测性。在5个RP:CB报告中,来自癌细胞系的细胞被移植到小鼠身上,或是自体或是异体移植。接着,实验组(E)与对照组(C)的样品被收集,作为原论文的E1,C1与重复研究的E2,C2。每只小鼠的肿瘤的生长是两个进化过程累积的结果。第一个是在移植前,待移植的癌细胞群体已经发生了差异性的进化。第二个是在移植后,癌细胞继续发生异质性的改变。移植后的变化经常在分析中被提到的,但移植前的变化却往往被忽略,即使进化不断。肿瘤细胞这一阶段的变化让人联想起经典的“卢里亚/德尔布吕克波动”。
由E1,C1,与E2,C2两次研究所得到的结果都是条件分布的。RP:CB的最终分析依据对(E1,C1)和(E2,C2)的比较。在那些不能重复出原结果的研究中,C1和C2在二项研究(PRX2, CD47)的实验里没有经历相同的进化过程, E1和E2在一项研究(iRGD)中趋异进化(参考表1)。在另一项研究(cimetidine)中,E1和C1的差别太小而没有生物学或统计学意义上的显著性。
RP:CB报告的肿瘤进化过程可用下图这样一个简单遗传模型勾画出来,它将进化途径定义为服从条件概率。这里,通过从已有的多样性里独立出来或是出现新的基因突变,进化每一步都受着前一步的影响。因此前一步的微小变化都可能会带来之后的更大差异。在图1的阶段2中,两个重复实验的轨迹几乎没有重叠,因此出现了非常不同的肿瘤表型。如果采用比图1更真实的模型来分析,所得到的肿瘤将很可能属于不同模式。我们因此建议,肿瘤研究需要发展出明确的肿瘤进化模型,而不能假定结果是简单和可重复的。
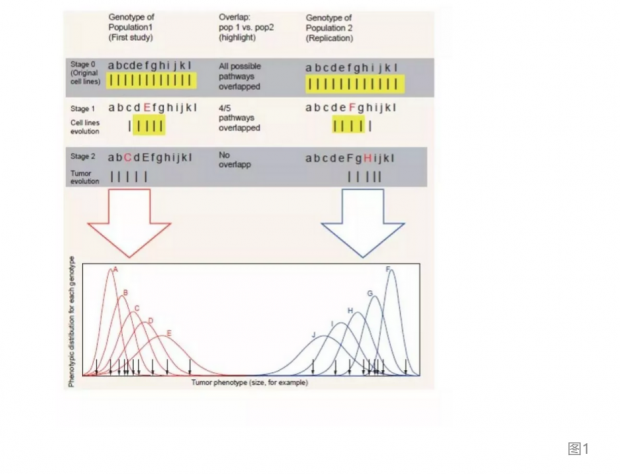
哪些研究能重复,哪些不能?
RP:CP项目在一定程度上揭示出了什么研究是可能重复的,什么是不可能重复的。如果所分析的表型在实验过程中不发生进化,那么重现性通常很高。例如化合物JQ1处理后使得MYC转录下调的结果是可以重复出来的。同样的,Horrigan所进行的重复实验也观察到使正常小鼠出现轻度贫血的毒性作用:该实验中,小鼠的组织是未发生进化的。
在肿瘤的进化中,可重复性将是一个关于进化途径的数量,强度和长度的函数。TCGA的数据表明,肿瘤进化所涉及的路径数目一定相当大。而随着每一路径上的步骤数目增多,不同可能性的量就将呈指数增长。这就使得许多肿瘤研究结果不能被重复。我们还应注意到,图1中对随附性(contingent)进化的描画,将因样本数量的增加而变得非常困难。
面对进化路径的多样性,肿瘤生物学研究往往试图分离出共有部分路径的病例:比如共有EGFR基因突变的肺癌。这些病例确实对EGFR抑制剂显示出稳健及比较可重复的结果。但这些被部分划定的遗传途径仍然常常是多样的,也常常产生不可重复的结果,如肿瘤耐药性。
结 论
让人奇怪的是,几乎没人对RP:CB和之前的其他重复性研究做出讨论。也许根据主流观点,既然低重复率是人为因素造成的,那就无须进一步的深入探讨了。但这个缺乏证据的说法,可能掩盖了低重复率背后更根本的原因。从进化的角度来看,很多研究固有地无法重复,是因癌变通常不沿着同一进化路径发展。
目前,可重复性仍然是肿瘤生物学研究的核心原则。该原则假设了肿瘤的趋同进化,并认为肿瘤在其中会经历相对明确的遗传变化。于是,在基础研究中,我们发现了遗传上的一些改变,然后就研发靶向这些改变的治疗策略(即靶向治疗)。然而,基础遗传结构的持续演变使得突变成为了“移动的目标”,无论是在个体之间还是个体内部。从这个角度上讲,基因靶向治疗违背了进化的原则。
不进化或缓慢演化的性状可能是更好的目标。耐药性的演变确实也仍是癌症靶向治疗的主要障碍。主要的3种单克隆抗体药物贝伐单抗,曲妥珠单抗和利妥昔单抗的疗效具有指导意义。贝伐单抗和曲妥珠单抗分别靶向VEGF和HER-2,然而疗效有限。相反,利妥昔单抗是靶向在pre-B细胞表面都表达的CD20,能显著提高B细胞淋巴瘤患者的生存期。这也许是因为它不以细胞进化的产物作为靶点。近期的靶向基础转录装置的治疗策略,与这种支持以非变动分子作为靶标的看法是相一致的。
最后,尽管许多疾病从达尔文式医学的角度来看,都是进化的产物或副产物,但肿瘤的发生是不同的,因为它并不仅仅是进化的产物:它就是进化过程本身,或者说是进化正在进行的表现。Lewontin指出,进化的精髓就是其多样性。值得探讨的正是这种多样性,而非某个标准型。对于肿瘤研究,进化路径的多样性也有显著的临床意义。H. J. Muller在《物种起源》出版一百周年时,评论说生物学已经很长时间没有进化思维了。如今五十年又过去了,Muller的评论对肿瘤研究依旧不显过时。
版权声明:
英文原文2018年2月发表于《国家科学评论》(National Science Review, NSR),原标题为“On the low reproducibility of cancer studies?”。NSR是科学出版社旗下期刊,与牛津大学出版社联合出版。《知识分子》获NSR和牛津大学出版社授权刊发该文中文翻译。

▼▼▼点击此处,直达本文原文。
话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。




 京公网安备 11010502034662号
京公网安备 11010502034662号 