阅读:0
听报道
撰文 | 邸利会 责编 | 李晓明
最近一拥而上、多达200项的新冠病毒肺炎临床试验,让一些学者坐立难安。
北京、上海、广州、南京、西安科研机构的多位卫生统计学与流行病学专家,对当下的新冠病毒肺炎的临床试验提出了批评和建议。他们的文章《关于科学、规范、有序地开展新型冠状病毒肺炎相关临床试验的建议》(以下简称 “建议”)近日发表在新一期的《中华流行病学杂志》上。
本刊2月10日曾就此发表《疫情吃紧,40余项临床试验一股脑上马为哪般?》,没想到,短短十几天,新冠肺炎的临床试验已经由几十项飙升到200项。
一下子上如此多的临床,除了给前线救治增加负担外,一个基本的问题是,去哪找那么多合适的病人?如果病人样本量明显不够,又怎么能获得扎实可靠的结论?

遗憾的是,从几位专家的分析看,如果放任下去,新冠临床试验 “一地鸡毛” 的尴尬结局似乎不可避免。
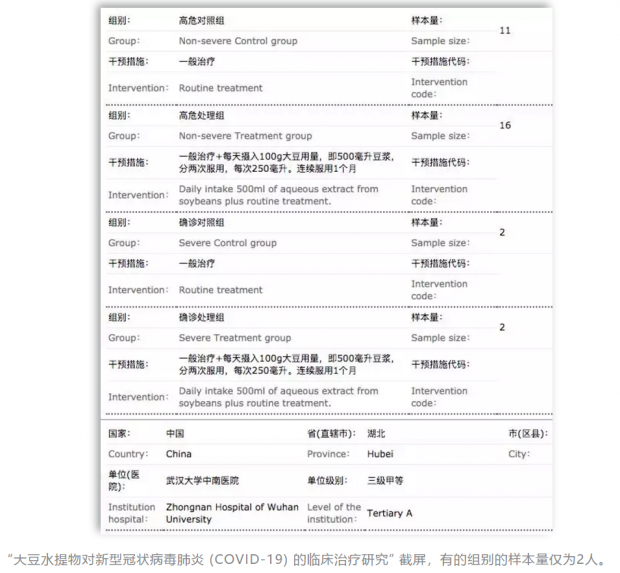
01 病人样本不足,结论不可靠
此番注册的临床试验,除了有限的诊断性和观察性研究外,大部分是治疗性的临床试验,达到了139项。那么,理论上开展这么多临床,需要多少病人呢?
几位作者分析指出,如果临床试验以轻症患者作为研究对象,治愈率提升5个百分点(从目前的90%提升至95%),则每项试验需要近1000例病患参与;如果考察重症转化率降低5%(目前湖北地区重症不超过20%),同样需要800~1000例患者参与。
那么,如果研究重症患者的病死率,需要多少病人呢?几位作者指出,“根据目前资料看,初诊为重症的患者病死率为6%,如果试验药物能将病死率降低50%,理论上则每项试验至少需要800例重症患者参与”。
照此,以目前注册的139项计,保守算下来,假如每项要求800例患者参与,总的参与病人需要10万以上。可昨日(2月25日)的全国现存确诊人数,仅有4.7万多人,根本就不够用。
事实上,专家发现,一些临床试验的 “样本量明显不够,可能因把握度不足而难以获得预期结论”。
本刊查阅后发现,部分临床研究的样本量只有几十例,有的甚至才几例。而随着全国的疫情得到部分控制,确诊的人数正逐步下降,截止到2月25日下午5点,15个省地区直辖市的确诊病例不到50例,除了湖北、广东、浙江、山东,其余的确诊病例均在300例以下。照此推论,有的省恐怕一个临床试验都不够做。
而从目前一些发表的临床研究看,因为样本量的不足,恐怕也很难得出什么确定性的结论。
比如,天津中医药大学张伯礼等人最近发表了《中西医结合治疗新型冠状病毒肺炎34例临床研究》,对湖北省中西医结合医院出院的52例新型冠状病毒肺炎患者,分为中西医结合治疗组(34例)和西医组(18例)进行了研究,结论是中西医结合治疗新型冠状病毒肺炎能显著减轻患者的临床症状。
此外,上海市公共卫生临床中心感染与免疫科的卢洪洲等人,最近也发表了“洛匹那韦利托那韦和阿比多尔用于治疗新型冠状病毒肺炎的有效性研究”,对134例患者进行了分组研究,认为 “这项研究没有发现洛匹那韦/利托那韦和阿比多尔对缓解症状或加速病毒清除有任何作用。”
苏州偶领生物医药有限公司总经理谢雨礼告诉《知识分子》,“我个人对小样本临床试验的结果是存疑的,无论正反结果。对于正面结果,如果没有充分的证据链,包括临床前的研究,基本不太相信。”
不仅是样本的问题,本刊查询后发现,不少的临床试验设计,也没有坚持随机、对照,很多没有使用盲法评价。
前述研究者指出,临床试验如果没有高质量的设计,“如样本量不足,对照组的选择不合理,分组的随机化与遮蔽执行不严格,疗效指标的评价标准不客观,加之数据的完整性、真实性保障不充分,那么这些临床研究就难以提供高质量的有效性和安全性证据,使得首试患者、研究者和管理部门的努力付诸东流。”
02 不该上的临床也上
目前,多达200项的有关新冠肺炎的临床试验,涉及的药物和疗法五花八门,包括抗艾滋病的药物,治感冒、流感的药,干扰素、糖皮质激素,各种中药、中药注射剂、脐带血、干细胞等等。在一些病毒学家和药学家看来,显然并不是这些药都值得一试。
“一般来说,如果有一种药物在体外试验中证明对冠状病毒有效,特别是对新型冠状病毒有效,在细胞层面上能抑制病毒的复制,或是在病毒感染的动物试验中证明有效,且该药物已经是上市的药,不管之前用来治其他疾病的,就有很充足的理由进入临床试验。” 亚利桑那大学药学院助理教授王俊告诉《知识分子》。
“既然是已经上市的药物,就证明安全性是有一定保障的,或者说有大量的临床数据可供参考,意味着这个药服多大剂量,服多长时间,它会带来什么样的副作用,这个是有据可依的。” 王俊补充说道。
此前,喧嚣一时的双黄连被爆出只是在1月29日晚到30日晨,由上海药物所做了一个简单的细胞水平的抗病毒活性测试,并未发表详细的试验研究数据。不过,这并不妨碍双黄连被用于新冠的临床试验研究。
本刊在中国临床试验注册中心网站检索后发现,由华中科技大学同济医学院附属同济医院主持的400例确诊病人参与的 “双黄连口服液治疗新型冠状病毒肺炎(COVID-19)有效性和安全性的随机、开放、平行对照、多中心临床试验 ” 正在进行,在盲法部分写着“开放”,意即所有各方包括病人自己都清楚吃的是什么。
对于当前几十种中医药的临床试验(包括中药注射剂),美国德克萨斯州立大学圣安东尼奥医学中心教授项焰也对本刊表示,“中医药成分不清,我个人觉得纯粹是浪费时间甚至有害无利。”
值得注意的是,新冠肺炎的轻症患者本身有一定自愈性,较多用于这类患者的中医药究竟起了多大作用,也需要严格的试验证明。
王俊向《知识分子》表示,“中药我不做评论,就是说,我不清楚它的逻辑在哪里,依据在哪。其实另外一些药上临床的逻辑我也压根不明白。”
他进一步解释道,“因为我本身是研究流感的,我很清楚,从分子机理来讲,阿比多尔(arbidol)和奥司他韦(oseltamivir)所作用的病毒蛋白,只在流感病毒上存在,相同的蛋白在新型冠状病毒上是不存在的。就是说,从理论上讲,没有任何理由相信阿比多尔和奥司他韦能对新冠状病毒有效,并且到目前为止,没有任何公开发表的试验数据证明它们对新型冠状病毒还有非典病毒和中东呼吸综合症病毒的复制具有抑制作用。所以,我不清楚这里面的逻辑,为什么要用这些药物来作为候选药物进行新型冠状病毒的临床研究。”
之前被媒体争相报道的李兰娟院士的重大成果——找到很有效的抗病毒的药物阿比朵尔(arbidol)和达芦那韦 (Darunavir),所做的其实不过是体外试验,且阿比朵尔的有效浓度是10~30个微摩尔,达芦那韦是300微摩尔浓度。这种体外上千倍浓度的药量根本不可能用到体内,有专家甚至评论,可能得吃上万片药才能在体内达到这个浓度,副作用将远远超出药效。
不过,本刊从中国临床试验注册中心查到,目前有关阿比多尔的新冠临床研究已经有4项,且阿比多尔已经写入了最新的《新型冠状病毒肺炎诊疗方案(试行第六版)》。对此,王俊表示,“不清楚为什么会加入阿比多尔,(目前)没有试验数据表明阿比多尔对新型冠状病毒有效”。
03 该上的试验被挤占资源
值得警惕的是,正是很多没有什么逻辑的药物纷纷加入了新冠治疗的临床试验,本该有希望的药物却可能因为缺乏病人等原因,难以达到理想的预期结果。
在2月24日晚世界卫生组织-中国冠状病毒病联合专家考察组召开的新闻发布会中,世卫组织代表布鲁斯·艾尔沃德(Bruce Aylward)博士的一番话颇耐人寻味。
他谈到,在武汉考察时碰到了一位名叫曹彬的研究人员,是负责抗病毒药物开发的。他问曹彬,研发抗病毒药物过程中最大的挑战是什么?曹彬回答说,现在是招募病人,因为病人数目在下降。
这固然是值得庆祝的消息,但随后在向全球提出的最后一点建议中,这位世卫组织代表提到其它的试验研究挤占了本该有希望的研究,比如曹彬正在领衔开展的瑞德西韦的临床研究——
“这一段争取来的宝贵时间要用好,尽管我们列出了很长的研究清单,但也强调研究项目应该有优先次重,以便快速地掌握知识以进一步阻断病毒传播,进一步降低重症率及病死率。我们认为瑞德西韦可能有预期效力。比如我见到研究人员曹彬说现在招募病人变难了,不仅是因为病例减少了,而是同时还在开展其他试验研究,而这些并未见得有多么大的希望。所以我们需要开始优先那些可能帮助我们更快挽救生命的研究项目。这不是中国独有的问题,也是全球的问题。”
布鲁斯·艾尔沃德还强调,“我们认为,目前只有一种药可能真正有效,这就是瑞德西韦”。

瑞德西韦临床试验由中日友好医院、中国医学科学院药物研究所牵头,将在武汉金银潭医院等多家医院中进行,拟入组761例患者,采用随机、双盲、安慰剂对照方法展开,而曹彬是负责人。
瑞德西韦是美国吉利德公司的在研药物,研究发现,瑞德西韦对非典病毒(SARS)和中东呼吸综合征病毒(MERS)有很好的抑制效果,不仅有细胞水平的试验结果,而且还有动物模型的试验结果,且都有科研论文数据支持。
而在本刊此前的访谈中,王俊也将瑞德西韦列为排名第一的最有希望的候选药物。2月25日上午,国务院应对新型冠状病毒感染肺炎疫情联防联控机制举行新闻发布会上,国家知识产权局副局长何志敏介绍说,瑞德西韦要到4月27日才能公布临床试验的结果。蜂拥而上的其它临床试验是否会对瑞德西韦的临床试验的结果造成影响,尚未可知。
04 临床试验严谨性不应妥协
那么,针对新冠病毒的临床试验究竟应该如何做?在当下疫情紧迫的情况下,是不是可以在样本量和试验设计上作些让步,无需做严谨、操作上困难的临床试验设计? “建议” 一文的作者认为,这种想法的初衷也许是好的,但后果往往是得不出可靠的结论,也就是对患者不负责任。
“SARS时期我们有了足够的教训,不能再犯这类错误。治疗无效不等于没有副作用,尤其是在这个时候,不允许将无效药物的风险转嫁给患者。” 作者在论文中写道。
王俊告诉《知识分子》,从规则和程序上,平常可能需要很长的时间才能通过各层的审批,但这是一个新发传染病,来的比较猛烈,可能会有加快审批的一个程序,但是这并不代表它的相关的审查标准会降低。
“因为不管是什么药物,最终药物要给到病人,肯定要保证安全性和有效性,并且有效性还是其次,最重要的是要有安全性,如果给大批量的患者服用这个药,你一定要有试验数据或者临床试验结果表明这个药物在人体内是不会有很强的毒副作用,或者不会留下很大的后遗症的。” 他表示。
而最近一些新冠候选药物的副作用也引发了业内人士的关注。
一些专业人士注意到,在第六版诊疗方案的磷酸氯喹治疗方案中,存在氯喹剂量过大,用药周期过长的问题。如果按照现行方案用药很可能导致大规模药害,甚至有患者猝死的情况发生。磷酸氯喹的临床药代动力学报道说明,其口服半衰期长达5~60天,半衰期中位数在21~30天,氯喹临床致死量在2~4克,若按第六版方案完成0.5克/次,一天两次,用药10天疗程,患者体内存留的氯喹势必超过致死量的两倍以上。

而中国临床试验注册中心网站上,以 “磷酸氯喹” 为注册题目检索,可见12项临床试验,这些临床试验的用药剂量安全性值得关注。
此外,国家药监监督管理局连续多年发布国家药品不良反应监测年度报告,一些中药制剂以及中药注射剂屡屡上榜,如双黄连、痰热清注射液、热毒宁注射液等等。由于缺乏循证医学研究证据,许多中成药说明书上不良反应一项均写着 “尚不明确”,如何在临床试验中避免用药的风险性值得重视。
鉴于当下 “一哄而上” 的临床研究可能导致的种种问题,“建议”一文的作者们发出了六条呼吁——
研究者需要自律,严谨科学地设计临床试验,避免利益冲突。越是在困难的时候越是要坚守循证医学的底线,一切为患者康复着想,一切为了让疫情得到有效的防控出发。
临床试验必须经过研发单位正常的伦理审查,如果在异地开展临床试验,其方案必须经异地的卫生行政部门审核备案,异地卫生行政部门有监督实施的义务与权力。
临床试验设计必须坚持随机、对照、重复的基本原则,尽量采用客观指标,尽可能使用盲法评价,并遵循临床试验统计学指导原则,避免仓促分析导致错误结论。
在临床试验没有结束时,课题组不应该发布未经审核的研究结果,一是避免对研究结果的解释引入偏倚,二是避免媒体过度炒作影响公众对研究的期待。
此时更需要国家与地方行政部门加强管理,相关政府管理部门应该科学、规范、有序地组织此类研究,呼吁有关部门应该实地现场检查、督导与调研。
治疗新型冠状病毒肺炎药物的疗效应该由权威部门发布,建议媒体谨慎报道基于个案的、缺乏对照的药物疗效。研究者向公众宣称自己的治疗效果时,应同时公布有关研究的设计和相关数据,接受科学界与公众监督。
这些呼吁是否会引起重视并在当下的临床试验中践行,唯有拭目以待。

话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。




 京公网安备 11010502034662号
京公网安备 11010502034662号 