阅读:0
听报道
图源:
撰文 | 计永胜
责编 | 何义均 戴 威
中枢神经系统(CNS)包括脑和脊髓,是机体的 “指挥中心”,保证了各器官的协调活动。然而,它的损伤多是不可逆的,常伴随神经功能的永久丧失。
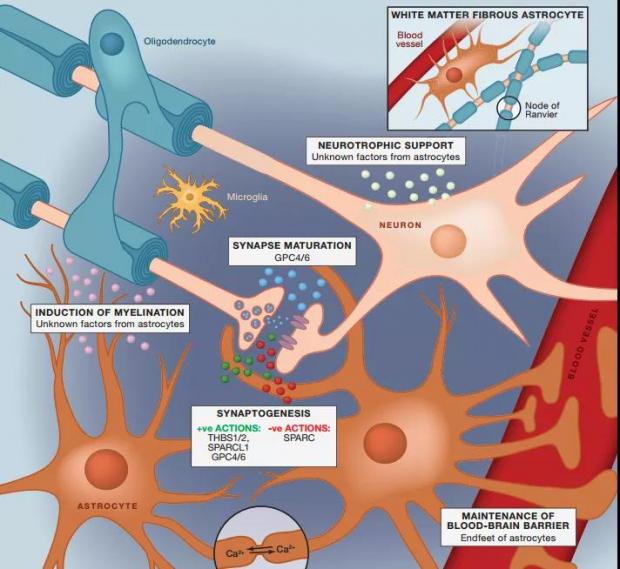
图1. 中枢神经系统(脑)中各种细胞的功能。(左上为少突胶质细胞,图源:参考文献[1])
近日,瑞典卡罗林斯卡医学院(Karolinska Institutet)细胞和分子生物学系教授乔纳斯·弗里森(Jonas Frisén)团队称,他们发现了一种脊髓修复的办法:在中枢神经系统中,一种叫作室管膜细胞的细胞,可以分化为少突胶质细胞,提升神经细胞的信号传导能力,有助于小鼠脊髓损伤的修复 [2]。
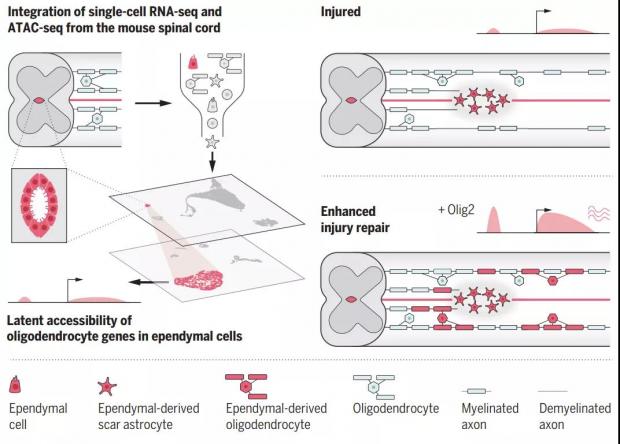
图2. 室管膜细胞向少突胶质细胞分化有助于脊髓损伤修复(图源:参考文献[2])
“我们的研究表明可以通过影响神经系统的干细胞,让它们在神经损伤修复中发挥更多的作用。” 文章通讯作者弗里森表示 [3],“虽然我们的研究还停留在小鼠水平,暂时没有向人类疾病方向发展,但可喜的实验结果还是为刺激受损神经系统的修复提供了新的策略。”
中枢神经系统受损,其修复需要多种细胞的参与。其中,室管膜细胞虽有干细胞潜能,但以往认为它修复神经系统的能力比较有限。在中枢神经系统受损后,室管膜细胞会被激活,主要分化为星形胶质细胞,形成疤痕,以保证神经组织的完整性。但是,这种 “单向” 分化不能使少突胶质细胞的数量得到补充,严重降低了中枢神经系统的修复效果。
在本次研究中,研究团队能发现了室管膜细胞的潜在能力,这要先归功于大量测序工作。
科研人员首先对1100个多种神经细胞进行了单细胞测序,分析其基因表达的调控序列。出乎意料的是,本来只存在于少突胶质细胞前体细胞的转录因子—— OLIG2(少突胶质细胞转录因子2)和SOX10(少突胶质细胞的主要分子标记物)—— 的调控序列在室管膜细胞中也存在。
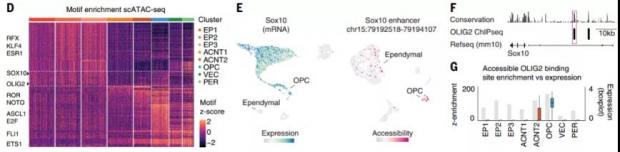
图3. 少突胶质细胞前体细胞和室管膜细胞在基因调控基序上有重叠(图D)。(图源:参考文献[2])
这使研究人员不得不怀疑,虽然 OLIG2 和 SOX10 只在少突胶质细胞中表达,并不在室管膜细胞表达 [4],但鉴于调控序列的存在,后者是否有分化为少突胶质细胞的可能呢?
为了检验这一猜测,研究团队在转基因小鼠身上做了脊髓修复实验。他们培养了一种让室管膜细胞特异表达 OLIG2 的小鼠,并检测脊髓损伤发生后小鼠室管膜细胞的分化情况。结果显示,在脊髓背部出现切口损伤后的1天和5天时,小鼠的室管膜细胞的分化潜能被激活,也倾向于向少突胶质细胞分化。
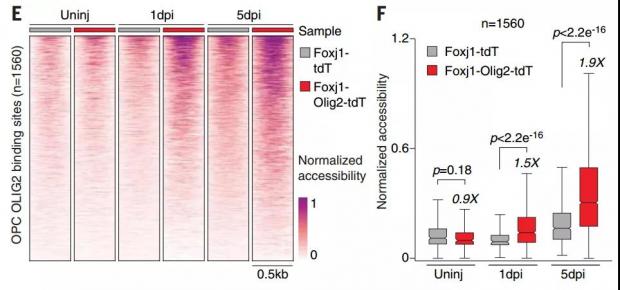
图4. 表达OLIG2的室管膜细胞在脊髓损伤后向少突胶质细胞分化的潜能被激活。(图源:参考文献[2])
不过,转基因小鼠的 “特异表达” 人为改变了室管膜细胞原有的分化轨迹。而这样真能分化出正常的、有脊髓修复能力的少突胶质细胞吗?
还真能。研究人员惊奇地发现,小鼠在发生脊髓损伤后,室管膜细胞发生增殖,并向损伤部位聚集。表达 OLIG2 的室管膜细胞不但能够形成星形胶质细胞疤痕,还能形成少突胶质细胞。研究人员将这群细胞命名为室管膜细胞源性少突胶质细胞系(epOLs)。他们发现,损伤4周后,epOLs 占到了整个室管膜细胞增殖子代的30%之多,并且 epOLs 转化并不影响星形胶质细胞的产生。
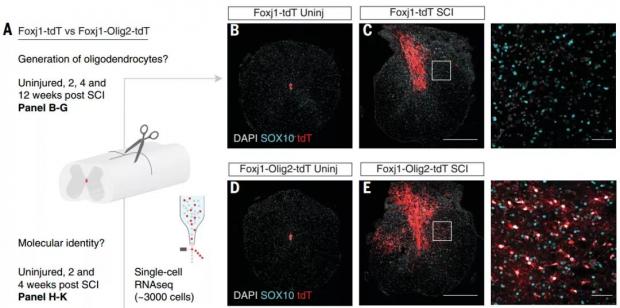
图5. 脊髓损伤后,表达OLIG2的室管膜细胞转化为epOLs。(图源:参考文献[2])
并且,在脊髓受损后3个月,epOLs 可以合成髓鞘质包裹轴突形成髓鞘,而髓鞘在神经功能的维持中起极其重要的作用。
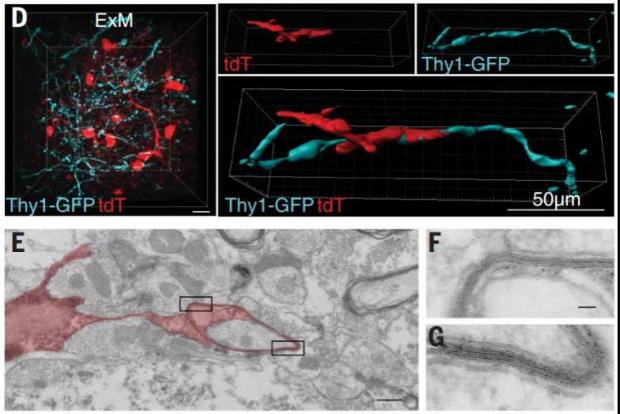
图6. epOLs可以使轴突重新被髓鞘包绕。(图源:参考文献[4])
除了背侧切口,该研究还涉及了胸部挫伤(thoracic contusion)这种与临床实际更接近的损伤模型。结果显示,相比于脊髓背侧切口模型,胸部挫伤模型的脊髓受损区域更广,12周后,epOLs 产生的数量也更多,并且 epOLs 有效改善了轴突的传导性能。也就是说,室管膜细胞 “逆天” 分化出的少突胶质细胞,对中枢神经系统功能真有修复作用。
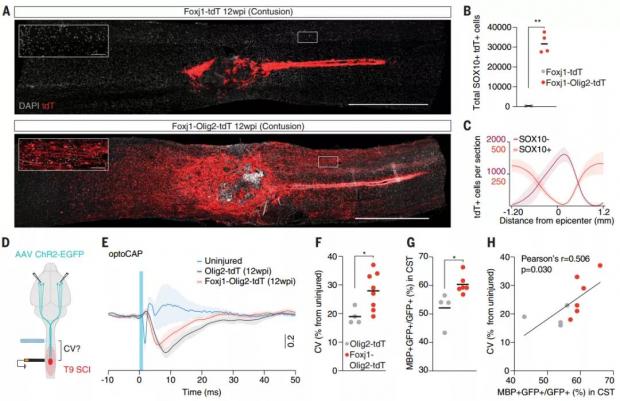
图7. epOLs可以改善轴突的传导性能。(图源:参考文献[2])
“此项研究通过改变室管膜细胞的基因表达,激发了室管膜细胞 ‘隐藏’ 的分化潜能,使其向少突胶质细胞转化。这更加丰富了我们对神经干细胞功能的认识。” 中国科学技术大学附属第一医院神经内科特任研究员张艳告诉《知识分子》,“epOLs 有助于脊髓损伤的修复令人振奋。这说明神经干细胞可以作为一个细胞库,为中枢神经损伤病人提供神经支持细胞和功能修复细胞。”
参考文献
[1] Shane Liddelow and Ben Barres. SnapShot: Astrocytes in Health and Disease. Cell 162, August 27, 2015 DOI
[2] Enric Llorens-Bobadilla, James M. Chell, Pierre Le Merre, et al,. A latent lineage potential in resident neural stem cells enables spinal cord repair. Science 02 Oct 2020:
Vol. 370, Issue 6512, eabb8795.
[3]
[4] Q. R. Lu et al., Common developmental requirement for Olig function indicates a motor neuron/oligodendrocyte connection. Cell 109, 75–86 (2002). doi: 10.1016/S0092-8674 (02)00678-5;
话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。




 京公网安备 11010502034662号
京公网安备 11010502034662号 