阅读:0
听报道
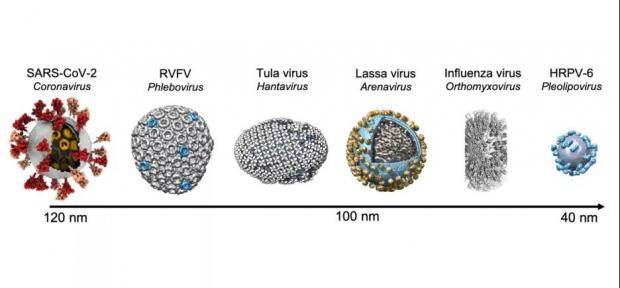
使用冷冻电镜断层成像和子断层图像平均法解析的囊膜病毒比较。图源:李赛团队
引 言
近期,清华大学李赛团队利用冷冻电镜解析了新冠病毒结构,为人们理解新冠病毒提供了直观的认识。在下面的这篇文章中,李赛不仅介绍了新冠病毒的结构研究,还解读了新冠病毒所属的囊膜病毒的结构研究。
囊膜病毒指外围有脂质双层膜包裹的病毒,我们经常听到的天花、乙肝、丙肝、艾滋、狂犬、新冠、寨卡等病毒,均是囊膜病毒。与无囊膜病毒相比,囊膜病毒可谓长相随机,千毒千面,给试图看清它们的科学家带来了极大的挑战。
撰文丨李 赛
责编丨戴 威
人类的发展史,也是一部和各种瘟疫斗争的生存史。瘟疫的罪魁祸首里,既有引发鼠疫、霍乱、结核病、伤寒等瘟疫的细菌,也有引发天花、流感、麻疹、艾滋等大流行病的囊膜病毒(enveloped virus)。生活在一个科技高速发展的时代,每当我们以为人类已经克服了以上多数病原体的时候,总有新的麻烦出现。
回顾过去短短20年,全球便经历了新冠、SARS、MERS、非洲猪瘟、埃博拉、寨卡病毒等多种新发型囊膜病毒所引发的疫情。这些病毒的出现,不仅给全球人类健康带来巨大危险,给全球经济造成巨大损失,也在潜移默化的改变我们的生活方式。这些经历,让我们对大自然始终保持畏惧,也对囊膜病毒本身产生了极大的好奇。
无囊膜病毒与囊膜病毒的区别是什么?囊膜病毒的组装有哪些类型?千面的囊膜病毒到底长什么样?今年的诺贝尔生理学或医学奖颁给了丙肝病毒的发现者,这次疫情,也将全球目光再一次聚焦到冠状病毒所属的囊膜病毒上。作为一名病毒学家,笔者和同事在今年解析了属于囊膜病毒的新冠病毒的结构。借此机会,笔者尝试就囊状病毒的结构与冷冻电镜技术的发展等问题分享自己的思考。
01 “千毒一面” 与 “千毒千面”
无囊膜病毒
无囊膜病毒(nonenveloped virus)没有囊膜,直接由蛋白质外壳包裹。这类病毒的范畴比较广,从动物病毒、噬菌体、到水生病毒等都有。对人类健康及经济生产威胁较大的有同属微小病毒科的脊髓灰质炎病毒、肠道病毒及口蹄疫病毒等。
在结构上,大多数无囊膜病毒就像一个模子刻出来的一样。呈正二十面体组装的病毒是它们的代表。这些直径100 nm左右的超大分子复合物,由于高度的对称性、结构的全同性及尺寸恰好在电子显微镜的透射范围内等特征,为结构解析工作带来了极大的便利,是冷冻电镜方法开发历程中的三大标准生物样品之一(另两种:脱铁蛋白,核糖体)。
因此可以说,冷冻电镜断层成像技术(cryo-Electron Tomography, cryo-ET)的开发几乎是伴随着对无囊膜病毒结构的解析与组装机制的深度解读一起成长的。目前使用冷冻电镜解析常规尺寸的正二十面体病毒方法非常成熟:由于其表面拷贝数非常高的衣壳蛋白以严格的对称性分布,无需大量数据便可通过三维图像重构获得近原子分辨率。这个经典应用也为探索更复杂的病原体(包括大量非球形或非对称性的病毒体)提供了坚实的基础。

(左)正二十面体组装的水呼肠病毒,彼此之间几乎全同 图源:[4];而(右)以新冠病毒为代表的囊膜病毒,千毒千面,几乎没有两颗一样的病毒颗粒 图源:[1]
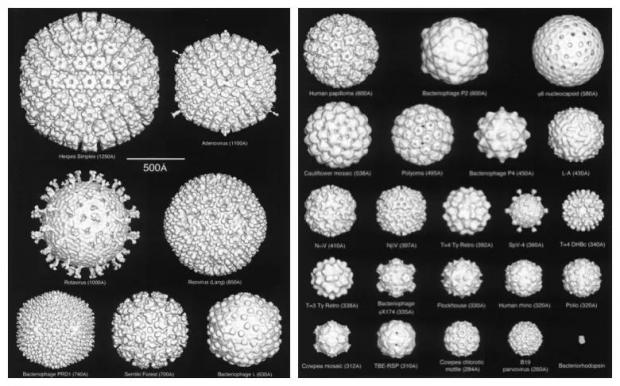
著名的病毒结构生物学家Stephen Fuller和Timothy Baker比较了早期冷冻电镜解析的正二十面体型病毒的结构 图源:[5]
囊膜病毒
包括新冠病毒在内的囊膜病毒则多是动物病毒,它们可以说是现代人类面临的最具威胁的病原体。囊膜病毒的大家庭里,既有迫害人类多年,恶名昭彰的 “老大哥” 们:比如天花、流感、乙肝、丙肝、麻疹、艾滋、登革、狂犬病毒等;也有近几十年才引起关注或被发现的 “小鲜肉”们:比如新冠、拉沙、埃博拉、寨卡、裂谷热病毒等。这些病毒里,除了寨卡和登革病毒具有较为严格的正二十面体对称外,其余的长相均较为随机。
这种随机性与囊膜病毒的组装和生命周期特点息息相关。它们由脂双层包裹,借助外镶的刺突状糖蛋白与受体结合并进入细胞。接着,利用I、II或III型膜融合蛋白介导膜融合、解胞并释放核酸,绑架细胞的生命活动实现自我复制,最后组装成新的病毒并从细胞出芽。可见,囊膜病毒通过蛋白介导膜融合,通过膜融合去组装并释放核酸,通过出芽 “掳走” 细胞膜以成为新病毒的囊膜。
除了上述的刺突蛋白及脂双层外,囊膜病毒一般还有基质蛋白(负责病毒组装)、核蛋白(负责收纳组织核酸),负链RNA病毒的结构蛋白里还有聚合酶。此外,不少囊膜病毒还有通道蛋白,例如新冠病毒,流感病毒等。
由于脂双层参与病毒组装,这类病毒几乎千毒千面,没有两个完全一样的病毒。看清囊膜病毒的全病毒分子结构,其蛋白的分布及构象转变,甚至是宿主体内的病毒半组装结构,对我们理解囊膜病毒如何攻下细胞这座城堡至关重要。这也会启发我们找到病毒的弱点,为我们设计中和抗体和疫苗去击溃这些病毒提供更加巧妙的策略。
然而针对囊膜病毒的结构工作,目前仍主要通过晶体学或单颗粒法解析在体外重组蛋白的结构。而冷冻电镜在组装柔性、不对称、不具全同性的囊膜病毒及其他类似大分子复合物的三维结构和功能研究中发挥着不可替代的作用。
由于囊膜病毒的长相随机,很难通过传统结构生物学方法解析,因此全病毒结构及其在生命周期中重要状态的高分辨结构,一直是结构生物学的挑战。使用冷冻电镜断层成像方法拍摄样品的三维图像,并结合子断层图像平均法(STA)对病毒上的蛋白子断层图像进行对齐平均运算,再通过投射回三维空间的手段,为解析囊膜病毒全病毒结构及细胞内的病毒结构带来可能。
02 从囊膜病毒组装模型看结构研究发展
随着显微技术及结构生物学的发展,结构病毒学家们看到的更多更清楚,也引出了越来越多的生物学研究兴趣。他们不再满足于仅仅解析体外表达的病毒蛋白,或正二十面体类全同病毒的衣壳时,而将目光更多的转向对人类威胁更大、变异更快、非定型不全同的囊膜病毒。
它们看似随机的组装有规律吗?结构蛋白的拷贝数是固定的吗?蛋白与核酸之间的互相作用是怎样的?从外表到内部,从局部到全局…… 结构病毒学的研究人员正在接受着越来越多新的挑战。下面我们围绕囊膜病毒的九种组装模型,看看囊膜病毒结构研究的发展。
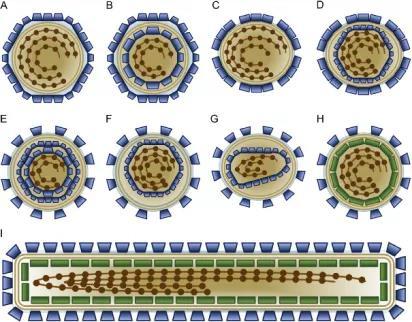
九种组装类型的囊膜病毒示意图 图源:[6]
具有二十面体对称衣壳的囊膜病毒颗粒
最早被解析的囊膜病毒是有正二十面体对称特征的。这类病毒,例如裂谷热病毒、登革病毒等,均具有II类膜融合蛋白,这些蛋白结构高度保守并呈多种多聚形式。它们没有基质蛋白,取而代之利用糖蛋白组装成衣壳。
1995年德国海德堡欧洲分子生物学实验室 Stephen Fuller 等通过单颗粒平均法(SPA)解析了 Semliki 森林病毒(SFV,披膜病毒科)结构 [7]。该病毒主要通过蚊虫叮咬传播,在啮齿动物中引起致命的脑炎,在人类中通常只有轻度的症状。它具有二十面体蛋白外壳、脂质双层膜以及二十面体对称的核衣壳。在当时有限的分辨率下,只能看到病毒的轮廓。
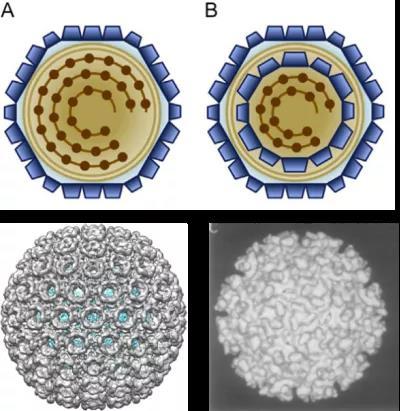
第一类囊膜病毒:由糖蛋白组装成正二十面体外壳,包括单层壳的RVFV和双正二十面体壳的SFV 图源:[8,9]
同样具有二十面体外壳和脂双层膜、但没有二十面体核衣壳的另一类病毒,也在早期就被解析出来。引起发病率和死亡率很高的登革出血热和登革休克综合征的登革热病毒(DENV,黄病毒科),于2002年被美国普渡大学 Richard J Kuhn 等人确定了24 Å分辨率的结构 [10],这是解析的第一个黄病毒结构。2013年,直接电子检测器(DED)的出现以及电子显微镜硬件和图像处理软件方面的进步,催生了冷冻电镜的 “分辨率革命”,使得近原子分辨率成为可能。而在 cryo-EM 的 “分辨率革命”之前,UCLA 的周正洪教授团队就通过CCD相机获得了3.5 Å分辨率的成熟登革热病毒结构 [11]。
常在非洲与阿拉伯地区爆发的裂谷热病毒(RVFV,白蛉热病毒属),和DENV具有相似结构,由于其表面糖蛋白的柔韧性,早期基于单颗粒冷冻电镜重建的三维结构仅限于20Å左右的分辨率。直到2018年,我与牛津大学 Steinar Halldorsson 等同事通过采取改进样品制备策略、局部重建等手段获得了8-13Å的RVFV病毒结构,并阐明了其融合机制 [12]。
仅囊膜内具有二十面体蛋白壳层的病毒
除了上述两种在囊膜外侧具有二十面体对称蛋白外壳的病毒外,还有一类病毒的外囊膜包被着一层或多层二十面体对称蛋白或核衣壳:包括乙型肝炎病毒HBV [13]、疱疹病毒科(如HSV-1 [14]),以及19年饶子和团队解析的非洲猪瘟病毒ASFV [15]。
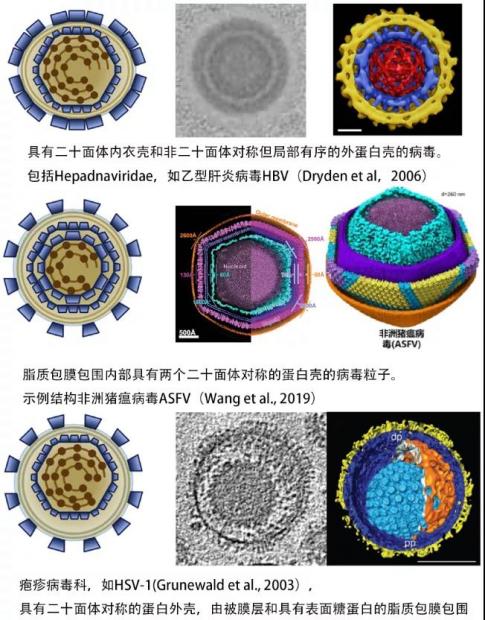
第二类囊膜病毒:外囊膜包被着一层或多层正二十面体对称蛋白衣壳 图源:[6];Dryden et al., 2006; Wang et al., 2019; Grunewald et al., 2003.
非二十面体对称囊膜病毒及其糖蛋白
分辨率革命之后,以单颗粒方法解析正二十面体对称蛋白壳的结构已近成为常规。但蛋白外壳具有二十面体对称性的囊膜病毒毕竟仅是少数,大部分囊膜病毒因为构象差异较大,无法通过单颗粒法获得完整结构。这给高分辨率冷冻电镜结构解析带来了挑战。而高分辨冷冻电镜断层成像(cryo-ET),因原始数据带有精确的Z轴信息,结合使用子断层图像平均法(STA),已被证明具备获得近原子分辨率的能力。由于其在囊膜病毒原位结构方面独特的优势,被越来越多地用于研究病毒粒子的整体超微结构。
拥有I型膜融合蛋白的病毒是囊膜病毒中被研究最多、最具代表性,也对现代人类健康最具威胁。HIV与流感病毒汇聚了病毒研究领域的大多数资源,近20年反复爆发的冠状病毒、埃博拉病毒等也在快速吸引科研投入。此类病毒表面的糖蛋白呈三聚体并随机分布,膜附近的基质蛋白为病毒提供组装。
从1981年美国确认了首例艾滋病感染者到2018年,全球已有3200万人死于艾滋病。人类对于HIV病毒的基础研究从未止步,针对HIV病毒结构的认识也在越来越精细,但目前针对HIV病毒的有效疫苗仍然缺乏。HIV由外囊膜及其包围的含病毒基因组的核衣壳组成。2008年刘骏等人利用冷冻电镜断层成像法揭示了HIV的糖蛋白在病毒表面的原位结构及其与抗体的复合物结构 [16], 2013年章佩君团队揭示了成熟HIV圆锥形衣壳上的衣壳蛋白CA排列成六聚体和五聚体的精细结构 [17]。
在非洲地区频繁爆发的拉沙病毒(LASV, 沙粒病毒科),属于生物安全四级(BSL-4)的急性出血热病毒,致死率可达20%。2016年,我和同事就对灭活的拉沙病毒进行了病毒及其糖蛋白的首次三维重构,揭示了糖蛋白14Å分辨率的原位结构,并通过构建病毒样颗粒(VLP)揭示了拉沙病毒糖蛋白在酸性环境下的构象变化过程,与细胞内受体LAMP1的复合物结构,并从结构上解释了为何糖蛋白只有在低pH下才会与LAMP1结合 [18]。2017年,Scripps 研究所 Erica Sapphire 研究员从非洲疫情爆发区拉沙热生还者血液中获得中和性抗体,并解出糖蛋白胞外区三聚体与抗体复合物的晶体结构,验证了我的研究中早期电镜结构的真实性 [19]。
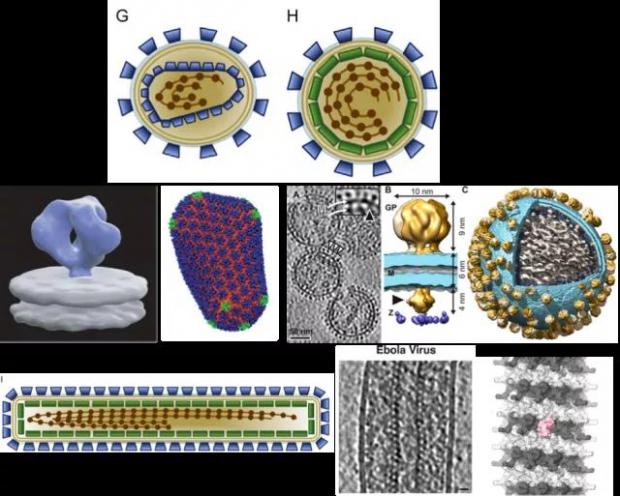
第三类囊膜病毒:具有I型膜融合蛋白,糖蛋白随机分布,有基质蛋白 图源:[6,18]
今年肆虐全球的新冠病毒,由我们清华大学团队使用 cryo-ET,将浙江大学李兰娟团队提供的灭活病毒解析至最高7.8Å分辨率,并重构出一颗有代表性的新冠病毒全病毒分子结构 [1]。我们不仅展示了病毒表面刺突蛋白(spike)的结构、分布及其糖基化组分,还挺进 “深核”,解析出病毒腔内的核糖核蛋白(RNP)的结构与排列规律,为其超长基因组在病毒体内的分布提供了高分辨率信息,绘制了独一无二的新冠病毒全身 “通缉照”。
2020年8月至9月间,《细胞》(Cell)、《科学》(Science)、《自然》(Nature)分别报道了我们团队 [1]、德国马克思·普朗克生物物理所 Martin Beck 团队 [2]、以及英国剑桥 MRC-LMB 的 John Briggs 团队 [3] 三篇分别利用冷冻电镜断层成像技术解析新冠病毒原位结构的研究论文。
冠状病毒本身非常有特点,拥有多个囊膜病毒之最:已知最大的糖蛋白(三聚体分子量超过600kD),RNA病毒中最长的RNA(30kb)。我们的工作发现,新冠病毒糖蛋白拷贝数稀少(~30个);在囊膜表面拥有极大的自由,可绕茎部旋转甚至可在囊膜上游走;非常脆弱,部分亚基甚至整根糖蛋白会发生脱落。通过对来自天然S蛋白的N-聚糖组成进行质谱分析,发现虽然天然聚糖较为复杂,但整体而言与重组糖蛋白聚糖的加工状态高度相似。
冠状病毒RNA直线长度可达病毒自身直径的100倍。把这根核酸“长绳”完整有序地缠绕进仅有约80nm直径的腔体内的重任主要落在核蛋白上。它需要像线轴一样收纳RNA,将其有序缠绕,并组装成称为核糖核蛋白复合物(RNP)的高级结构,才能将RNA完整塞进体内。在病毒发生膜融合及去组装后,它又能有条不紊的与RNA解绑,让它顺利进行复制。这个包装方法及过程,不仅对于新冠病毒是个未解之谜,甚至在所有正义单链RNA病毒中也是几何谜题。
我们团队对病毒内近20,000颗RNP进行了挑选和分析,得到了病毒腔内13Å分辨率的RNP结构密度图,并开创性地展示了RNP在病毒腔内的组装机制。成像显示,该复合物像串珠一样将RNA组织在一起,并在病毒体内呈现六聚 “鸟巢” 型和正四面体 “金字塔” 型两种局部排列,有序地收纳了RNA这根 “长绳”,还增加了病毒在复杂环境中经受物理挑战的能力。这可能是世界范围内首次 “看清” 正义单链RNA病毒的内部结构。
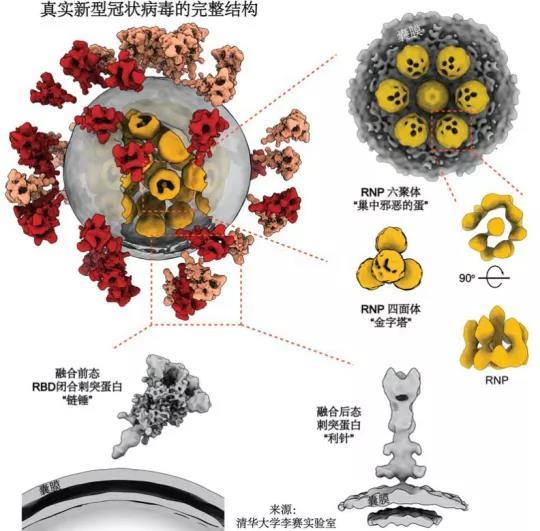
新冠病毒从内到外的全病毒结构 图源:[1]
埃博拉病毒属于丝状病毒科,可引起人类及其他灵长类动物产生埃博拉出血热,是当今世界上最致命的病毒之一,致死率可达50%-90%。2014年爆发的埃博拉疫情,在全球引发约2万人感染,7千余人死亡。由于潜伏期短,针对所引发症状无有效疫苗及药物,埃博拉病毒被列为BSL-4级病原体。埃博拉病毒的长丝状形状来自于它的核蛋白与RNA结合组装出的松散卷曲的核衣壳(nucleocapsid, NC)状结构;该松散结构通过病毒基质蛋白VP40与核蛋白NP的C末端结合而组装 [20]。
其他类型的囊膜病毒
除了以上归纳的类型,囊膜病毒的组装还有很多种,例如子弹型的弹状病毒科(如狂犬病毒),椭球形的痘病毒科(如天花病毒)。
在这里拓展介绍一下携带II类膜融合蛋白的囊膜病毒,其糖蛋白的多聚形式非常多样化。除上面提到的裂谷热、登革病毒那样由糖蛋白的五聚、六聚体组装为正二十面体外,还有单聚、二聚、三聚、四聚等多种形式,在病毒表面构成局部有序的网格,从而支撑病毒形态。这里以汉坦病毒的部分相关研究为例。汉坦病毒目前分布于世界各地,由啮齿动物携带,一旦感染人类,便会导致严重的肺部疾病(NWHs)和肾综合征出血热(OWHs)。
2016年我与同事通过对图拉病毒(TULV, 汉坦病毒科)进行了全病毒糖蛋白外壳重构,揭示了Gn-Gc异二聚体组成的四聚体spike是如何以局部有序的网格覆盖囊膜表面 [21]。2020年,我与法国巴斯德研究所 Alexandra Serris 等同事合作,结合X-射线晶体学及cryo-ET解析了该病毒多个蛋白晶体结构及病毒原位结构,开创性地构建了汉坦病毒糖蛋白包括胞外段和跨膜区的近全长结构 [22]。
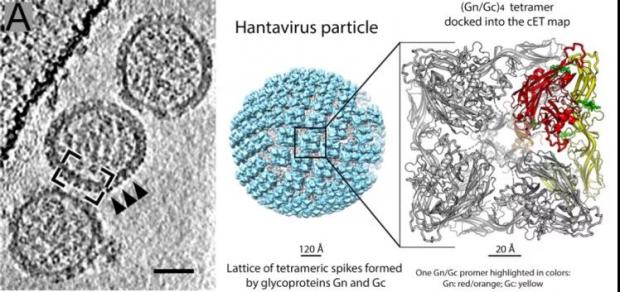
其他类型囊膜病毒之一:携带II类膜融合蛋白的汉坦病毒,糖蛋白以二聚和四聚体的层级多聚方式组装成网格覆盖囊膜表面 图源:[22]
03 推动显微技术发展,揭示病毒全貌
囊膜病毒在人类发展史上造成过多次大流行灾难,是对现代人类健康最具威胁的病原体。没人知道,还有多少危险的烈性病毒潜伏在自然界,又何时会浮出水面。
研究囊膜病毒的天然结构,而非体外重组病毒蛋白,对于我们真正了解病毒,发现它们的弱点至关重要。而因为脂双层参与组装,囊膜病毒柔性极大,形态不定,完整病毒的结构解析为结构生物学带来巨大的挑战。冷冻电镜断层成像是揭示囊膜病毒全貌图的最佳方案。
虽然目前分辨率还停留在1-2纳米左右,但该方法开发突飞猛进,常规获得近原子分辨率仅是时间问题。对囊膜病毒的研究,正从体外结构的传统方向,大步迈向从细胞中直接观测病毒生命活动的原位结构方向。冷冻电镜结构生物学是一门高度交叉学科,汇集了分子生物学、物理学、计算机等等领域的人才和资源。
只有这些方向齐头并进,才能推动显微技术达到更高成像效率、更高分辨率、更原位天然结构,从而回答更重要的生物问题。另一方面,对于传染率和致死率如此高的病毒的原位结构研究本身就充满了很大的挑战性,需要集成高端生物成像设施的生物安全实验室。此类实验室目前在全球仍是屈指可数,在疫情的影响下,这也成为生命科学基础建设的一个重要趋势。
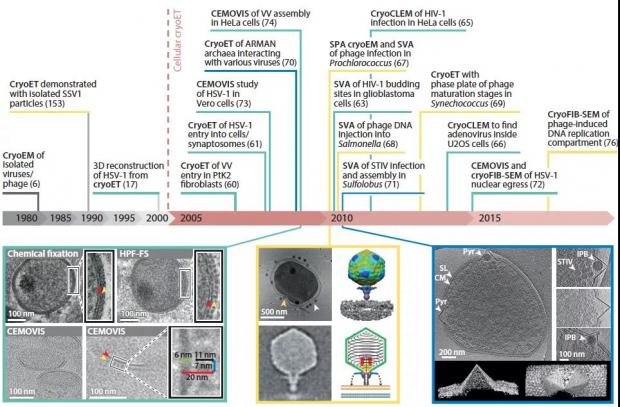
细胞中直接观测病毒生命活动原位结构的里程碑工作时间轴 图源:[23]
作者简介
李赛,清华大学研究员。研究囊膜病毒结构及高分辨冷冻电镜断层成像技术。
参考文献
1. Yao, H. et al. Molecular architecture of the SARS-CoV-2 virus. Cell, doi:https:// (2020).
2. Turoňová, B. et al. In situ structural analysis of SARS-CoV-2 spike reveals flexibility mediated by three hinges. Science, eabd5223, doi:10.1126/science.abd5223 (2020).
3. Ke, Z. et al. Structures and distributions of SARS-CoV-2 spike proteins on intact virions. Nature, doi:10.1038/s41586-020-2665-2 (2020).
4. Zhang, X., Jin, L., Fang, Q., Hui, W. H. & Zhou, Z. H. 3.3 A cryo-EM structure of a nonenveloped virus reveals a priming mechanism for cell entry. Cell 141, 472-482, doi:10.1016/j.cell.2010.03.041 (2010).
5. Baker, T. S., Olson, N. H. & Fuller, S. D. Adding the third dimension to virus life cycles: three-dimensional reconstruction of icosahedral viruses from cryo-electron micrographs. Microbiology and molecular biology reviews : MMBR 63, 862-922 (1999).
6. Stass, R., Ng, W. M., Kim, Y. C. & Huiskonen, J. T. in Advances in Virus Research Vol. 105 (ed Félix A. Rey) 35-71 (Academic Press, 2019).
7. Fuller, S. D., Berriman, J. A., Butcher, S. J. & Gowen, B. E. Low pH induces swiveling of the glycoprotein heterodimers in the Semliki forest virus spike complex. Cell 81, 715-725, doi:https://(95)90533-2 (1995).
8. Halldorsson, S. et al. Shielding and activation of a viral membrane fusion protein. Nature communications 9, 349, doi:10.1038/s41467-017-02789-2 (2018).
9. Fuller, S. D., Berriman, J. A., Butcher, S. J. & Gowen, B. E. Low pH induces swiveling of the glycoprotein heterodimers in the Semliki Forest virus spike complex. Cell 81, 715-725 (1995).
10. Kuhn, R. J. et al. Structure of Dengue Virus: Implications for Flavivirus Organization, Maturation, and Fusion. Cell 108, 717-725, doi:https://(02)00660-8 (2002).
11. Zhang, X. et al. Cryo-EM structure of the mature dengue virus at 3.5-Å resolution. Nature Structural & Molecular Biology 20, 105-110, doi:10.1038/nsmb.2463 (2013).
12. Halldorsson, S. et al. Shielding and activation of a viral membrane fusion protein. Nature Communications 9, 349, doi:10.1038/s41467-017-02789-2 (2018).
13. Dryden, K. A. et al. Native Hepatitis B Virions and Capsids Visualized by Electron Cryomicroscopy. Molecular Cell 22, 843-850, doi:https:// (2006).
14. Grünewald, K. et al. Three-Dimensional Structure of Herpes Simplex Virus from Cryo-Electron Tomography. Science 302, 1396, doi:10.1126/science.1090284 (2003).
15. Wang, N. et al. Architecture of African swine fever virus and implications for viral assembly. Science 366, 640, doi:10.1126/science.aaz1439 (2019).
16. Liu, J., Bartesaghi, A., Borgnia, M. J., Sapiro, G. & Subramaniam, S. Molecular architecture of native HIV-1 gp120 trimers. Nature 455, 109-113, doi:10.1038/nature07159 (2008).
17. Zhao, G. et al. Mature HIV-1 capsid structure by cryo-electron microscopy and all-atom molecular dynamics. Nature 497, 643-646, doi:10.1038/nature12162 (2013).
18. Li, S. et al. Acidic pH-Induced Conformations and LAMP1 Binding of the Lassa Virus Glycoprotein Spike. PLoS Pathog 12, e1005418, doi:10.1371/journal.ppat.1005418 (2016).
19. Hastie, K. M. et al. Structural basis for antibody-mediated neutralization of Lassa virus. Science 356, 923-928, doi:10.1126/science.aam7260 (2017).
20. Wan, W. et al. Structure and assembly of the Ebola virus nucleocapsid. Nature 551, 394-397, doi:10.1038/nature24490 (2017).
21. Li, S. et al. A Molecular-Level Account of the Antigenic Hantaviral Surface. Cell Reports 15, 959-967, doi:https:// (2016).
22. Serris, A. et al. The Hantavirus Surface Glycoprotein Lattice and Its Fusion Control Mechanism. Cell, doi:https:// (2020).
23. Quemin, E. R. J. et al. Cellular Electron Cryo-Tomography to Study Virus-Host Interactions. Annu Rev Virol 7, 239-262, doi:10.1146/annurev-virology-021920-115935 (2020).
话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。




 京公网安备 11010502034662号
京公网安备 11010502034662号 