阅读:0
听报道
撰文 | 王一苇 戴威 汤佩兰
责编 | 陈晓雪
2021年1月4日,《英国医学杂志》(BMJ)新闻与观点团队副主编彼得·多西(Peter Doshi)在杂志的博客网站上发文 [1],认为辉瑞-BioNTech和Moderna生产的两款新冠mRNA疫苗95%的有效性存疑,指出辉瑞疫苗有效性或低至 “29%”,未达到世界卫生组织建议的最低标准50%。
由于多西供职于著名医学期刊,并在美国马里兰大学担任医药卫生服务副教授,他的质疑引发了大量关注,辉瑞疫苗“29%”有效性的说法快速扩散。
“29%”是怎么算出来的?mRNA疫苗保护率真的不高吗?《知识分子》采访了疫苗评审专家和免疫学家。
01 95%?29%?都是怎么计算的?
本次多西的质疑并非来自新证据。他对辉瑞-BioNTech的公开数据进行了重新分析,所提出的有效性 “29%” 的观点建立在一个大胆假设的基础上——疫苗试验中数千名疑似病例都是新冠感染者。
此前,辉瑞疫苗有效性95%来自4万余接种志愿者的3期临床数据。其中,21721人接种疫苗,21728人接种安慰剂。在最终确诊新冠的170名志愿者中,8人来自疫苗组,162人来自安慰剂组,因此计算得出疫苗组确诊的概率比安慰剂组低95%——即保护率。[2]
而在确诊者外,辉瑞疫苗的3期试验中还有3410名“疑似新冠患者”(suspected covid-19)。其中,有1594人来自疫苗组,1816人来自安慰剂组。根据美国食品药品监督管理局(FDA)疫苗与相关生物制品咨询委员会的辉瑞疫苗报告,他们未被检测出新冠病毒核酸阳性结果,除非症状严重,否则也不记入不良事件。[3]
多西认为,这3410名 “疑似新冠患者” 可能存在大量假阴性,因此要和确诊者一样,考虑进疫苗保护率的计算。
他假设辉瑞-BioNTech试验中的新冠疑似者全部为实际感染者,这时疫苗保护率就成了19%(1 – (8+1594)/(162+1816)),多西的粗略计算中假定疫苗组和安慰剂组人数相等);又考虑到接种后7日内免疫原性会造成不适,多西再排除掉接种7日内发生的疑似案例,那么保护率约为29% ( 1 –(8 + 1594 – 409)/(162 + 1816 – 287))。
多西在博客中写道,“疑似案例是确诊人数的20倍以上,这类疾病不能因为没有核酸阳性结果就忽视掉。” [1]
02 “疑似新冠患者”计入确诊,合理吗?
所谓的“疑似新冠患者”究竟是否该计入疫苗有效性的计算?
一位要求匿名的免疫学专家认为,辉瑞和Moderna公司的标准是需要根据核酸检测阳性才能作为确诊病例进行统计,那些疑似(却没做核酸检测)的患者没有统计进去,“我个人看不是非常合理。这样的标准在以前的传染病疫苗研究过程中从来没有采用过,这样的定义是经不起历史考验的,起码从现在来看是这样。”
这位免疫学者曾参与过SARS疫苗研发。他告诉《知识分子》,“之前的疫苗实际上都是以感染率作为疫苗有效的标准”,如果按照是否需要进行医学处理来作为判断标准,这不是特别合理。“实际上如果我们研判各种疫苗说明书的话,那么之前所有的疫苗都不是以在临床当中进行医学处理作为保护性的条件。”对于29%的质疑,他认为并没有一个基础研究的数字支持,“从纯数字的角度看,是一种非常粗糙的估计”。
临床疫苗学专家、江苏省疾病预防控制中心副主任朱凤才则表示,他并不认可多西29%的算法。“如果按照这样(计算),所有的疫苗(有效性)都会变小。” 在与《知识分子》通话中表示,这位世界卫生组织新冠疫苗优先次序评审专家说道。
朱凤才认为,这里的“疑似新冠患者”指的是临床试验中有轻微类新冠症状,但没有做新冠核酸检测的个体。他们之所以没有做核酸检测,可能是现实条件不允许。(根据辉瑞文件 [4],这3410名“疑似新冠患者”是“未经PCR确认的”,但并未详述未确认的原因。)
“有些人并没有去就诊,或者根本就没有机会采样,有各种各样的原因,”朱凤才表示,4万多人中有3000多人是这个情况,在概率上是合理的。凭经验判断,这些人中的大部分不太可能是核酸阳性,因此把他们全部计入确诊病例是有问题的。“这是极端的(做法)。”
03 辉瑞疫苗真的能达到95%保护率吗?
朱凤才认为,辉瑞宣称的95%疫苗保护率是过高的,部分原因是试验中的统计误差。症状轻微的受试者可能不会上报自己的症状,导致最终统计的患病人数比实际患病人数低。其中,疫苗组由于注射了疫苗,症状轻微的人理论上相对于对照组会更多,未上报的人数也相对更多。这会导致最终计算结果中,疫苗保护率是偏高的。而这类误差在试验中“很难作修正”。
朱凤才认为,一个降低此类误差的计算方法,是以重症病人的人数反推总患病人数,再用得到的患病人数计算疫苗保护率。“一般重症(数量)不会漏的,”他推算,辉瑞疫苗的实际保护率大约在75%和80%之间。
这个数据如何得出?朱凤才表示,这是根据新冠期间形成的测算量表计算得出的,计算过程比较复杂,因此没有向《知识分子》展示其计算过程和公式。
他表示,监管机构在批准疫苗使用时也会考虑误差问题,会根据申请企业的数据做出统计调整,调整后的数据通常有一个更低的标准。美国FDA在2020年10月发布的《新冠疫苗紧急使用批准行业指南》规定,有对照组的三期临床试验要达到50%的有效性,同时,经过适当调整后的有效性下限是30%。[5]
多西在博客中另一个质疑是,辉瑞在分析有效性时以存在“第二剂后7天或之前的重要方案偏离”的理由排除了371人,其中311人来自疫苗组,而只有60人来自对照组。“值得关注的是,这些被排除个体的数量在随机分组之间是不平衡的。”多西写道。
朱凤才对此表示,这很可能是辉瑞在合规前提下做的有利选择。“把这个数据放到里面,计算可能更准确。”
对于多西的质疑,截至发稿前,辉瑞与BioNTech均未对《知识分子》的问询做出回应。
04 不同统计口径下保护率不同,怎么看?
1月12日,科兴-巴西合作方发布的最新数据称疫苗保护率为50.4%,远低于之前的78%。这一消息也引起讨论,为什么两次公布的保护率数据差异这么大?
据彭博报道 [12], 参与科兴疫苗三期临床试验的巴西布坦坦研究所在发布会上解释,科兴将三期试验中的感染者分成6类,分别是无症状、极度轻症、轻症、两个级别的中症,和重症(asymptomatic, very mild, mild, two levels of moderate, and severe)。科兴疫苗对无症状之外的新冠的保护率是50.4%,对无症状和极度轻症以外的新冠的保护率是78%。
一个疫苗的保护率有多种统计口径,应该以哪个为准?
目前大多数疫苗试验中,用于最终统计保护率的是“确诊患者”人数,“确诊”的判断标准是新冠病毒核酸阳性且具备一定临床症状,二者缺一不可。
上文提到的辉瑞95%的保护率即以这个标准作出。Moderna、阿斯利康的疫苗保护率也采用这个计算标准,只是在临床症状标准上会略有区别。
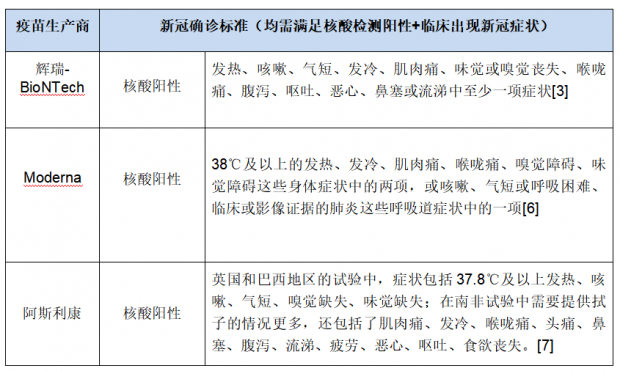
当试验参与者出现特定症状,研究人员将采集拭子送至实验室进行核酸检测,因此研究人员的随访频率、参与者是否自觉报告也将一定程度影响最终的诊断。
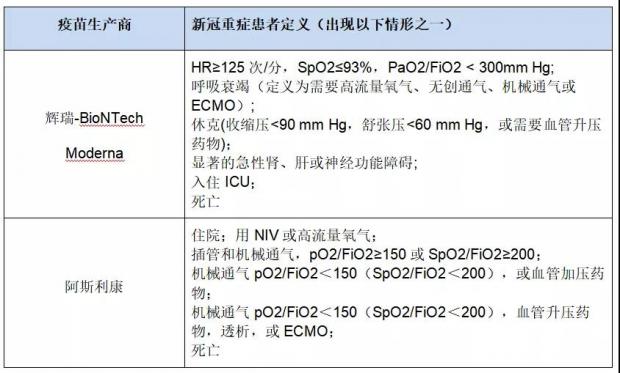
对于确诊患者中的重症患者,辉瑞、Moderna采用美国FDA的定义,而阿斯利康将世界卫生组织确定的新冠临床量表中6分及以上情形认定为重症;但轻症患者、中度症状患者的诊断标准和确诊人数目前还缺乏详细信息。
目前唯一统计了无症状感染者保护率的是阿斯利康。在去年12月发表在《柳叶刀》的论文中,他们统计了英国地区核酸阳性的无症状感染者。通过每周收集参与者拭子,研究人员发现疫苗组中有无症状感染者29人(n=3288),安慰剂组为40人(n=3350),有效性为27.3%。[7]
不过,阿斯利康在巴西的临床试验中未对无症状感染者进行核酸测试,在南非的试验中,无症状感染者的检测仅在研究访问(study visits)时采集,因为数据较小未发表于论文中。
新冠疫苗接种后出现无症状感染者,是否意味着疫苗保护失败?上述要求匿名的免疫学家表示,这是一个新问题。”以前疫苗主要预防的是出现症状的人。”
阿斯利康疫苗对无症状感染者的有效性只有27.3%,而科兴疫苗对轻症感染者保护率只有50.8%,我们需要担心打了疫苗没效果吗?
“(科兴疫苗)对重症100%有保护,这点还是值得欣慰的,” 上海交通大学医学院、上海市免疫学研究所研究员李斌表示,重症保护意味着可以有效降低新冠病毒的致死率,“大家担心的是,如果你不能保证保护轻微的(感染者),那么可能就没法阻断病毒的传播,特别是无症状感染者。”
目前为止,没有任何疫苗宣称可以100%预防无症状感染者。“理论上讲,有无症状感染者的存在,病毒就不可能被疫苗消灭,”李斌说,“从基础研究来说,科研还要继续,现在的疫苗肯定不是最理想的疫苗。但现有的灭活疫苗肯定是可以打的,安全性没问题。”
疫苗实验中出现轻症患者,意味着什么?能说明疫苗效果不好吗?
“打完疫苗被感染以后,产生轻症,也是可以理解的,”李斌表示,轻症代表病毒在体内还是扩增了,但如果不打疫苗,也许这些人会成为重症,“重症发病率被阻止了,至少这个数字是确定的,所以在我看来疫苗还是有效的。”
如果打了疫苗后不再有重症患者,新冠病毒会怎样发展?李斌认为,这时的新冠病毒像流感病毒。“希望毒性越来越小,最终成为普通感冒病毒中的第四个冠状病毒,”他说。他表示,流感病毒的疫苗就是打了只管一年的流行株,而目前新冠疫苗产生的抗体及免疫记忆最长能持续多久,仍然需要进一步观察。
关于能预防重症但对轻症保护率较低的疫苗,旅德免疫学者商周认为需要分两方面看。
“从个体层面来看,接种能预防重症的疫苗会让新冠变成类似流感一样,不再给人的健康带来大的伤害。从群体层面来看,新冠疫苗和流感疫苗很不相同,因为新冠病毒不像流感病毒那样变异快,所以新冠疫苗接种的一个重要目的是通过疫苗接种来达到群体免疫,从而消灭新冠病毒。”
商周也表示,因为轻症患者依然会是传染源,所以对轻症新冠保护率低的疫苗在建立有效群体免疫屏障上会慢得多。
05 数据透明有助于分析疫苗效果
这不是多西第一次对疫苗数据提出质疑。多西曾在麻省理工学院历史、人类学、科学、技术和社会博士学位(Ph.D. in history, anthropology, and science, technology and society),研究兴趣为药物安全性和有效性的评估政策。2018年,多西曾因加拿大政府拒绝将多种药物和疫苗的数据分享给他评估而起诉加拿大卫生部,并取得胜诉。[8]
在博客中,多西呼吁辉瑞和Moderna公司公开原始试验数据,认为这可以帮助 “回答许多公开的问题”。目前,辉瑞规定其数据公开的原则是 “依申请公开,并接受审查” [9],而且在研究结束的24个月之后才会公开 [10]。而Moderna表示数据在试验完成后会依申请公开 [11]。
目前,国药和科兴也未披露完整的三期试验数据。
朱凤才也表示,公开数据能使专业人士更好地分析疫苗效果。
参考资料:
[1]Peter Doshi: Pfizer and Moderna’s “95% effective” vaccines—we need more details and the raw data
[2]Polack et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. NEJM. (2020) 383:2603-2615.
[3]FDA Briefing Document,Pfizer-BioNTech COVID-19 Vaccine.
Vaccines and Related Biological Products Advisory Committee Meeting. December 10, 2020.
[4]Vaccines and Related Biological Products Advisory Committee Meeting
December 10, 2020
#page=42
[5]Emergency Use Authorization for Vaccines to Prevent COVID-19 Guidance for Industry
[6]FDA Briefing Document, Moderna COVID-19 Vaccine.
Vaccines and Related Biological Products Advisory Committee Meeting. December 17, 2020.
[7]Voysey et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. The Lancet.(2020) Volume 397, ISSUE 10269, P99-111.
DOI:https://(20)32661-1
[8]Health Canada ordered to release confidential drug company data on HPV vaccines
[9]Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine supplemental material
#article_supplementary_material
[10]A Phase 1/2/3 Study to Evaluate the Safety, Tolerability, Immunogenicity, and
Efficacy of RNA Vaccine Candidates Against COVID-19 in Healthy Individuals
https://pfe-pfizercom-d8-#page=119
[11]Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine supplemental material
#article_supplementary_material
[12]
话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。




 京公网安备 11010502034662号
京公网安备 11010502034662号 