刚刚,瑞典卡罗琳医学院宣布,将2021年的诺贝尔生理学或医学奖颁给美国旧金山加州大学(UCSF)的教授David Julius和Scripps研究所的Ardem Patapoutian,奖励他们对感知温度与触觉受体的发现。
2020年,《知识分子》曾报道两位科学家同获科维理奖,今日重发。另附《知识分子》特约文章,梳理了David Julius发现Trp离子通道的过程以及该领域的研究现状。
撰文 | 辛玲
神经感知温度和压力的秘密
加州大学旧金山分校的戴维·朱利叶斯和Scripps研究所的阿德姆·帕塔普蒂安在各自独立的研究中发现了人体感知温度、压力及疼痛的分子机制,为与触觉相关的生理疾病研究提供了重要依据。
感知外界刺激的分子受体是人类五大感官系统的生物学基础。虽然我们很早就发现了与视觉、嗅觉相关的分子受体,但对于触觉—包括人体对温度(冷暖)、机械力(如握手)、伤害性物质(如吃辣椒产生疼痛感)的感知却始终是个谜。
生物学家饶毅曾撰文介绍(见饶毅:国产博士的记录),1980年代,朱利叶斯开始用当时比较新的方法表达克隆寻找五羟色胺的受体,十几年后,他继续用这一办法寻找辣椒素(辣椒中的一种化合物,可引起灼痛感)的受体,并在1997年找到了一个辣椒素激活的蛋白质分子VR1,而且发现VR1可被加热所激活,因为辣椒素已知与痛觉通路有关,所以这一工作也揭开了温度感受的机理和痛觉的外周感受的部分机理。在1997年的这篇文章中,朱利叶斯也确认VR1属于TRP通道家族,而TRP基因早在1969年就在果蝇中首次发现,只是人们一直不知道它的功能。因此,饶毅评论说,朱利叶斯虽然不是第一个发现TRP基因的科学家,但他发现TRP基因编码的蛋白质在感觉系统起重要作用(温度、压力等)。“把他(Julius)和Ardem合起来是因为他们在压力感觉都有贡献。其中对于长期悬而未决的听觉,他们和其他人都有直接或间接贡献。”饶毅说。
清华大学药学院研究员肖百龙告诉《知识分子》,朱利叶斯的小组后来还陆续发现了这个家族的其它受体,譬如凉爽受体以及芥末油受体。这一新发现的TRPV1及相关通道目前已成为新型止痛药研发关注的靶点。
“David Julius的工作是非常系统的,从发现外周感受疼痛的受体,一直到它的结构和功能上的关系,包括生理上通过基因敲除的技术去研究其他的受体,这是一个系列的工作,David Julius获奖我觉得是well deserved。”北京大学生命科学学院研究员李毓龙评论说。
帕塔普蒂安与朱利叶斯几乎同时在研究触觉受体的问题。帕塔普蒂安在发现了凉爽(薄荷素)、芥末油以及温热的受体后,决定对更具挑战性的机械力受体的寻找发起冲击。机械力的研究极其困难,一是需要找到合适的刺激方式,二是很难记录产生的电流。
帕塔普蒂安课题组的博后Bertrand Coste寻找到一种可在实验室培养皿中生长的胶质瘤细胞系的细胞,这些细胞通过产生电信号来响应轻触带来的压力变化。然后从人类的2万多个编码基因中精心挑选出300多个在该种细胞中高表达的候选基因,然后培养逐一缺少(敲低)这些基因的细胞。接着对样本们进行逐一测试,寻找缺失时会导致细胞失去感应电流的基因。经过三年多的不懈努力,最终确定清单上的72号候选基因确定具此功能。他们把这个基因取名为PIEZO,在希腊语里是压力的意思。PIEZO在动物和植物体内都存在,在进化上高度保守,提示它在功能上非常重要。
同时期在帕塔普蒂安课题组从事博士后研究的肖百龙博士见证了这一激动人心的发现过程,并在后续的研究中证明了PIEZO蛋白形成一类全新的压力敏感离子通道。肖百龙指出:“寻找压力受体的过程充满了风险,候选基因list有可能是不完整的,敲除过程也可能出现技术问题,但是持之以恒的努力最终收获了这一里程碑式的科学发现”。
帕塔普蒂安很快确认了PIEZOs为哺乳动物体内压力感应的必需基因。他的研究表明,PIEZOs可形成离子通道,它们直接负责皮肤内默克尔细胞(Merkel cells)和触觉终端,以及本体感受器(感觉神经末梢位于肌肉内的感受器,可以感受身体在空间的位置、姿势和运动并做出反应)的压力感测。
PIEZOs 还能通过分布在血管和肺部的神经末梢感知压力,并影响红细胞体积、血管生理,引发多种人类遗传疾病。PIEZOs的发现打开了力学生物学的大门,这是一个与生物学、工程学和物理学交叉的新兴科学领域,侧重于研究细胞和组织的物理作用力和力学特性的变化如何对健康和疾病造成影响。
“Ardem是一位极其聪明、具有前瞻视野的科学家,但他从不满足于现有成就,不断探索,充满创新欲望。他对课题组的研究人员充满信任,总是全力支持他们探索前沿科学问题。他因PIEZO通道的发现和研究获得此次科维理奖确属实至名归。”肖百龙说。
“两位获奖者在外周感知分子机制的研究中做出了系统性、里程碑式的贡献,此次获奖实至名归。” 李毓龙表示。他认为,他们的获奖再次表明,卓越的基础科学需要时间积累和好奇心的驱动,而这些正是中国科学家们积极努力的方向。
注:上文摘自2020年《知识分子》文章:7位科学家获科维理奖,但颁奖典礼要到2022年了。
附:TRP通道的前世今生
撰文|齐昕 李婕 卢剑飞
审核|徐天乐 朱曦 李海涛
责编|陈晓雪
细胞的信号转导依赖细胞膜上的多种受体蛋白。而在这其中,离子通道对于即时感知细胞内外信号,调节适应性变化具有关键作用。2003年,Peter Agre和 Roderick Mackinnon 就因为发现了水通道和解释了电压门控钾通道离子选择性原理而共同获得了诺贝尔化学奖。
我们今天介绍的瞬时受体电位(Transient receptor potential ,TRP)通道,也以其复杂的调控机制和丰富的生理功能吸引了一代又一代的科学家为之努力探索。
1、一个意外收获
相比于我们对电压门控型离子通道的研究,对TRP通道的研究起步时间较晚。
1969年,英国爱丁堡大学动物系的 D. J. Cosens 和 Aubrey Manning 在黑腹果蝇上利用甲基磺酸乙酯(Ethylmethane sulfonate,EMS)作为诱变剂,通过人工诱变的方式筛选到一个突变体,该品系存在异常的趋光性和视网膜电位,持续光刺激仅引起短暂的视网膜负电位,而不是常见持续的、平台样变化,并且在第二次光照刺激来临时不能产生有效的反应 [1]。
美国加州大学伯克利分校 Gerald Rubin 实验室的博士后 Craig Montell 随后研究发现,这是由于黑腹果蝇某个类似离子通道膜蛋白的突变而导致的,因此他们率先克隆了该基因,并将该蛋白命名为瞬时受体电位(TRP)通道 [2]。野生型TRP通道介导昆虫视觉细胞中光激活的持续平台电流。同样的通道在脊椎动物中并不存在,但是却有很多在进化上和初始的果蝇TRP通道相关的通道蛋白,形成了一个蛋白超家族。
基于果蝇的TRP是最早被发现的,所有的超家族成员也都以TRP命名并根据蛋白序列的差异分属于TRPC(Canonical)、TRPV(Vanilloid)、TRPM(Melastatin)、TRPA(Ankyrin)、TRPP(Polycystin)、TRPML(Mucolipin)以及TRPN(NOMP-C)七个亚家族(图1)。其中TRPN只在无脊椎动物中发现,初始的果蝇TRP属于TRPC亚家族。
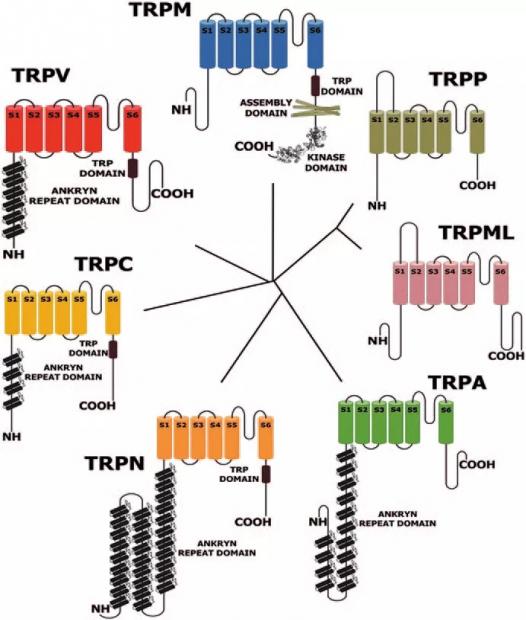
图1 TRP通道亚家族[3]
哺乳动物TRP通道不参与视觉感受,但广泛参与了痛觉的产生与调节,其中以TRPV1为主要代表。长久以来,人们已经知道辣椒浸出液选择性激活背根神经节(Dorsal root ganglion,DRG)的伤害感受神经元,诱导其产生动作电位 [4],将伤害刺激传递给中枢神经系统产生痛觉。但刺激分子辣椒素是通过什么机制激活神经元的呢?
为了筛选与辣椒素结合的受体,1997年加州大学旧金山分校的David Julius教授带领的小组从大鼠DRG中提取了16000多种mRNA,将它们分成不同的组分,分别转入工具细胞中检测其对辣椒素的反应,成功克隆得到了辣椒素受体VR1。对VR1蛋白序列的分析表明VR1属于TRP蛋白超家族,因此被命名为TRPV1通道 [5]。
该基因编码一个6次跨膜蛋白,通道展现出高度的钙离子通透性。TRPV1能被辣椒素特异性激活,同时也能被42℃以上的高温激活,从而不仅确定了辣椒素激活感觉神经元的原理,还首次将痛觉和温度感受联系在一起,揭示了人吃辣椒为什么会同时感到辣和热的分子机制。
迄今为止,已从酵母、昆虫、鱼类及哺乳动物中发现了50余种TRP通道。他们虽然同属于TRP超家族,但序列一致性不超过20%,同时,通道特性也存在巨大的差异,有些TRP通道表达在质膜上,整合细胞内外信息,介导非选择性阳离子内流;有些则分布在细胞器膜上,调节胞内Ca2+的释放 [6]。想要了解通道开放机制和生理功能,解析他们的精细结构势在必行。
2、冷冻电镜关键技术革命引爆结构解析突破
与果蝇trp基因同源性最高,也是全长最早得到解析的哺乳类TRP通道之一是TRPC3。TRPC3在神经系统和心脏中广泛表达,被二酰基甘油(diacylglycerol,DAG)等第二信使激活,感知胞浆钙库耗竭,开放介导非选择性的阳离子电流,参与生长锥导向,突触可塑性,血管收缩等多重生理过程。
2007年Chikara Sato等人合作报道了TRPC3的冷冻电镜结构,这也是第一个被解析出来的全长哺乳类TRP通道结构 [7]。电镜结构显示,TRPC3由四个亚基组成,整个通道形成一个嵌套式的结构,由中间的球形空腔和不连续外壳构成,通道开放时离子通过孔道进入腔体,借由腔体底部四个开口流入胞内。而外壳上分隔出的不同结构域可能也参与了门控机制的精细调节。
紧随其后得到全长解析的是TRPV1通道。2013年,David Julius 教授与和他同一机构的华人科学家程亦凡教授合作,在《自然》杂志连续发表了两篇文章,解析了全长TRPV1关闭态和开放态的结构,此为首个以冷冻电镜方法获得近3Å超高分辨率的膜蛋白结构,大大促进了对TRP通道分子结构的认识,并开创了一个以冷冻电镜为主要手段研究蛋白结构及蛋白与蛋白间相互作用的新时代,也侧面促进了冷冻电镜技术获得2017年诺贝尔化学奖。

图2 加州大学旧金山分校教授程亦凡 | 图源:
通过对TRPV1关闭态结构的分析,研究者发现该通道与电压门控离子通道具有相似的结构:TRPV1为四聚体,每个亚基具有六次跨膜α螺旋结构域,其中第5和第6个跨膜结构域共同构成通道孔区,第1-4个跨膜结构域构成电压感受位点以及辣椒素结合位点 [8]。而在树脂毒碱(辣椒素类似物)和蜘蛛毒素DkTx存在的情况下,可以得到TRPV1的开放态结构,通过对其开放态与关闭态结构的对比,发现TRPV1有独特的双门通道激活机制(图3) [9],虽然其选择性滤器是否构成真正能控制离子流动的上闸门尚有争议 [10]。该工作完美地阐释了辣椒素和质子两种不同配体激活下,TRPV1通道的开放原理与构象变化,但也给我们带来了新的疑问,温度介导TRP通道开放是否也具有特定的结构生物学基础呢?
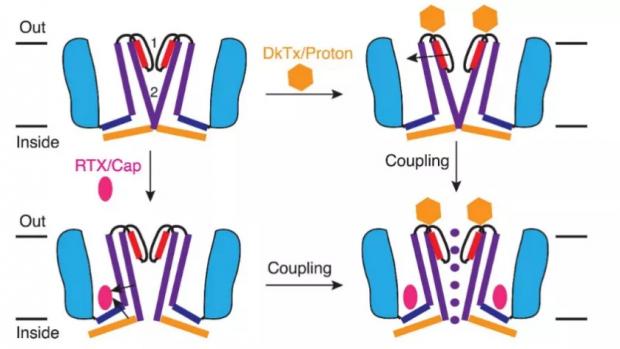
图3 TRPV1双门通道门控机制 [9]
3、春江水暖 “TRP” 知
除了被配体激活,温度敏感也是TRP家族的一个重要特征。我们把类似TRPV1这种在特定温度下开放的TRP家族成员统称为ThermoTRP。
迄今,在哺乳动物中已鉴定出11种ThermoTRP,包括热受体TRPV1-TRPV4和TRPM2-TRPM5,以及冷受体TRPM8、TRPC5和TRPA1。这些ThermoTRP可以感受整个生理范围内的温度,从产生痛感的灼热,到令人舒适的温暖及凉爽,再到刺骨的寒冷。
此外,ThermoTRP还可以被化学配体所激活,包括刚才提到的辣椒素,还有大蒜素、大麻素、芥末油,薄荷醇和肉桂醛等(图4)[11]。
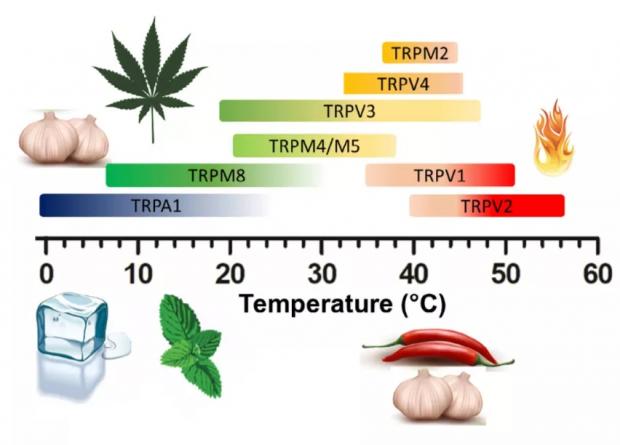
图4 ThermoTRP及其化学配体
研究人员充分利用各种生物物理学技术和方法,对温度如何激活ThermoTRP通道的机理进行了长期探索。温度代表着区域微观粒子的平均动能,而热传导会影响粒子排布。对于肽链和蛋白质来说,温度改变不仅会影响氨基酸残基的极性强弱,也会大程度改变蛋白质的构象。正是由于这种多模态参与的方式,阻碍了解析ThermoTRP温度激活机制的进程。同时,不同种属温度敏感性的差异,比如,大鼠rTRPV1的激活温度阈值为~42℃,而吸血蝙蝠(Vampire bat)TRPV1的激活温度约30℃,更是增加了鉴定温度传感结构域的挑战性。
对于TRPV1来说,目前鉴定出参与温度门控的区域主要包括N端、C端、外孔区以及孔道区域(图5)。
位于N端的锚定重复域(Ankyrin repeat domain,ARD)决定了十三条纹地松鼠和双峰驼的耐热性,如果把地松鼠来源的sqTRPV1通道第190位天冬氨酸换成类似大鼠的丝氨酸,会介导sqTRPV1热敏感性增加,但不影响其辣椒素和酸诱导的化学激活 [12]。而实验证明,连接ARD和第一个跨膜片段的N端,也被称为细胞膜近端域(Membrane proximal domain,MPD),作为温度感受器而参与介导TRPV1温度敏感性,并决定了温度刺激下的TRPV1通道开关过程中的能量变化和温度感受特性。利用分子生物学手段将这段区域换进rTRPV2,hTRPV2或者mTRPV4等通道,不仅使温度不敏感的亚型转变为温度敏感的通道,也会使野生型通道的温度感受特性变得和TRPV1通道一样 [13]。
此外,受内源性胞内激动剂磷脂酰肌醇(Phosphatidylinositol-4,5-bisphophate,PIP2)影响的通道C端的近膜区与远端,也都是感知温度刺激的重要模块 [14,15]。将热激活的TRPV1与冷激活的TRPM8 C端互换,可以交换其温度敏感性,尤其是将TRPV1 Q727和W752两个氨基酸残基引入野生型TRPM8通道中,可以使其直接表现出热激活的特性,且不与PIP2激活耦联,这说明温度传感与传统配体激活依赖的机制不同 [16]。
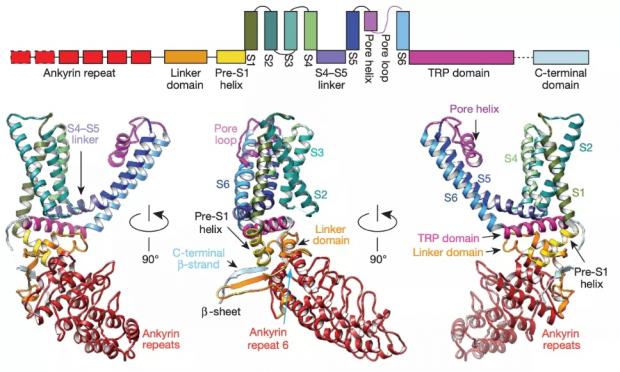
图5 TRPV1温度敏感结构域 [8]
有研究证明,N端和C端两个胞内区也会通过相互作用介导TRPV1的热失活 [17]。除了胞内区,通道孔道及孔道周边也参与了温度敏感性调控,其关键位点,包括位于通道孔区的C617、C622以及位于孔区外的N628、N652、Y653,突变后均会显著影响TRPV1的温度敏感性 [18,19]。每个物种都有最适宜的生存温度,进化压力使得TRP通道表现出了显著的种属差异,这也在侧面论证了TRP家族对于生物适应环境变化具有重要意义。
4、以子之矛,攻子之盾
因为其多种多样的生物学功能以及灵活多变的开放机制,靶向TRP通道进行临床干预具有广泛的应用前景。
以TRPV1为例,它就是非常具有转化价值的镇痛靶点 [20]。作为将伤害刺激转化为电信号的感受器,TRPV1通道在感觉神经末梢过度激活时,也会导致神经病理痛(图6)[21]。例如癌症患者化疗后有时会并发严重的外周神经痛,常规镇痛药不能完全缓解。这可能就是因为顺铂、奥沙利铂和紫杉醇等化疗药促进TRPV1的功能,引起通道表达水平升高、通道敏化及氧化应激反应,诱发机械、热和冷痛敏反应 [22]。靶向TRP通道的药物,可有效缓解癌症患者在化疗时遭受的严重不良反应。例如,树脂毒碱可以作为 “分子手术刀”,通过特异性激活其受体TRPV1通道,引起表达TRPV1的痛觉感受神经元发生钙内流与钙超载,进而导致这些神经元的凋亡,作为慢性癌症疼痛的控制手段 [23]。
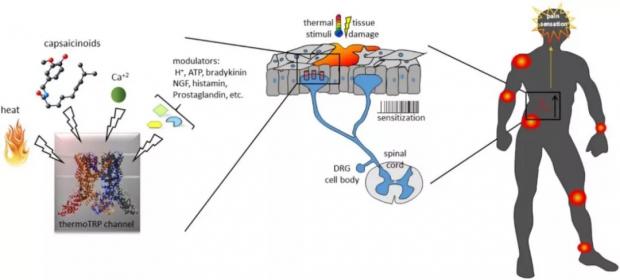
图6 ThermoTRP与疼痛[11]
同时,TRP通道也是治疗呼吸系统疾病的潜在靶点,它们在肺中的免疫细胞和结构细胞中广泛表达,在引起支气管痉挛和咳嗽等呼吸系统症状中发挥核心作用 [24]。吸入辣椒素会激活C纤维引起剧烈的咳嗽反射,而该反射的增强是哮喘、慢性阻塞性肺病、特发性肺纤维化等一系列呼吸道疾病共同的特征之一。靶向呼吸道中高表达的TRPV1、TRPA1、TRPV4、TRPM8等亚基,不仅可以增加肺通气,改善气道阻塞,也可能成为COVID-19等肺部感染治疗中,减轻肺水肿 [25]、改善呼吸窘迫、抑制病毒在宿主细胞间传递 [26] 的辅助干预策略。
除此之外,靶向TRP家族,尤其是TRPM亚家族干预神经系统疾病也具有临床转化意义。TRPM2抑制剂JNJ-28583113可以显著缓解小鼠缺血性中风过程中神经元的氧化应激损伤 [27],而TRPM4亚基不仅通过促进N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDAR)膜转运,加重突触周NMDAR介导的神经元死亡 [28],还可以与磺酰脲受体1(Sulfonylurea-receptor 1,SUR1)形成复合体,增加血脑屏障通透性 [29],与水通道蛋白4(Aquaporin 4,AQP4)形成聚合体加剧中风时星形胶质细胞的肿胀,导致更严重的神经损伤 [30]。外源格列苯脲靶向SUR1-TRPM4异聚体干预缺血性中风已经进入临床三期阶段。这进一步说明了靶向TRP通道干预中枢神经系统疾病的应用前景。
TRP通道的研究还在继续,这不仅是我们理解机体如何感知外界刺激(温度、压力、伤害刺激)的分子窗口,也是极具启发性和延续性的靶标探索史诗,其从结构到功能的研究范式对后续膜蛋白的研究产生了深远的影响。临床医学的进步与革新离不开基础科学的探索与发现,希望随着我们对TRP通道和其他膜蛋白了解的深入,能真正揭开生物进化的奥秘,产生更多有启发性和临床转化价值的研究成果。
注:本文部分内容摘自公众号《离子通道研究进展》
作者简介
齐昕为上海交通大学医学院三年级博士研究生,李捷为上海交通大学医学院二年级硕士研究生,卢剑飞为上海交通大学医学院博士后。
审稿人简介
徐天乐为上海交通大学医学院特聘教授,朱曦为德克萨斯大学休斯敦健康医学中心教授,李海涛为清华大学医学院教授。
参考文献:(上下滑动可浏览)
1.Cosens D. J., and Manning Aubrey. "Abnormal Electroretinogram from a Drosophila Mutant." Nature 224, no. 5216 (1969): 285-7.
2.Montell Craig, and Rubin Gerald M. "Molecular Characterization of the Drosophila Trp Locus: A Putative Integral Membrane Protein Required for Phototransduction." Neuron 2, no. 4 (1989): 1313-23.
3.Ferreira Gonzalo, Raddatz Natalia, Lorenzo Yenisleidy, González Carlos, and Latorre Ramón. "Biophysical and Molecular Features of Thermosensitive Trp Channels Involved in Sensory Transduction." 1-39: Springer International Publishing, 2015.
4.Baccaglini P. I., and Hogan P. G. "Some Rat Sensory Neurons in Culture Express Characteristics of Differentiated Pain Sensory Cells." Proc Natl Acad Sci U S A 80, no. 2 (1983): 594-8.
5.Caterina Michael J , Schumacher M A , Tominaga Makoto , Rosen Tobias A , Levine Jon D , and Julius David "The Capsaicin Receptor: A Heat-Activated Ion Channel in the Pain Pathway." Nature 389, no. 6653 (1997): 816-24.
6.Koivisto Ari-Pekka, Belvisi Maria G, Gaudet Rachelle, and Szallasi Arpad. "Advances in Trp Channel Drug Discovery: From Target Validation to Clinical Studies." Nat Rev Drug Discov (2021).
7.Mio Kazuhiro, Ogura Toshihiko, Kiyonaka Shigeki, Hiroaki Yoko, Tanimura Yukihiro, Fujiyoshi Yoshinori, Mori Yasuo, and Sato Chikara. "The Trpc3 Channel Has a Large Internal Chamber Surrounded by Signal Sensing Antennas." J Mol Biol 367, no. 2 (2007): 373-83.
8.Liao Maofu, Cao Erhu, Julius David, and Cheng Yifan. "Structure of the Trpv1 Ion Channel Determined by Electron Cryo-Microscopy." Nature 504, no. 7478 (2013): 107-12.
9.Cao Erhu, Liao Maofu, Cheng Yifan, and Julius David. "Trpv1 Structures in Distinct Conformations Reveal Activation Mechanisms." Nature 504, no. 7478 (2013): 113-8.
10.Jara-Oseguera Andres, Huffer Katherine E, and Swartz Kenton J. "The Ion Selectivity Filter Is Not an Activation Gate in Trpv1-3 Channels." Elife 8 (2019).
11.Castillo Karen, Diaz-Franulic Ignacio, Canan Jonathan, Gonzalez-Nilo Fernando, and Latorre Ramon. "Thermally Activated Trp Channels: Molecular Sensors for Temperature Detection." Phys Biol 15, no. 2 (2018): 021001.
12.Laursen Willem J, Schneider Eve R, Merriman Dana K, Bagriantsev Sviatoslav N, and Gracheva Elena O. "Low-Cost Functional Plasticity of Trpv1 Supports Heat Tolerance in Squirrels and Camels." Proc Natl Acad Sci U S A 113, no. 40 (2016): 11342-47.
13.Yao Jing, Liu Beiying, and Qin Feng. "Modular Thermal Sensors in Temperature-Gated Transient Receptor Potential (Trp) Channels." Proc Natl Acad Sci U S A 108, no. 27 (2011): 11109-14.
14.Brauchi Sebastian, Orta Gerardo, Salazar Marcelo, Rosenmann Eduardo, and Latorre Ramon. "A Hot-Sensing Cold Receptor: C-Terminal Domain Determines Thermosensation in Transient Receptor Potential Channels." J Neurosci 26, no. 18 (2006): 4835-40.
15.Vlachova Viktorie, Teisinger Jan, Susankova Klara, Lyfenko Alla, Ettrich Rudiger, and Vyklicky Ladislav. "Functional Role of C-Terminal Cytoplasmic Tail of Rat Vanilloid Receptor 1." J Neurosci 23, no. 4 (2003): 1340-50.
16.Brauchi Sebastian, Orta Gerardo, Mascayano Carolina, Salazar Marcelo, Raddatz Natalia, Urbina Hector, Rosenmann Eduardo, Gonzalez-Nilo Fernando, and Latorre Ramon. "Dissection of the Components for Pip2 Activation and Thermosensation in Trp Channels." Proc Natl Acad Sci U S A 104, no. 24 (2007): 10246-51.
17.Luo Lei, Wang Yunfei, Li Bowen, Xu Lizhen, Kamau Peter Muiruri, Zheng Jie, Yang Fan, Yang Shilong, and Lai Ren. "Molecular Basis for Heat Desensitization of Trpv1 Ion Channels." Nat Commun 10, no. 1 (2019): 2134.
18.Yang Fan, Cui Yuanyuan, Wang KeWei, and Zheng Jie. "Thermosensitive Trp Channel Pore Turret Is Part of the Temperature Activation Pathway." Proc Natl Acad Sci U S A 107, no. 15 (2010): 7083-8.
19.Grandl Jorg, Kim Sung Eun, Uzzell Valerie, Bursulaya Badry, Petrus Matt, Bandell Michael, and Patapoutian Ardem. "Temperature-Induced Opening of Trpv1 Ion Channel Is Stabilized by the Pore Domain." Nat Neurosci 13, no. 6 (2010): 708-14.
20.Szallasi Arpad, Cortright Daniel N, Blum Charles A, and Eid Samer R. "The Vanilloid Receptor Trpv1: 10 Years from Channel Cloning to Antagonist Proof-of-Concept." Nat Rev Drug Discov 6, no. 5 (2007): 357-72.
21.Patapoutian Ardem, Tate Simon, and Woolf Clifford J. "Transient Receptor Potential Channels: Targeting Pain at the Source." Nat Rev Drug Discov 8, no. 1 (2009): 55-68.
22.Naziroglu Mustafa, and Braidy Nady. "Thermo-Sensitive Trp Channels: Novel Targets for Treating Chemotherapy-Induced Peripheral Pain." Front Physiol 8 (2017): 1040.
23.Brown Dorothy Cimino. "Resiniferatoxin: The Evolution of the "Molecular Scalpel" for Chronic Pain Relief." Pharmaceuticals (Basel) 9, no. 3 (2016).
24.Belvisi Maria G, and Birrell Mark A. "The Emerging Role of Transient Receptor Potential Channels in Chronic Lung Disease." Eur Respir J 50, no. 2 (2017).
25.Kuebler Wolfgang M, Jordt Sven-Eric, and Liedtke Wolfgang B. "Urgent Reconsideration of Lung Edema as a Preventable Outcome in Covid-19: Inhibition of Trpv4 Represents a Promising and Feasible Approach." Am J Physiol Lung Cell Mol Physiol 318, no. 6 (2020): L1239-L43.
26.Chao Yu-Kai, Chang Sui-Yuan, and Grimm Christian. "Endo-Lysosomal Cation Channels and Infectious Diseases." Rev Physiol Biochem Pharmacol (2020).
27.Fourgeaud Lawrence, Dvorak Curt, Faouzi Malika, Starkus John, Sahdeo Sunil, Wang Qi, Lord Brian, et al. "Pharmacology of Jnj-28583113: A Novel Trpm2 Antagonist." Eur J Pharmacol 853 (2019): 299-307.
28.Yan Jing, Bengtson C Peter, Buchthal Bettina, Hagenston Anna M, and Bading Hilmar. "Coupling of Nmda Receptors and Trpm4 Guides Discovery of Unconventional Neuroprotectants." Science 370, no. 6513 (2020).
29.Woo Seung Kyoon, Kwon Min Seong, Ivanov Alexander, Gerzanich Volodymyr, and Simard J Marc. "The Sulfonylurea Receptor 1 (Sur1)-Transient Receptor Potential Melastatin 4 (Trpm4) Channel." J Biol Chem 288, no. 5 (2013): 3655-67.
30.Gerzanich Volodymyr, Woo S Kyoon, Vennekens Rudi, Tsymbalyuk Orest, Ivanova Svetlana, Ivanov Alexander, Geng Zhihua, et al. "De Novo Expression of Trpm4 Initiates Secondary Hemorrhage in Spinal Cord Injury." Nat Med 15, no. 2 (2009): 185-91.
0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 