阅读:0
听报道

2021年诺贝尔化学奖授予Benjamin List和David W. C. MacMillan,以奖励他们 “对于有机小分子不对称催化的重要贡献”。
导 读
今年的诺贝尔化学奖颁给了不对称有机催化。作为有机化学的博士,意外之余有点惊喜。化学奖近年来经常给了生化和材料等交叉学科,纯化学较少,被戏称为 “理综奖”。
今年mRNA疫苗获奖的呼声很高,接连落选生理奖和化学奖,颇有些遗憾。不过从另外一个角度看,新冠口服小分子药物molnupiravir三期临床成功的消息极大提升了人类战胜新冠的信心,有机化学作为小分子药物背后的基础科技获得诺贝尔奖也算应景。
化学与许多学科交叉,很多人将其视为其他学科的工具,有机化学又因为潜在的危险性和污染性更是不受待见。这种负面看法甚至影响到了政府的政策和学生的专业和职业选择,不利于制药、能源和材料等相关产业的发展。
今年的诺贝尔化学奖来得非常及时,本文希望通过梳理有机化学在当前制药工业的应用前景和面临的新课题,改变普通大众对有机化学的误解和负面看法。
撰文|谢雨礼
责编|刘楚
1 有机化学仍是制药行业的核心科技
有机化学,包括天然产物化学和有机合成和方法学等是现代制药起源和发展的基石。现代制药起源于小分子化学药物,比如我们耳闻能详的药物青霉素,阿斯匹林,二甲双胍,青蒿素等。
早期,科学家通过分离天然产物或者有机合成获得这些药物后,依靠动物模型生物活性筛选。到上个世纪五十年代,以DNA双螺旋结构为起点的分子生物学起步,基于靶点的小分子药物发现蓬勃发展,产生了他汀、拉唑、沙星以及抗病毒和肿瘤靶向药等一批改变临床实践的革命性药物。
随后,分子生物学以及生命科技的发展,让我们能够从分子层面更好地理解生命的奥妙,包括疾病的发生发展的机理,干预靶点和治疗疾病的药物形式不再局限于小分子,逐渐多样化。
1976年 ,赫伯特·伯耶(Herbert Boyer)和罗伯特·斯旺森(Robert Swanson)基于DNA重组技术创建了基因泰克(Genentech)公司,这被认为是现代生物制药起步的标志。
今天,以单抗为代表的生物药已经成为一种主流药物形式,逐渐打破化学药的垄断地位,市场份额不断攀升。蛋白偶联药物、核酸、细胞疗法、肠道菌、病毒、基因疗法和基因编辑也急起直追,成为生物医药创新的前沿领域。
这种态势下,有人认为传统化药到头了,其背后的有机化学也没有那么重要了。
这显然是一个误解。 以新冠药物molnupiravir受到业界极大关注为例,小分子新冠抗病毒药物仍然有着不可忽略的优势。
主要原因有:
1
小分子口服的方便性,特别是针对疫情这样的大规模病人群体和长期用药的慢性病;
2
成本的优势,大规模生产和居家治疗的经济性。社会老龄化,各国医保面临巨大压力,某种意义上价廉也是一种临床需求;
3
机制不明的复杂疾病,仍靠表型筛选获得小分子药物;
4
小分子与抗体,核酸和细胞等药物比较,疗效并不是零和的竞争关系,更多的是互相补充。可以说,小分子药物和技术永远也不会过时,仍在纵深发展。
有机化学对于医药行业的重要性也没有下降。一方面,有机化学依然是驱动小分子药物和技术创新的动力;另一方面,有机化学也是新兴生命科技必不可少的赋能工具。
自人工合成尿素以来,有机合成已有近200年历史,技术进展至 “没有合成不了的分子”,但在制药领域远非充分和完善。
作为制药工业创新的发动机,有机化学当前面临许多新课题,包括扩展小分子药物的化学空间、开发环保经济的生产工艺、智能化和自动化以及生物医药新技术的发展等。
2 课题一:扩展小分子药物的化学空间
与天然产物复杂多样的结构比较,目前合成药物所涉及的化学骨架只是冰山一角。现有药物分子大致可以归纳到32种化学骨架,大部分含有常见的20种侧链 [1]。
考虑到起始原料、合成难度、反应条件以及时间和资源的限制,药物化学家一般倾向使用少数可靠通用的化学反应,导致药物分子局限在比较窄的化学空间。
据统计 [2],过去三十年最常用的药物化学反应中,排在前三位的占到所有反应的64%,包括酰胺键的形成, Suzuki−Miyaura偶联反应以及SNAr芳香取代反应。
这种习惯操作导致发现新药的机会减少,也为药物后续开发带来系统性困难。比如,由于金属催化的偶联反应大规模使用,导致联苯结构在化合物库和候选药物分子中过度集中。联苯等平面结构化合物一般溶解性较差,给制剂带来挑战。另外,去除金属杂质也成为工艺开发的重要课题。因此,发现更多简单方便、手性可控、功能和位置选择性高的新反应和新化学对于扩展小分子药物的化学空间至关重要。
过去20年,涌现了不少革命性的化学反应和方法,其中金属催化的不对称氢化和环氧化、烯烃复分解反应、偶联反应,以及有机小分子不对称催化已经获得诺贝尔奖的认可。
就制药行业来说,这还远远不够,药物化学家希望能够自由编辑有机分子,也就是在多种官能团存在下,特异性地插入、删除、交换和构建分子中的原子和官能团 [3]。
近年来,以C-H和C-C活化为核心的分子后期功能化(LSF)朝着分子编辑这一目标迈进了一大步(图1)。比如,亲电的氟试剂NFSI,亚磺酸盐介导的自由基氟烷基化,以及可见光氧化还原催化的CF3偶联反应可以在后期方便地引入药物改造中最受欢迎的氟原子 [4-6]。
以Suzuki−Miyaura、Negishi、Buchwald-Hartwig、Chan-lam和Ullmann为代表的偶联反应是药物化学和工艺化学中构建C-C键和C-N键最常用的反应,近年来也不断进化和改善,增加药物分子常见的氮杂环和极性官能团的耐受性,底物范围不断扩大。
偶联反应的下一个热门方向是季碳(Csp3)的构建,包括sp3-sp2,sp3-sp3,sp3-N 偶联等 [7]。
引入季碳的优点是化学空间呈指数级增加,有望克服药物分子骨架缺乏多样性的瓶颈。然而,其缺点同样明显。季碳引入手性中心,异构体、杂质数量以及工艺开发难度也大幅增加,给药物后续开发带来挑战,因此理想的季碳偶联应该是立体选择性的。
另外一种构建含有多个季碳、类似于天然产物分子骨架的方法是平面结构的还原。比如,上海有机所游书力实验室发展了系列不对称去芳构化反应,可以从芳香化合物直接合成天然产物和药物分子中广泛存在的季碳中心和螺环结构 [8]。多组分反应、多样性导向合成(DOS)、点击化学以及DNA模板化学反应和DNA编码化合物库等策略和技术也在尝试新的反应和方法,保持化合物数量优势的同时克服多样性不够的缺点。
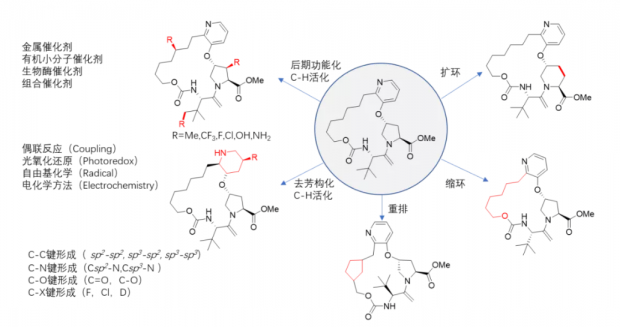
图1 有机小分子编辑图示[3]
3 课题二:开发环保经济的生产工艺
绿色催化剂(有机和生物催化)
工艺开发在某种意义上对化学的要求更高,既要简单经济又要绿色环保。今年诺贝尔化学奖的选择,环保应该是重要的考量因素。不对称有机催化剂避免了重金属的使用,受到制药界的欢迎。最近的例子包括默沙东开发的aza-Michael反应立体选择性的有机催化剂,用于抗病毒药物letermovir的生产 [9]。
除了有机小分子,生物酶也是理想的绿色催化剂。通过蛋白质工程获得的transaminase成功应用于糖尿病重磅药物西他列汀(sitagliptin)的商业化生产激发了制药界开发酶催化剂的热情 [10]。
另外,生物酶在药物化学中也逐渐得到应用,特别是内源性物质及其类似物的合成.最近的例子包括肿瘤免疫药物STING激动剂 [11]。
此前,生物酶的应用一直受限于窄的反应类型,其稳定性、活性和选择性需要通过烦琐的蛋白工程进行优化。酶的定向进化被认为是解决这一问题的方案,2018年被授予诺贝尔化学奖。
四年内两获诺奖,绿色催化剂的重要性可见一斑。
高通量化学实验
已有报道的方法学和催化剂,一般底物覆盖的范围有限,而且经常避免了药物中常见的极性基团。如何就特定的底物快速找到最合适的反应条件和催化剂是工艺化学的重要课题。
借鉴于生物中的高通量筛选,微量高通量实验成为加速药物发现和工艺开发的有用工具 [12]。自动化的微量反应器、高通量分析方法(MISER)、MALDI质谱等技术允许短时间内完成数百个到上千个化学反应。礼来公司2013年就报道了他们的自动化平台,每年能够开展一万六千个100毫克级的、类型多样的反应 [13]。今天,许多CRO公司能够提供高通量筛选反应条件和催化剂的服务。
流动化学(flow chemistry)
流动化学也是当前工艺开发和绿色化学的前沿领域。不同于传统的批次反应,流动化学工艺用泵将物料以设定流速打入反应管连接的多个微型反应器或舱室进行充分混合和反应。
由于这些管或舱室的体积非常小,仅需小量的物料进行连续反应,因此带来诸多益处,。比如减少昂贵试剂的用量、降低溶剂消耗和危废量、改善温度控制、以及提高反应效率和安全性等。
流动化学物料接触表面积大、混合充分,特别适用于光化学和气液两相反应。流动化学还可以嵌入金属的反应管道,直接作为催化剂的来源。比如,诺华以铜管作为催化剂来源,开发了三步92%的收率合成抗惊厥药物rufinamide的工艺路线 [14]。
目前,流动化学工艺的药品生产质量管理规范(Good Manufacture Practice of Medical Products,GMP)日益完善,FDA已经批准了多个药品临床和商业化的连续生产。
礼来是较早研究流动化学的制药公司之一, 于2017年在《科学》杂志上报道了cGMP条件下公斤级连续生产抗肿瘤药物prexasertib的工艺,在标准的通风橱中每天可以生产三公斤原料药,流动化学环保经济的优势展露无遗 [15]。
4 课题三:智能化和自动化
人工智能(AI)是当前最具革命性的赋能技术,逐渐被引入到各个领域中。AI与高通量技术、流动化学、实时监测和在线分析技术日益融合,药物化学和工艺化学正在走向智能化和自动化。
AI在化学中最直观的应用就是设计有机合成路线。Corey提出的 “逆合成分析原理” 获得了1990年诺贝尔化学奖。
Corey在此基础上开创了运用计算机技术进行有机合成设计,为AI的应用奠定了基础。AI路线设计主要有 “基于规则” 和 “机器学习” 两种算法。
基于规则主要是利用已知的化学反应、选择性原理、官能团的耐受性等知识进行推算。化学仍然是半经验科学,基于规则预测的准确性并不高。
近年来基于大数据的机器学习发展更快,得益于电子实验记录本和电子版文献资料的普及。AI机器通过模拟神经网络的深度学习,路线设计的准确性和效率大为提高。
2018年上海大学和德国合作团队在《自然》上报道了一篇AI设计合成路线的工作 [16]。他们基于1250万个发表的化学反应,利用深度神经网络及蒙特卡洛树算法在5秒钟的时间里成功地规划了新的合成路线。
AI技术还可应用于催化剂的设计、反应条件优化以及发现新反应等方面。磷酸前药技术(ProTide)在核苷类抗病毒和抗肿瘤药物中有广泛应用,如Gilead的抗丙肝明星药物索菲布韦。
2017年《科学》杂志报道了一种AI设计的、可高度选择性控制磷酸前药中P手性中心的多功能催化剂 [17]。另外,英国科学家通过AI预测1000种化学试剂组合的反应性发现了4个全新的化学反应 [18]。
结合微量高通量反应和实时分析技术,智能化和自动化的化学合成机器人正在成为现实。2020年《自然》以封面文章的形式报道了一款利物浦大学研究人员开发的AI机器人化学家 [19]。这款机器人可以在实验室中独立工作,像人类一样使用各种化学试剂和实验仪器。然而,与人类不同的是,它除了充电时间每天可以工作21.5个小时。一个有经验的化学工作者每周可以完成10个左右的化学反应,而这个身高1.75米的AI机器人在8天里完成了668个实验,并独立发现一种全新的催化剂。可以预测,5年内商业化的化学合成机器人可能面世。
智能化和自动化是未来发展的趋势,必将大大加快和简化药物研发的过程。有机化学,包括药物和工艺化学的研究不能局限于烧瓶,需要开展更多的流管和微反应器反应,并与设备和自动化工程师广泛合作,以适应机器协助和智能化学的需要。
5 课题四:生物医药新技术发展的需求
如果从还原论的角度看,生命的本质是无机离子、有机小分子、多肽、蛋白质,核酸、脂类和多糖等生物分子在细胞和组织环境下的化学反应和相互作用。
由此衍生的生物医药新技术当然离不开有机化学。生物体系和生物大分子的存在,使得生物正交化学(Bio-orthogonal chemistry)和邻近效应化学(Proximity-Directed Chemistry)成为两个重要方向。
生物正交化学是指能在真实或者模拟的生物体系中即时发生但不干扰内源性生物化学过程的化学反应。最具代表性的就是点击化学(Click Chemistry),包括叠氮与炔烃的加成反应、硝酮与环炔烃的反应、醛或酮形成肟或腙的反应、四嗪与环状烯烃或环状炔烃的狄尔斯-阿尔德反应,基于异氰化物的点击反应,以及四环烷偶联反应等。这些反应使得对细胞中生物分子的实时研究成为可能,广泛应用于分子探针、靶点鉴定和连接子的构建。
相反,邻近效应的作用可以促进药物与靶点发生化学反应,或者诱导内源性生物化学过程从而达到治疗疾病的目的。不同于烧瓶中的化学,邻近效应,比如小分子与蛋白质的结合,可以大大提高有效底物浓度。而且,分子之间的碰撞不是随机的,具有定向效应,选择性大大提高。邻近效应化学在小分子共价抑制剂、PROTAC技术、ADC、核酸和CART小分子开关等新技术中得到广泛应用。
共价抑制剂
近年来,生物科技在资本的催动下突飞猛进,而传统有机化学,包括生物体系中的新化学发展步伐有所滞后。比如,共价抑制剂正在成为小分子药物的主流。
作为共价抑制剂的弹头(Warhead),必须满足以下几个条件:1)具有成药性,比如合理的溶解性、化学和代谢稳定性等;2)合适的反应性,足够惰性而能耐受复杂的生物体系,同时在邻近效应的诱导下能够快速捕捉目标残基;3)高度选择性,一般是由邻近效应和蛋白微环境(PH值和疏水性)决定。已知的共价弹头包括迈克尔受体、磺酰氟、二硫键、α-氰基丙烯酰胺和酮羰基等,其中比较成功的弹头还只有靶向半胱氨酸巯基(Cys)的迈克尔受体丙烯酰胺(图2)。靶向氨基和羧基的共价抑制剂还非常少见。
药物创新对新弹头的需求非常急迫。比如,KRAS是癌基因之王,超过三分之一的肿瘤病人携带KRAS突变。携带KRAS G12C突变(12位氨基酸Gly突变为Cys)的肺癌病人今年迎来了革命性药物AMG-510的上市,该药物就是靶向KRAS突变蛋白12位Cys的共价抑制剂。
因为没有合适的弹头,众多携带其他KRAS突变如G12D和G12V的病人目前仍没有理想的药物。另外,目前还没有靶向赖氨酸的理想弹头。赖氨酸是许多靶点的催化残基,理论上靶向催化残基的共价抑制剂不容易耐药(催化残基突变造成失活)。发现新弹头可能需要化学家打破传统思维,比如在模拟蛋白结合口袋的反应器中寻找新反应。这个环境与传统的有机溶剂和烧瓶完全不同,需要考察邻近效应、定位效应以及环境中其他残基参与的催化效应等。比如,AMG-510与12位巯基发生共价反应时,旁边10位赖氨酸的催化至关重要,这是该药物对KRAS G12C蛋白高度选择性的重要原因 [20]。
分子胶和PROTAC
分子胶和PROTAC是前沿的小分子技术,他们与目标蛋白和内源性蛋白降解酶形成三元复合物结构,诱导目标蛋白降解或者抑制目标蛋白的功能。
经典的PROTAC分子包括三部分:靶向目标蛋白的弹头、连接子和招募蛋白降解酶的结构。PROTAC分子量经常达到800以上,成药性较差。虽然已有成功的案例,比如Arvinas公司靶向降解雄激素受体(AR)和雌激素受体(ER)的临床药物ARV-110和ARV-471,但如何系统合理地设计和发现类药的PROTAC成为业界的难题,其中可能涉及到的有机化学是重要的研究方向。
基于碎片的药物设计和发现值得借鉴。比如,可以将目标蛋白和降解酶与特定设计的分子碎片在模拟的生物体系中孵育,通过邻近效应和生物正交反应自动产生合理的PROTAC分子。
抗体偶联药物(ADC)
日本第一三共研制的、治疗乳腺癌的Her2 ADC药物DS-8201获得空前成功,让ADC重新发力成为当前生物医药领域的热门方向。ADC药物也分为三部分,包括毒素/小分子载荷、连接子和单抗。其中毒素和连接子的创新与有机化学密切相关。毒素一般为复杂的天然产物或者合成的高活分子,可以通过前面提到的C-H活化和后期功能化反应进行优化。
ADC连接子一般要求在生物体系中稳定但一旦被肿瘤中特异表达的酶切割或其他条件触发下即能自动释放毒素。如图2所示,目前可供选择的自裂解连接子并不多。另外,连接子化学不但要耐受蛋白质和复杂毒素分子中的各种官能团,而且涉及两种不同的溶媒,与毒素连接可以在有机溶剂中进行而另一头连接单抗则需在水中进行。单抗一般含有多个可供连接的残基,连接子如何与单抗定点均一反应是ADC化学面临的难点。
针对这些难题,学术界和工业界已取得不少进展。比如,非天然氨基酸的引入允许单抗与毒素通过生物正交点击反应连接。蛋白质N端与C端的特异性生物正交反应也有应用于ADC的潜力,比如最近报道的氨醛缩合和去羧基烷基化反应 [21,22]。另外,金属催化的水溶液相容的C-H活化和巯基偶联反应也有报道 [23,24]。
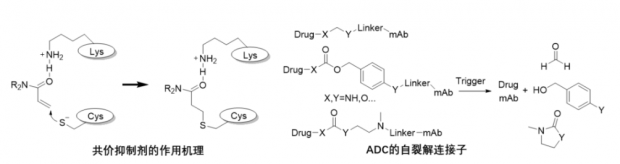
图2 共价抑制剂和ADC的连接子
核酸药物
核酸药物经过了几十年的发展,最近迎来了一个新的发展高潮,有望成为继小分子和单抗之后的第三大药物。特别是mRNA新冠疫苗的成功,让核酸技术几乎家户喻晓。
核酸药物发展面临的技术障碍是药物递送和免疫原性的问题。而当前的两个解决办法,化学改造和药物递送技术都离不开有机化学。比如,mRNA疫苗研发中被认为足以获得诺贝尔奖的创新其实就是通过核苷酸碱基的化学改造发现了假尿嘧啶,引入假尿嘧啶的mRNA具有正常功能但可以躲避免疫系统的识别 [25]。
如图3所示,核酸的化学改造按部位分三类:碱基,糖环和连接基团磷酸的改造。到目前为止,最具突破性的改造都是几十年前的化学发明,包括磷酸基团中的一个氧(PO)换成硫(PS)和糖环2位修饰。寡核苷酸链的固液相合成和酶促合成也相对成熟,但仍有优化的空间,比如提高长链寡核苷酸的合成产率,避免不稳定的三价磷化学而快速构建磷酸二酯骨架的新方法等。核酸技术的蓬勃发展显然需要更多的新骨架和新化学。
PS对核酸药物来说必不可少,因为硫原子的疏水性增加了药物的血浆蛋白结合率,从而大大改善了核酸的药代动力学性质。然而,PS给核酸药物带来了一个挑战,因为P手性中心的引入,目前的核酸药物实际上是多个异构体的混合物。比如,首个治疗脊髓性肌萎缩症(SMA)的反义核酸药物Spinraza包含超过10万个异构体。
2017年,哈佛大学科学家报道了一种控制PS手性的方法,他们不对称合成了含有524288个手性中心的反义核酸药物 mipomersen,而且通过动物实验证明了手性纯的药物疗效优于混合物 [26]。这方面最有突破性的工作是著名有机合成化学家 Phil Baran 与BMS合作发现的立体选择性构建PS磷酸二酯键的试剂PSI(图3,[27])。
早期核酸的递送主要是病毒载体和高分子材料,近年来逐渐被更加高效的脂质纳米颗粒(LNP)所代替。新型的可离子化脂类分子DODAP,DODMA和MC3等得到广泛应用,比如第一个上市的siRNA药物Patisiran就是使用的MC3-LNP技术。LNP颗粒只能有效进入空隙较大的组织且过敏反应严重。这些缺点使得开发新的递送材料和技术变得十分迫切。偶联递送技术在核酸药物中的应用也非常广泛,特别是肝靶向的GalNAc技术是核酸药物快速发展的主要推动力。Alnylam开发的靶向PCSK9的降脂小核酸inclisiran就是使用了GalNAc技术,其安全性和便利性甚至超越了口服小分子,被诺华97亿美元收购。无论是开发新材料还是新的偶联技术,有机化学是关键的创新驱动力。
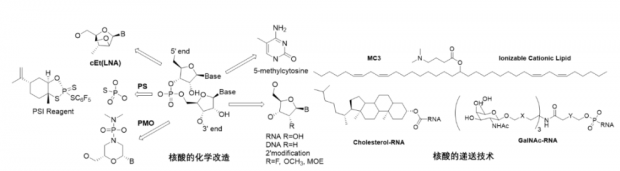
图3 核酸的化学改造和递送技术[27]
其他
多肽也是常见的药物形式,如胰岛素和GLP-1激动剂等。最近,环肽、双环肽以及多肽偶联药物成为热点。针对不可成药靶点开发双环肽的Biocycle公司业界非常知名。构建环肽的反应也是有趣的研究方向 [28]。随着测序成本的下降,DNA编码化合物库技术(DEL)发展非常迅猛。DEL可以方便地生成高达百亿级的化合物,但由于缺乏与水溶液,以及不稳定DNA分子相容的化学反应,其多样性不足的问题一直没有得到很好的解决。DEL化学显然是有机化学将来的重要方向之一。另外,细胞治疗和基因编辑有安全性的担忧,学术界已经在尝试开发小分子开关和解毒剂,因此有机化学也将是这些革命性技术的赋能工具之一 [29]。
结 语
综上所述,有机化学在制药行业仍然发挥着核心科技的作用,今年获得诺贝尔奖实至名归。同时,生物医药新技术爆发给有机化学提出了许多新的课题和方向。笔者是南开大学化学系92级学生,谨以此文献给南开化学100周年庆,祝愿南开化学再创辉煌。
参考文献:
1. Jonas Bostrom, et al., Expanding the medicinal chemistry synthetic toolbox. Nat Rev Drug Discov 2018 Oct;17(10):709-727
2. Ranjan Jana, et al., Analysis of Past and Present Synthetic Methodologies on Medicinal Chemistry: Where Have All the New Reactions Gone? J Med Chem 2016 May 26;59(10):4443-58
3. Kevin R Campos, et al., The importance of synthetic chemistry in the pharmaceutical industry. Science 2019 Jan 18;363, 6424
4. K. Yamamoto et al., Palladium-catalysed electrophilic aromaticC-H fluorination. Nature 2018,554, 511–514
5. CA. Kuttruff,et al., Late-Stage Functionalization of Drug-Like Molecules Using Diversinates. ChemMedChem 2018, 13, 983–987
6. J. W. Beatty et al., Photochemical Perfluoroalkylation with Pyridine N-Oxides: Mechanistic Insights and Performance on a Kilogram Scale. Chem 2016, 1, 456–472
7. David C Blakemore, et al., Organic synthesis provides opportunities to transform drug discovery. Nat Chem 2018 Apr;10(4):383-394
8. Chun-Xiang Zhuo,et al., Catalytic Asymmetric Dearomatization Reactions. Angew. Chem. Int. Ed. 2012, 51, 12662 – 12686
9. Cheol K Chung,et al., Asymmetric Hydrogen Bonding Catalysis for the Synthesis of Dihydroquinazoline-Containing Antiviral, Letermovir. J Am Chem Soc 2017 Aug 9;139(31):10637-10640
10. C. K. Savile et al., Biocatalytic asymmetric synthesis of chiral amines from ketones applied to sitagliptin manufacture. Science 2010,329, 305–309
11. MD. Altman et al., Cyclic Di-Nucleotide Compounds as STING Agonists, WO2017/027646A1
12. T. Cernak et al., M Microscale High-Throughput Experimentation as an Enabling Technology in Drug Discovery: Application in the Discovery of (Piperidinyl)pyridinyl-1H-benzimidazole Diacylglycerol Acyltransferase 1 Inhibitors. J. Med. Chem. 2017,60, 3594
13. AG.Godfrey, et al., A remote-controlled adaptive medchem lab: an innovative approach to enable drug discovery in the 21st Century. Drug Disc. Today 2013, 18, 795–802
14. P. Zhang, M. G. Russell, T. F. Jamison, Organic Process esearch & Development 2014, 18, 1567–1570.
15. Cole, K. P. et al. Kilogram-scale prexasertib monolactate monohydrate synthesis under continuous-flow CGMP conditions. Science 2017,356, 1144–1150
16. Segler MHS, et al., Planning chemical syntheses with deep neural networks and symbolic AI Nature. 2018 Mar 28;555(7698):604-610
17. DA. DiRocco et al., A multifunctional catalyst that stereoselectively assembles prodrugs. Science 2017,356, 426–430
18. J. M. Granda, et al., Controlling an organic synthesis robot with machine learning to search for new reactivity. Nature 2018,559, 377–381
19. Burger B, et al., A mobile robotic chemist Nature. 2020 Jul;583(7815):237-241
20. Hansen R,et al., The reactivity-driven biochemical mechanism of covalent KRAS G12C inhibitors. Nat Struct Mol Biol 2018 Jun;25(6):454-462
21. MacDonald JI,et al., One-step site-specific modification of native proteins with 2- pyridinecarboxyaldehydes. Nat. Chem. Biol. 2015, 11, 326–331
22. S. Bloom et al., Decarboxylative alkylation for site-selective bioconjugation of native proteins via oxidation potentials. Nat. Chem. 2018, 10, 205–211
23. Zhou, Q. et al. Bioconjugation by native chemical tagging of C–H bonds. J. Am. Chem. Soc. 2013,135, 12994–12997
24. Vinogradova, EV, et al., Organometallic palladium reagents for cysteine bioconjugation. Nature 2015,526, 687–691
25. Katalin K, et al.,Suppression of RNA recognition by Toll-like receptors: the impact of nucleoside modification and the evolutionary origin of RNA. Immunity 2005 Aug;23(2):165-75
26. Naoki Iwamoto, et al., Control of phosphorothioate stereochemistry substantially increases the efficacy of antisense oligonucleotides. Nat Biotechnol 2017 Sep;35(9):845-851
27. Knouse KW,et al., Unlocking P(V): Reagents for chiral phosphorothioate synthesis, Science 2018 Sep 21;361(6408):1234-1238
28. C. Heinis, et al., Phage-encoded combinatorial chemical libraries based on bicyclic peptides. Nat. Chem. Biol. 2009,5, 502–507 (2009).
29. Greta Giordano-Attianese, et al., A computationally designed chimeric antigen receptor provides a small-molecule safety switch for T-cell therapy. Nat Biotechnol 2020 Apr;38(4):426-432
话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。




 京公网安备 11010502034662号
京公网安备 11010502034662号 