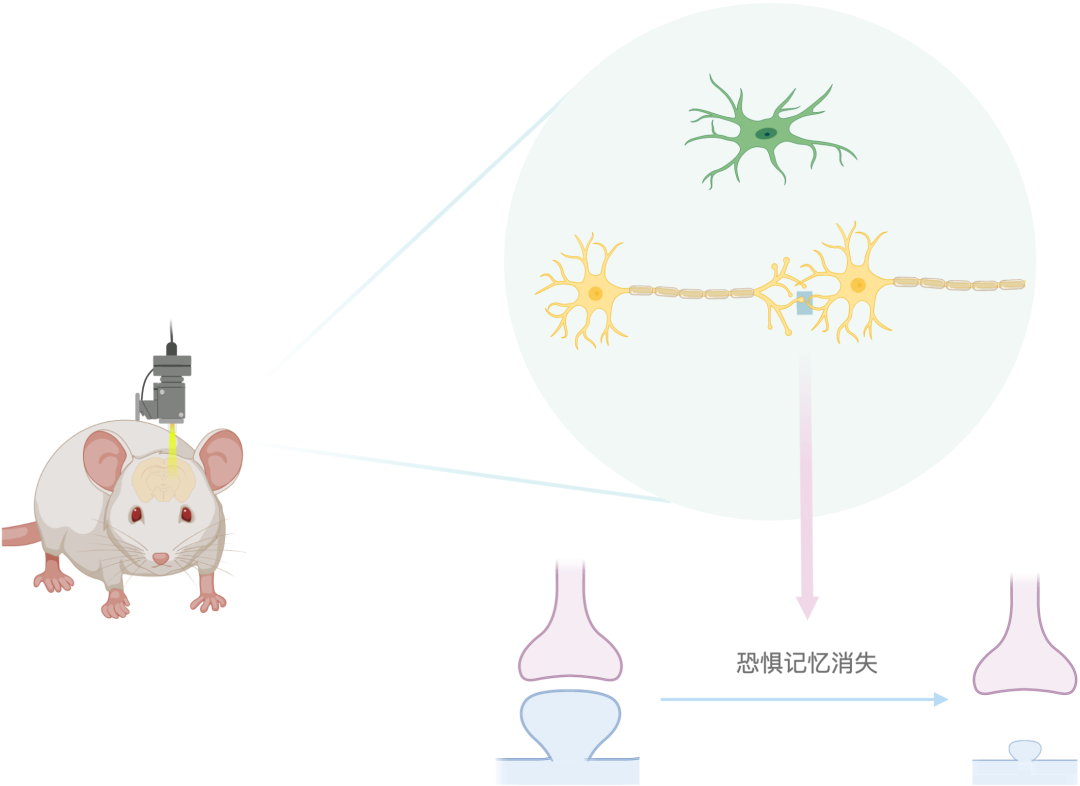
京都大学一研究团队搭建全新神经光学平台,通过光遗传技术干扰树突棘内蛋白间结合,改变突触强度,从而实现小鼠在体恐惧记忆的特异性抹除。本文作者制图。
导 读
京都大学研究团队以好莱坞电影《黑衣人》中用发光装置抹除记忆的桥段为灵感,搭建全新神经光学平台成功实现对小鼠记忆的特异性抹除,并揭示早期记忆形成的时空轨迹。近日,这项研究在《科学》杂志发表。
撰文 | 徐玥 柳昀哲
责编 | 冯灏
“记忆是智慧之母”,早在古希腊时期,人们就已将记忆女神——摩涅莫绪涅,颂作艺术与科学缪斯之母。
1、记忆知多少
千百年来,人类依靠记忆积累经验、依托记忆习得技能征服大自然,从而有如今人类文明的枝繁叶茂、欣欣向荣。人类若失去记忆能力,过去和现在所接受、贮存的信息,都将泯灭于时间长河中,一去不复返,经验与技能亦将荡然无存,一如著名的患有顺行性遗忘症的亨利·莫莱森(Henry Molaison)所泣那般,“每天都像是大梦初醒不知身在何处”。
记忆的重要性不容置喙,但很长一段时间内,人类对记忆形成与巩固的认识极为有限。
19世纪,神经解剖学家圣地亚哥·拉蒙-卡哈尔(Santiago Ramón y Cajal)提出神经元理论,该理论认为神经系统是单个细胞(神经元)的集合,它们相互连接形成一个网络,奠定现代神经科学的基础。并于1894年在 Croonian Lecture 一书中进一步提出,记忆可能储存在神经元与神经元之间的连接中。
1949年,作为对卡哈尔思想的回应,神经心理学家唐纳德·赫布(Donald Hebb)进一步提出赫布理论(Hebbian Theory),“当神经元A的轴突与神经元B很近并参与了对B的重复持续的兴奋时,这两个神经元或其中一个便会发生某些生长过程或代谢变化,致使A作为能使B兴奋的细胞之一,它的效能增强了”,即大脑可能通过加强已存在的神经元间的联系来提高其信息交流的效率,记忆可能存储在神经元不同强度的连接之间。这也体现了突触可塑性——神经元间的突触可能随着持续重复的刺激而导致传递效能的增加。
上述假设虽然在理论上成立,但受早期实验条件的限制一直未能得到验证,直至1966年,生理学教授泰耶·勒莫(Terje Lømo)首次在兔海马体中发现了长时程增强(long-term potentiation, LTP)作用。长时程增强是发生在两个神经元信号传输中的一种持久的增强现象,能够同步刺激两个神经元,进而改变两者之间的突触强度。勒莫观察到,对突触前纤维施加高频刺激时,突触后细胞对该刺激的反应会增强,且这种增强效果会持续一段时间。后续研究通过基因敲除或转基因等方法,使得小鼠海马CA1区的LTP不能被诱导,观察得到小鼠的空间记忆能力受损,而在LTP被诱导能力恢复后,其空间记忆能力也实现好转。这证实了LTP在陈述性记忆的形成具有直接作用。
关于记忆,目前神经科学主流观点认为,其宏观上存储于一大群神经元相互之间形成的连接网络,微观上受单个突触效能改变的影响,而LTP被普遍视为构成记忆基础的主要分子机制之一。
LTP对记忆的形成与巩固至关重要,那么,特定记忆于何时位于大脑的何处也许能够通过探测细胞经历LTP的动态时空特征知晓。近日,京都大学Yasunori Hayashi课题组通过搭建全新神经光学平台操控CFL(cofilin,肌动蛋白解聚因子,一种对突触功能至关重要的蛋白)的活性,阻碍LTP作用,从而在小鼠中实现记忆的靶向性抹除。该成果2021年11月11日发表在《科学》杂志上 [1]。
谈到该操纵记忆的神经光学平台的设计灵感,该研究第一作者、京都大学助理教授后藤明弘笑着提及好莱坞电影《黑衣人》,“影片中,黑衣人用一个发光装置抹除了记忆,将黑色西装和墨镜换成白色实验服和护目镜的我们,实际做着类似的事。” [2]
2、神经光学抹除平台
该技术具体是如何实现记忆抹除的呢?让我们来一探究竟。
树突棘中actin(肌动蛋白)的快速聚合与长时程增强(LTP)的早期阶段相关。上文提及的技术核心——CFL(肌动蛋白解聚因子),因与F-actin结合,一同在树突棘顶部积聚。有趣的是,当CFL以较低化学浓度与F-actin结合时,CFL会切割F-actin,致使F-actin解聚;反之,当CFL与F-actin以较高浓度结合时,两者形成cofilactin耦合物,稳定F-actin。并且,诱导sLTP会促进CFL和actin的相互作用,与cofilactin耦合物的形成一致。
因此,研究人员假设,失活CFL将引发树突棘中cofilactin耦合物的不稳定,从而实现对sLTP的选择性抹除。
研究人员运用基因编辑技术,借助腺相关病毒(AAV)递送表达CFL-SN融合蛋白(CFL与光敏感蛋白SuperNova融合),以光敏感蛋白SuperNova(SN)实现活细胞中特定分子的CALI(发色基团辅助光失活)。在特定波长的光照下,SN会产生一种特殊类型的活性氧,使与其融合的蛋白质失活,该技术中即失活CFL。
在非神经元细胞中表达CFL-SN融合蛋白,光照诱导CALI抑制细胞依赖actin的运动,与失活CFL效果一致,说明光照诱导CALI失活CFL与直接失活CFL效果一致,可降低actin稳定性。
那么,根据CFL与F-actin结合存在的依据浓度变化的协同性,CFL-SN的CALI除了会引起自身与F-actin解聚,是否也会引发其余CFL与F-actin解聚呢?
研究人员借助CFL-GFP(绿色荧光蛋白)融合蛋白,实时动态观测,证实CFL-SN的CALI也会引发其余CFL与F-actin的解聚。将CFL-SN、CFL-GFP两种融合蛋白共表达于神经细胞海马切片培养物CA1锥体细胞后发现,当定点释放谷氨酸引发sLTP后,可观察到CFL-GFP的快速聚集;在引发sLTP后诱导CALI,CFL-GFP的聚集与树突棘容量的增大均被逆转(图1A、B)。
sLTP常伴随着树突棘内actin更新速度的减慢。为进一步验证CFL增多及其后续引起的cofilactin耦合物形成是否参与该过程,研究人员通过使用光活性GFP(PAGFP),将其与actin融合形成PAGFP-actin融合蛋白,检测CFL-SN的CALI是否可以恢复actin的更新速度。实验结果显示,诱导sLTP发生后,actin在树突棘内的更新速度减缓;而当sLTP诱导后进行CALI后,actin更新速度恢复,树突棘体积也恢复到基线水平(图1C)。
诱导CALI后仍可在同一树突棘再诱导出现sLTP等实验说明,该技术通过光照诱导CALI失活CFL、破坏cofilactin耦合物稳定性、恢复actin更新速度成功实现对sLTP的高效清除。并且,消除效果准确稳定、不影响基础转运速度、不干扰后续长时程增强作用的形成。
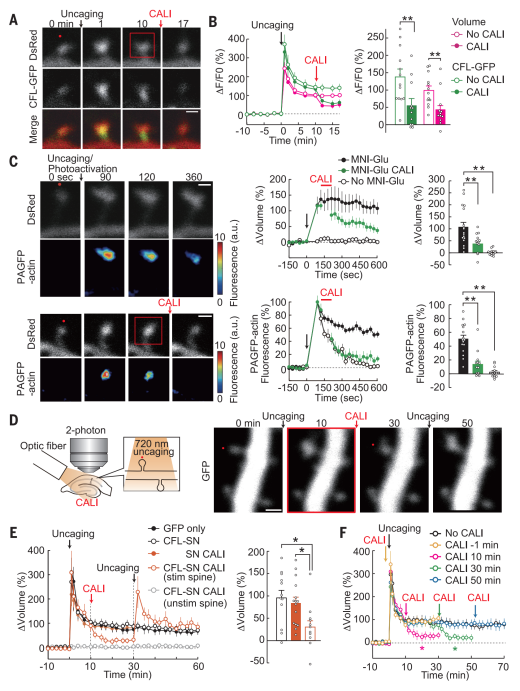
图1 光照诱导抹除sLTP | 图源[1]
3、在体抹除记忆
实验团队于离体状态对所开创技术验证其有效性、稳定性、特异性之后,在小鼠中展开了抹除恐惧相关陈述性记忆的在体研究。
该实验使用抑制性回避学习训练评估记忆。抑制性回避学习训练利用啮齿类动物偏爱黑暗环境的天性,当小鼠被置于亮隔间,它们通常会在30秒内穿过打开的门进入暗隔间,每穿门一次便会遭受一次足部电击(图2B)。
实验结果显示,表达CFL-SN的小鼠在第一天经历电击后的2分钟诱导CALI,会在第二天表现出更短的穿门时间,即此恐惧记忆形成受损。
为测试被抹除记忆的场景特异性,研究人员使用两个大小、地板材质、视觉线索、光照颜色、气味等皆不同的抑制性回避装置用于测试(图2E)。具体来说,小鼠首先被放于场景A,不进行CALI处理。两个小时后,小鼠被放于场景B,在B中短(未延长)的穿梭时间说明小鼠能成功区分场景A、B。在场景B中,小鼠会在遭受电击后接受CALI处理。第二天,经历CALI的小鼠在场景B表现出更短的穿梭时间,但在场景A中与未接受CALI的小鼠表现出相似的穿梭时间,暗示仅有关于场景B的记忆被抹除,该神经光学系统能对记忆进行特异性消除。
总的来说,在体实验结果表明,所创神经光学平台通过操控CFL活性,阻碍LTP,成功实现对记忆的靶向性抹除,且稳定有效,与现有技术相比不涉及抗体等其余干扰,可以高效开展在体研究。
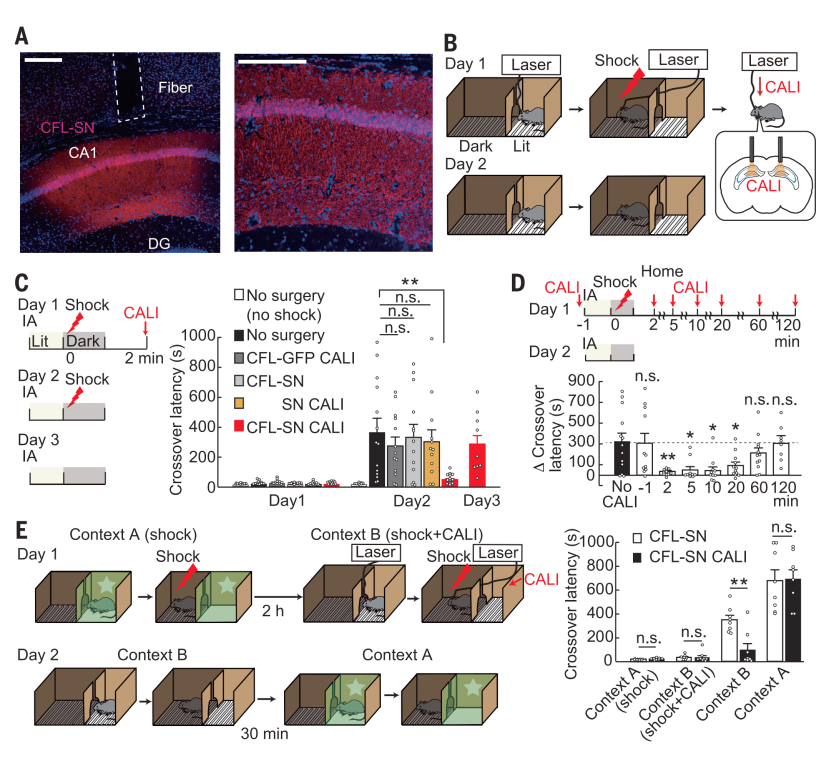
图2 光照诱导抹除记忆,图源[1]
抑制LTP实现靶向性抹除记忆的成功,为追踪记忆的形成与巩固提供了新的契机与手段。
当桌上摆放着一份重要文件,你可能会随后将它归存到保险箱。我们的记忆也上演着类似的情景:它们首先出现在大脑的一部分(海马),而后转移至另一部分(大脑皮层)以长期存储,即记忆巩固。
海马在清醒和睡眠状态(offline state)下都存在着神经活动重放现象,这一过程被认为是记忆巩固的基础,且有研究表明不同状态下对相同事件的神经活动重放可能扮演不同的角色。然而,目前仍不清楚这样的神经活动是否会引起事件发生时及不久后(online state)之外LTP的产生,以及若会引起,会于何时何处发生。
研究人员通过在小鼠遭受电击回笼2小时后,每隔20分钟对小鼠进行光照处理,或于第二天进行光照处理,发现offline LTP可拓展至学习后的2小时,但其参与的巩固过程在海马中限于一天内(图3B)。随后借助在线分析脑电图(EEG)和肌电图(EMG)数据自动确定动物的行为状态,对清醒和睡眠状态的offline LTP进行进一步区分,发现在睡眠期间诱导CALI时,记忆受损;而在清醒时期诱导CALI时,记忆未受明显影响(图3C)。另外,当CALI仅在第二天睡眠期间施行时,也不再对记忆有损害(图3D)。
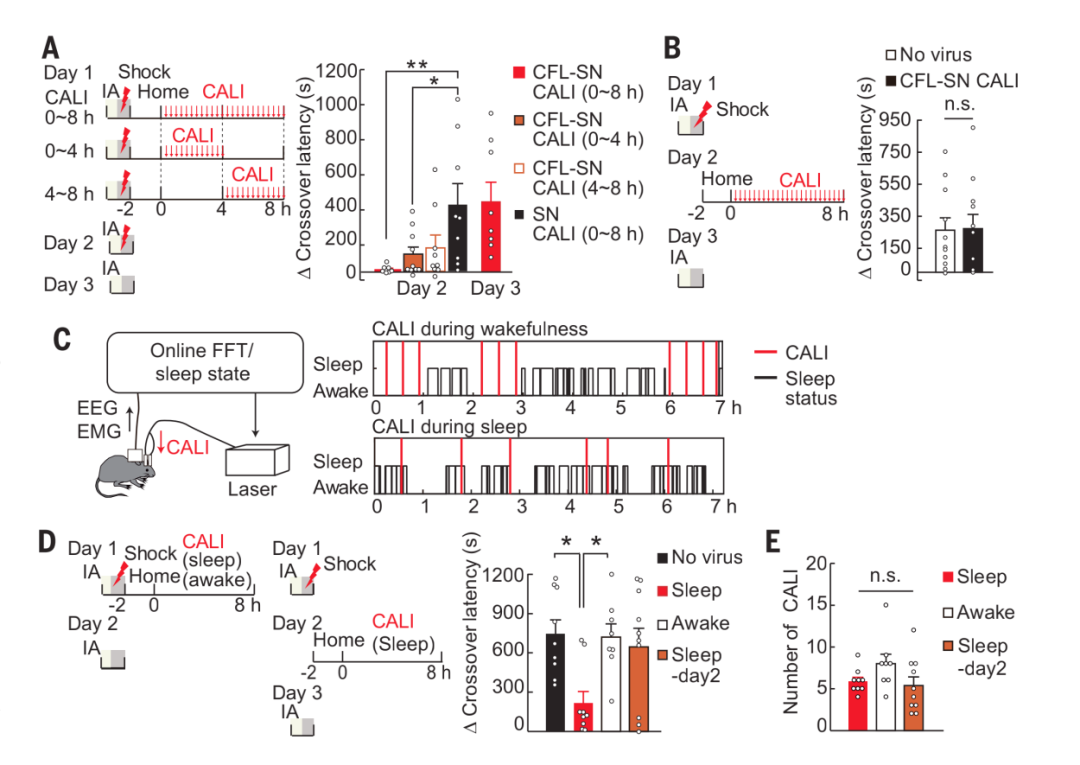
图3 海马睡眠期间的offline LTP对记忆至关重要 | 图源[1]
为进一步探究记忆的转移,研究人员于第二天小鼠睡眠期间对前扣带皮层(ACC)进行了光照处理诱导CALI,其记忆被抹除,证实第二天睡眠期间前扣带皮层处的LTP对于记忆的进一步稳定是必需的,所习得记忆在学习后的第二天经由LTP从海马转移至皮层。
另外,研究者发现online LTP和offline LTP对海马处记忆表征有着不同的作用,前者控制神经元的选择性放电,后者更注重神经元的同步发放。正如后藤明弘所说,“通过光照靶向诱导操作清除局部LTP能明显抹除记忆,这是出乎意料的”。
但无疑也是令人振奋的。研究通讯作者、京都大学教授林康纪(Yasunori Hayashi)指出,“该技术为细胞水平分离记忆的时空分布提供了方法和契机” [2],该文揭示第二天睡眠期间前扣带皮层处的LTP对于记忆的进一步稳定是必需的,同时,本文发现的学习后睡眠时期对记忆的重要性与以往睡眠促进记忆巩固的研究结论相符。
虽然关于记忆的形成与巩固这一领域仍迷雾重重,但随着技术的不断开发,设计的不断优化,相信人类终有一天能彻底破解。
作者简介
徐玥,北京协和医学院、北京脑科学与类脑研究中心 博士生
柳昀哲,北京师范大学、北京脑科学与类脑研究中心 双聘研究员
参考文献:
1. Goto, A., Bota, A., Miya, K., Wang, J., Tsukamoto, S., Jiang, X., Hirai, D., Murayama, M., Matsuda, T., McHugh, T. J., Nagai, T., & Hayashi, Y. (2021). Stepwise synaptic plasticity events drive the early phase of memory consolidation. Science (New York, N.Y.), 374(6569), 857–863. Kyoto University. (2021, November 17). New optical technology spotlights how memories move in mouse brains during sleep. ScienceDaily. Retrieved December 12, 2021 from
0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 