成年人的大脑里面还有没有神经干细胞存在?| 图源:
导 读
成年人的大脑里面还有没有神经干细胞存在,这些神经干细胞是否还能继续生成新的神经元?过去10多年,业内人普遍认为,存在;然而,近几年的一些研究却认为,不存在。
一般来说,证明存在,比较简单;证明不存在,可能工作量就比较大,需要更严格的鉴定标准,经得起统计学方面的考验。
无论如何,当神经发育结束后,成熟的人类大脑一共有大约800亿神经元和800亿神经胶质细胞,要在所有这些细胞中寻找神经干细胞,是很有挑战的。
相关阅读:争鸣 | 复旦神经科学家:成年人脑内不再有新生神经元
撰文|钱诚 周峰泉(约翰霍普金斯大学)
责编|邸利会
1、为了治病和变聪明
成年人大脑中是否有神经干细胞,科学家关注这个问题,有两个简单的理由。
首先,如果成年人的大脑中还存在着神经干细胞,并且能够通过某种方法刺激这些神经干细胞分裂增殖,并重新分化为神经元,可能是一种非常有效的治疗神经损伤和神经退行性疾病的新疗法。
神经元受到损伤或疾病侵扰后会死亡。许多神经退行性疾病,如阿尔茨海默症,帕金森综合症等疾病,主要病理后果是神经元的死亡。神经元的死亡是导致认知功能下降的主要原因。
因为神经元无法重新分裂产生新的神经元,目前针对人类大脑损伤或者神经退行性疾病,基本缺少有效的治疗方法。
另外,过去大概20年,许多实验室研究了成年小鼠大脑中神经干细胞的功能。
他们发现,在成年小鼠大脑中的海马区部位有不少的神经干细胞。这些成年神经干细胞与神经发育期间的神经干细胞相似,可以继续分裂,产生更多的神经干细胞,同时也可以分化成神经元和神经胶质细胞,且分化后的神经元可以整合到已经形成的神经环路中发挥功能。
另外,其他一系列研究表明,如果对小鼠进行运动或智力训练,小鼠的许多高级认知功能,如学习和记忆能力,就会有明显增加。
大家一致认为,小鼠大脑中的海马区域是负责学习和记忆的关键脑区,进一步的研究表明,在海马区域的神经干细胞对小鼠认知功能的提高起着非常重要的作用。
基于这些研究结果,大家认为,成年动物大脑中存在的神经干细胞及其产生新生神经元的能力,也是大脑神经可塑性的一个重要组成部分。
由此推断,如果成年人的大脑中也存在类似的神经干细胞,也可以通过运动或者智力训练来增加自己的认知能力,或者说变得更加聪明。
2、如何鉴定人类大脑神经干细胞?
人类大脑的样品主要有两个来源, 最常见的是由死者家属捐献的大脑组织。另外,部分患有脑部疾病的病人在治疗过程中需要做部分脑组织切除手术,切除出来的大脑组织,经病人及其家属同意,也是样品的另一个主要来源。
由于样品来源的特殊性,对样品进行任何预处理的可能性虽然有,但是很低。总结下来,目前大概有以下几种方法寻找并鉴定人类大脑神经干细胞。
一是,直接寻找神经干细胞。
成年的神经干细胞与胚胎发育期间的神经干细胞基本类似(包括特异性蛋白,所处脑区,和转录组特征等)。神经干细胞可以分裂,且含有一些在神经干细胞中相对特异表达的蛋白质(标志蛋白)。
其次,可以寻找由神经干细胞分化而产生的新神经元。与原有的老的神经元相比,这些新生成的神经元也表达一些相对特异的标志蛋白。
第三种是首先通过标记物来标记所有正在分裂的细胞(如Brdu, Bromodeoxyuridine, 中文名是溴脱氧腺苷。它是DNA中脱氧胸苷的类似物,可以在细胞分裂时参入新和成的DNA中,常用于检测分裂的活细胞),然后过一段时间再寻找含有这些标记物、同时也表达神经元特异性蛋白的细胞。这类细胞就是由神经干细胞分化而产生的神经元。
以上三种方法主要是通过抗体染色实验完成的。
最后,通过对大脑特定区域的细胞进行单细胞测序,可以得到每个细胞样品的转录组数据库。通过对该数据库进行生物信息分析,可以帮助我们鉴定具有神经干细胞转录组的细胞。
虽然实验手段经历了几个技术世代—— 从组织切片原位免疫染色为主、分散细胞染色后通过流式仪计数,到整批细胞混在一起核酸测序(bulk tissue RNA-seq),再到单细胞(核)RNA测序(见下表)—— 关于成年人大脑海马区神经干细胞究竟存在与否,以及有无内源成年神经生发,至今尚没有共识见解。
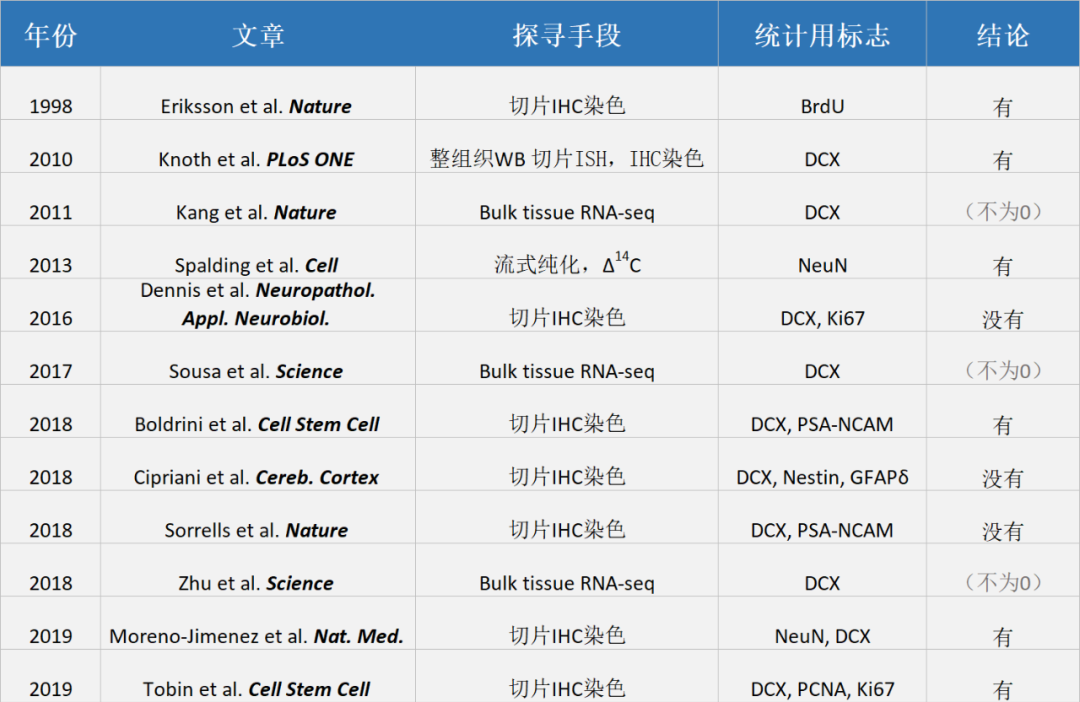
此处我们将所罗列文章的结论笼统地写作“有”还是“没有”发现成年新生神经元。至于结论是“有”的文章中,关于存在数量是多还是少的信息,以及成年人类样品的疾病等背景,大家可以去原文找寻。由于时间有限,我们没有逐个比较这些染色实验中样品准备的技术细节,以及抗体选择、优化是否合理。例如,我们这里不详细讨论样品中神经干细胞或新生神经元特异性抗原暴露充分与否,或者抗体是否非特异性的结合了其它蛋白。同样,BrdU是否可以少量掺入非分裂细胞DNA,或者生物样品准备的技术细节对于14碳同位素分析的影响,我们也不在这里讨论。
科学技术总有瑕疵,但伴随更多数据不断产生,以及多种不同技术的相互辅证(比如FISH RNAscope(RNA原位杂交技术)和multiplex免疫染色(多试几种抗体)联合),技术层面的障碍会越来越小。
如果采用染色的策略,那每一个细胞染出来了就捕获了那个细胞,剩下的就是通过什么标准去给每个细胞身份赋值定性为神经干细胞。
定错了,无非制造两个结果,不是假阳性,就是假阴性。如果不考虑抗体质量糟糕结合了靶目标之外的其它蛋白这种技术障碍,剩下的问题就是——
◢ 需要多少个神经干细胞/新生神经元特异性身份标志物?
◢ 两三个够不够用?
◢ 选定的标志物特异性是否足够强?
◢ 神经干细胞/新生神经元标志蛋白是否也会在某些神经胶质细胞中表达?
◢ 如果表达,通过查看胶质细胞标志物是否可以排除?
◢ 来自小鼠,猴子,幼年人类检测中获得的先验知识,能不能完全照搬的用在成年人脑神经干细胞的探寻?
3、更好的方法
除了经典的细胞标志蛋白染色技术,我们认为通过新技术单细胞测序研究细胞身份应该是一个更准确的方法。
那么,单细胞(核)测序能不能捕获上面通过染色实验(见上表)发现的那些成年人脑神经干细胞(若有)?
理论上应该没问题。
染色实验是通过抗体直接检测蛋白质,而核酸测序是检测编码蛋白的信使RNA。目前默认设置的常规测序深度通常能在每个细胞(核)平均测到3、4千个表达基因,当然增加开销可以测得更深。染色实验一般最多染3、4个蛋白,而且通常这些蛋白标志物表达量不会太低,所以编码它们的RNA应该能被单细胞(核)测序抓到。
如果只关心3、4个基因表达,那么细胞(核)的测序,从某种角度上看就相当于针对20万细胞样品通过检测3、4个细胞标志物来鉴定神经干细胞(此外,除了鉴定细胞类型,单细胞测序结果通过大数据分析也可以推断细胞分裂的情况,能分裂也是干细胞的特点之一)。
那么具体如何通过单细胞(核)mRNA测序鉴定细胞类型?
首先,利用每个细胞平均测到的3、4千个表达基因的转录组为依据,我们可以在相对高数量的维度上通过大数据分析将彼此相似的细胞归并为一类,就是聚类分析。
在捕获细胞(核)数量足够,测序深度良好的情况下,每类细胞还可以再细分成一些亚型。虽然所用软件或计算方法可能不同,聚类分析本身是一个基于关联性的无偏过程。
但对于分出来的每个类别(cluster)的细胞身份认定最终还是人定的,并且这是个极度依赖先验知识的步骤。
具体来说,通过数据分析可以算出每个cluster表达明显高的50到100个基因,再根据这些基因里有什么已知细胞类型的几个标志物来决定这个cluster的身份,最后可以再结合FISH或者抗体染色去复证。
当然这50到100个基因中还有希望发现新颖的,更纯的细胞身份标志物。同理,单细胞测序后的聚类分析也可以重新验证某些传统的细胞身份标志物是否确实不在其它细胞类型中表达(细胞特异性)。比如,2021年Neuron 杂志这篇文章 [1] 就发现在成年人脑海马区中,常用的新生神经元标志蛋白Dcx不仅仅是未成熟新生神经元的标志。
由于人类大脑样品来源不易,大多数情况下只能在单一时间点取样,而不像动物模型那样可以获得几个时间点real-time的样品。但是即使在单一时间点,同一组织内每个细胞的状态也略有差别。换一句说,在一群细胞中会存在处于某个生物过程中不同阶段的细胞亚群。
现有的大数据分析技术可以通过一个称为Pseudo-time trajectory的分析方法从单一时间点取样的单细胞(核)测序数据中,找到这些细胞亚群,从而模拟整个生物过程。
比如,2021年Neuron 杂志这篇文章 [1] 就发现通过分析成年小鼠,猪,恒河猴的单细胞测序结果,可以描绘一条从Neural intermediate progenitor cells(神经干细胞),到新生神经元,再到成熟神经元 (granule cell)的一个神经细胞分化成长的过程。然而在同样条件下,研究者们在成年人类大脑海马区就测不到这个细胞过程。基于此结果,该研究认为在这些人类大脑样品中不存在神经干细胞。
2021年发表在Neuron 杂志这两篇单细胞核测序文章 [1,2] 均聚焦探寻成年人脑海马区的神经干细胞和新生神经元。结果简言之,都没找到。
在成年人海马脑区齿状回区域探寻神经干细胞和神经生发过程,是因为早先实验在成年哺乳动物,比如啮齿目中的小鼠,非人灵长类,以及幼年人类海马区齿状回发现了显著的新生神经元踪迹,或者至少存在神经元生发过程。
至于成年人大脑中神经 “干细胞”,如果存在,目前大家普遍认为它们存在的区域和其它特性与其它动物模型中和幼年人类脑中发现的干细胞类似。这一先入为主的观点是否正确或限制了我们的视野,因为没有先验依据,暂时无法回答,但值得关注。
4、单细胞测序的挑战
单细胞(核)mRNA测序也不是完美无瑕的,通常缺点恰恰出自优点。
单细胞测序同样依赖先验知识来给细胞身份赋值定性。分析的时候选定几个参数之后,聚类是可以由计算机自动计算完成的。但是把每个cluster认定成什么细胞类型、亚型、状态,仍然是需要人为依照先验标志去赋值。
打个比方,如果蒙上眼睛去摸比如20万只动物,每个有3、4千特征值(甚至多些达到上万个特征),就可以把比如大象分成一堆,长颈鹿,绵羊,猫狗,禽类,鱼类各自成堆,分析的细一些还可以把猫和狗,鸡鸭鹅继续分开。
我们之所以能够身份赋值成功,是因为先验知识,我们本来就认识这些动物。试想如果我们原先不认识羊驼这种动物,数量又不大,那就很有可能把比如7、8只羊驼分到绵羊一堆里,也就是假阴性:没有羊驼。
同理,如果成年人脑神经干细胞与小鼠、猪、猴子、人类幼年的这些先验知识都不相似呢?
比如,2021年Neuron 杂志这篇文章 [1] 这20万细胞核已经成功捕获了神经干细胞,但是没有认出来(假阴性),却隐匿在了星形胶质细胞,小胶质细胞,少突细胞,interneuron群里。
好在成年人脑神经干细胞一旦被单细胞测序成功捕获了,随着技术进步可以测更高通量的细胞和测序深度增加(各个平台都有这样新的解决方案推出),这个干细胞cluster理论上应该冒出来。虽然也许这个cluster会与,比如,胶质细胞或者内皮细胞共用很多个标志基因,但测序分辨率够了应该能找到区别。
更为重要的,成年神经元生发作为一个过程,轨迹(trajectory)应该是存在、可测且清晰。
因为如果最终发现某些astrocytes或者microglia类细胞有神经干细胞功能,它们不可能瞬间身份转换成与某种原有成年脑细胞一模一样,所以通过转录组分析应该可以鉴定出来。
就算转录组和蛋白组的聚类和轨迹分析都不能赋值鉴定成年神经干细胞(若存在,且捕获),那还可以尝试基于染色质结构的聚类和轨迹分析,包括增强子enhancer特征,等等。在多组学这个趋势下,单细胞(核)DNA甲基化特征,lncRNA特征,单细胞ChIP-seq也早晚都会进入市场成为有用的工具。
如果以上方法还是无法找到成年神经干细胞,说明什么?
一个可能性是成年人脑中的类干细胞和类神经元生发过程在正常生理状态下处于静息或受抑制状态。
例如,最新的一项研究发现,在成年小鼠大脑的海马区衰老的神经干细胞抑制了其附近正常干细胞的分裂和分化功能。通过化学手段去除老化的干细胞可以大大促进正常神经干细胞的分裂与分化。
同理,成年人类大脑中的神经干细胞可能也是需要某些条件激活的,比如损伤,某种疾病,特定遗传,或者环境背景。这类的调节未必是线性的也许是个动力系统,所以前途仍然是光明的。
随着更多数据的产生,特别是那些染色找到成年人脑神经干细胞的课题组,可应用多组学单细胞(核)测序来确证自己的发现。
旧的bulk tissue mRNA-seq也是个宝库(通常都存在GEO数据库),因为很多是某种背景或者损伤的样品,未必能找到同等的再去做单细胞测序。结合单细胞测序标志库,现在有很多建立的数据分析流程 [3] 可以把bulk-seq做反卷积(deconvolution)看其中各个细胞成分的差异基因。
另外,经常听到的单细胞测序的其它缺陷,比如组织酶解消化过程会改变细胞状态和转录组,或者造成transcripts丢失。我们自己的经验也发现成年动物脑组织酶解消化过程,如果条件没有最佳化,会造成大量细胞丢失。
新推出的一些测序方案也许可以克服这些缺陷,使得测量结果更加原汁原味。
比如,spatial sequencing可以将组织切片的 “像素点” 不经酶消化直接原位转化成 “单细胞” 再测序。又如单细胞测序后通过组织切片FISH RNAscope验证可以找到不受样品消化影响的转录产物。
5、还没有定论
成年人大脑中约有800亿个神经元,以及大约等同或稍多数量的胶质细胞和其它细胞。
严格来讲,要知道这每人1600亿个细胞群体中 “有” 还是 “没有” 神经干细胞和成年新生神经元,如果找到了要下结论 “有”,那么一个关键问题是如何确定找到的细胞是神经干细胞?这1600亿细胞群体中,神经干细胞大概占多少?
如果没找到,下结论 “没有”,那么一个重要的问题是样品的覆盖率和数量是否足够?比如用单细胞测序,每次抽样20万个细胞,要测多少次才能下结论?要考虑是否经得起统计学方面的检验。
在多组学大数据的时代,让成年人脑神经干细胞探寻的子弹再飞一会儿。
背景小知识
所有动物大脑组织的形成都必须要经过一个神经发育(neurodevelopment)的过程。神经发育早期的神经组织,包括大脑,的主要细胞类型就是神经干细胞(neural stem cells)。
这些神经干细胞可以分裂增殖(divide and proliferate),同时它们中的一部分也可以停止分裂而分化(differentiate)成神经系统中的主要两类细胞:神经元(neuron)和神经胶质细胞(glia)。分化后的神经元会生长出神经纤维(axons and dendrites),然后彼此连接形成复杂的神经环路(neural circuits)。由神经元形成的神经环路,通过与各种类型的神经胶质细胞相互作用,就形成了完整的大脑神经网络系统,从而控制各种类型的神经功能。
这些神经功能包括感觉功能,如冷热痛痒,嗅觉,味觉,听觉,视觉功能,运动功能,和各类高级的认知功能。当神经发育结束后,成熟的人类大脑一共有大约800亿神经元和800亿神经胶质细胞,意味着要在所有这些细胞中寻找神经干细胞,是很有挑战的。神经干细胞分化成为神经元是一个不可逆的过程,神经元没有能力重新分裂而产生新的神经元,因此死亡以后也就得不到补充。在人的一生中,神经元数量随着年龄增长而逐渐减少。
与神经元不同,神经胶质细胞在某些特定条件下,如受到损伤以后,可以重新回到能分裂的状态,并产生新的神经胶质细胞。在低等脊椎动物中,如斑马鱼,某种神经胶质细胞,如视网膜中的穆勒细胞,在损伤后会回到神经干细胞状态,从而产生新的神经元和神经胶质细胞。神经胶质细胞的这种功能在哺乳动物中大家普遍认为完全丧失。 在大脑组织发育结束后,为了保证其内部的神经网络系统处于一个相对稳定的状态,从而能够正常行使其功能,成熟后的神经元一般丧失了生长神经纤维的内在能力,同时神经元所处的外部环境也是一个相对抑制的状态。
内外因素协同作用来维护神经网络的稳定运行,这也是哺乳动物大脑损伤或受疾病侵扰后无法再生并修复被破坏的神经环路的主要原因。成熟的神经网络并不是完全固定不变的,所有神经元都具有一定的可塑性(neural plasticity),即神经元之间的连接可以有一定程度的调整(如连接密度和强度等)。已有研究表明神经可塑性对调节各类神经功能或修复神经损伤有很大的作用。
一般情况下,神经可塑性是随着年龄的增长而不断下降, 所以人类在儿童时期可以有更好的能力学习和掌握新的东西,如学习多种语言。另一方面,大脑组织在受到损伤或疾病侵扰后,在儿童时期大脑得到修复的机率也会更大。
参考文献:
1. Frantic D, Skarica M, Ma S, Arellano JI, Tebbenkamp ATN, Choi J, Xu C, Li Q, Morozov YM, Andrijevic D, Vrselja Z, Spajic A, Santpere G, Li M, Zhang S, Liu Y, Spurrier J, Zhang L, Gudelj I, Rapan L, Takahashi H, Huttner A, Fan R, Strittmatter SM, Sousa AMM, Rakic P, Sestan N. Transcriptomic taxonomy and neurogenic trajectories of adult human, macaque, and pig hippocampal and entorhinal cells. Neuron. 2021 Nov 18:S0896-6273(21)00866-7. doi: 10.1016/j.neuron.2021.10.036. Epub ahead of print. PMID: 34798047.
2. Ayhan F, Kulkarni A, Berto S, Sivaprakasam K, Douglas C, Lega BC, Konopka G. Resolving cellular and molecular diversity along the hippocampal anterior-to-posterior axis in humans. Neuron. 2021 Jul 7;109(13):2091-2105.e6. doi: 10.1016/j.neuron.2021.05.003. Epub 2021 May 28. PMID: 34051145; PMCID: PMC8273123.
3. Le T, Aronow RA, Kirshtein A, Shahriyari L. A review of digital cytometry methods: estimating the relative abundance of cell types in a bulk of cells. Brief Bioinform. 2021 Jul 20;22(4):bbaa219.
0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 