
疫苗换代并不简单 | 图源:、
编者按
近日,在国内大规模使用的灭活疫苗生产商——科兴和国药同日(4月26日)获得国家药监局奥密克戎突变株临床批件。5月1日,国药集团宣布正式在树兰(杭州)医院开启临床试验,此前的4月,拿到香港 “奥株” 疫苗临床批准的科兴,也通告将积极开启临床试验。国际上使用较多的mRNA疫苗也已在2022年1月宣布开展临床试验。
目前全球范围内,多种不同技术路线的新冠疫苗如mRNA疫苗、腺病毒疫苗、重组蛋白疫苗及灭活疫苗等,其设计都是基于新冠原始病毒株,随着新冠病毒的不断突变,特别是奥密克戎变种在刺突蛋白上的大量突变,有效性都出现了大幅下降。
那么,开发针对新变种的新冠疫苗是否一定带来有效性的大幅提升?疫情延续两年多来,为何至今没有新一代新冠疫苗面世?药企、科学家和监管机构是如何考量的?知识分子专栏作者周叶斌撰文解读。
撰文 | 周叶斌
责编 | 刘楚
为什么要研发奥密克戎版疫苗?
2020 年末,第一个引起广泛关注的新冠突变株阿尔法出现时,很多人就开始担心针对原始病毒株制作的新冠疫苗会不会受到突变的挑战,需不需要针对不同的突变株制作疫苗。
有没有必要与为什么要研发突变株疫苗这两个问题本质是一样的,可以从疫苗的作用机理——免疫反应的角度来找到相关答案。
疫苗通过激发人体对病原体的免疫反应来起防护作用,即让人体的免疫系统在与真的病原体打照面前就先学会识别病原体。这种识别具有特异性,比如接种了新冠疫苗,得到的免疫保护是针对新冠病毒,不会扩展到流感病毒。
这种特异性的基础是人体免疫系统在分子层面上的差异识别。以新冠疫苗为例,不同技术路线疫苗起防护作用的基础都是针对刺突蛋白的免疫反应。这个免疫识别的过程中,刺突蛋白是所有疫苗共有的关键抗原,而人体免疫系统是在识别该蛋白质上特定的氨基酸序列。
当新冠病毒不断突变时,很多突变发生在刺突蛋白就会导致突变株与原始病毒株的抗原在分子层面上出现差异——刺突蛋白上的氨基酸序列不同导致免疫识别的位点出现差异,而基于原始病毒株的疫苗或自然感染带来的免疫识别,对于突变株就会不那么匹配,防护作用有可能会出现下降,也就是出现免疫逃逸。
非常不幸的是,现在全球的主流突变株奥密克戎恰恰在刺突蛋白上出现了大量突变 [1]:
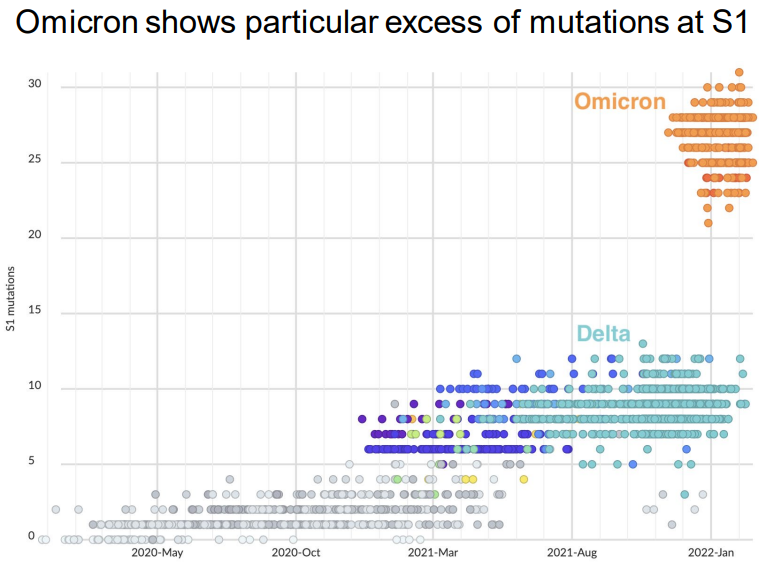 图1 在疫情不同时间段出现的各突变株在刺突蛋白S1亚基上的突变数量 | 图源[1]
图1 在疫情不同时间段出现的各突变株在刺突蛋白S1亚基上的突变数量 | 图源[1]
奥密克戎在刺突蛋白上的大量突变所带来的免疫逃逸,对应了现有疫苗有效性、特别是防感染与防轻症有效性的大幅下滑 [2]:
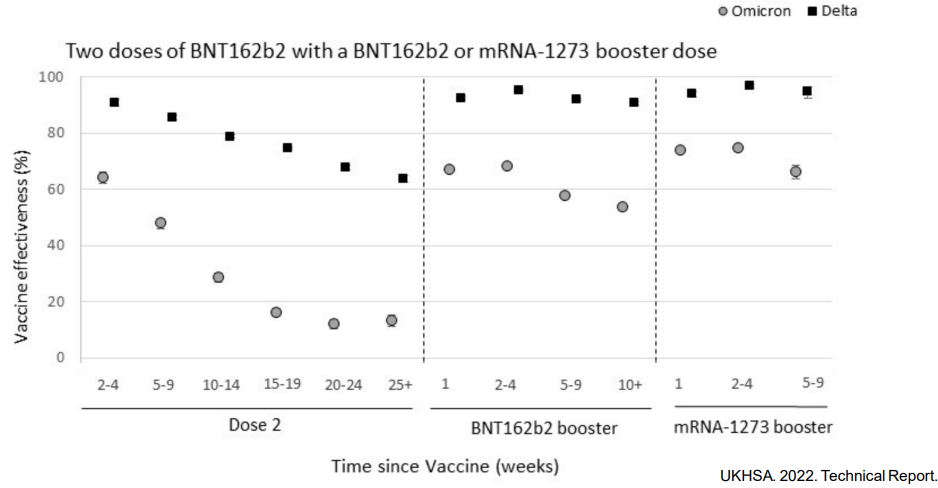 图2 英国公卫部门研究显示相对德尔塔,疫苗对奥密克戎的有效性大幅下滑 | 图源[2]
图2 英国公卫部门研究显示相对德尔塔,疫苗对奥密克戎的有效性大幅下滑 | 图源[2]
研发突变株版本疫苗的逻辑就是:既然疫苗的抗原识别位点上出现大量突变导致免疫逃逸进而影响疫苗有效性,那么反向推导,我们也可以尝试通过改变疫苗设计,让疫苗所用抗原更接近实际流行的突变株,这样或许就能获得更好的疫苗有效性。
现今的主流突变株同时也是免疫逃逸最严重的病毒株奥密克戎,又是这一系列突变株版本里的攻关重点。
另一个考虑是,除了应对眼下的流行株,次世代新冠疫苗还是应对新冠病毒的长远打算的一部分。
疫苗是我们减少新冠重症、死亡的基础手段。香港奥密克戎疫情的研究数据表明,接种疫苗可大幅降低感染者病死风险,而对于未接种疫苗的人特别是高危人群,即便是相对 “温和” 的奥密克戎也是极为危险 [3]。因此,维持疫苗的有效性是防疫的重要支柱。
但与此同时,新冠疫苗中免疫原性最好的部分,也是人体免疫系统打击新冠病毒效率最高的部位——刺突蛋白的S1亚基,碰巧也是迄今新冠病毒株突变频率最高的位置,甚至超过了流感病毒的突变速率 [4]:
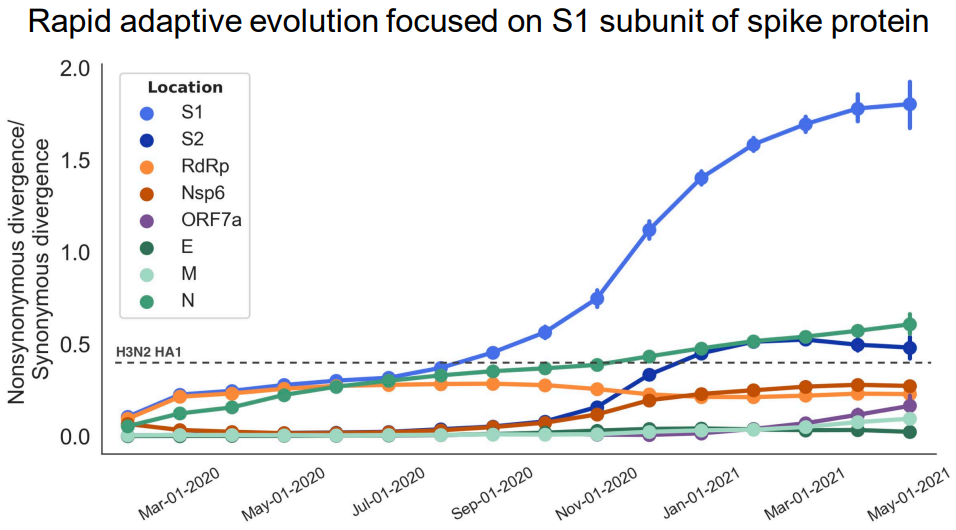 图3 新冠刺突蛋白S1亚基的氨基酸突变速率极高 | 图源[4]
图3 新冠刺突蛋白S1亚基的氨基酸突变速率极高 | 图源[4]
如此惊人的突变率使得我们不得不防备今后病毒通过高速突变而不断逃逸免疫防护、降低疫苗有效性的威胁。
因此,尽快开展新版疫苗还有为今后更新疫苗探路的意义,通过实践来积累经验,如果出现一个让已有疫苗完全失效的突变株,人类也能及时更换疫苗。
突变株疫苗的进展和设计逻辑
看完为什么要研发奥密克戎版疫苗,可能对于许多读者来说,更为关心的问题是现在突变株疫苗研发得怎么样了,什么时候可以用上?
这方面进展最快的是辉瑞/BioNTech与莫德纳(Moderna)这两家mRNA疫苗研究团队,分别在2022年初先后开展奥密克戎版疫苗的临床试验,不过尚未有阶段性结果公布。
2022年1月25日,辉瑞/BioNtech奥密克戎版疫苗率先公布启动临床试验 [5]。从试验设计上看,上述两个新版疫苗都考虑了多种情况,包括增强针与初始免疫等。
以辉瑞/BioNtech奥密克戎版mRNA疫苗为例,临床试验包括了三个分组 [5]:
1 第一组615人,已接种过两针原始疫苗,试验中将接种一针或两针新版疫苗;
2 第二组600人,已接种过三针原始疫苗(包含增强针),将再接种一针原始疫苗或新版疫苗;
3 第三组205人,未接种过疫苗,直接接种三针新版疫苗。
从以上设计不难看出,新版疫苗的研发要回答多个问题:新版疫苗作为增强针,应该是打一针还是两针(即第一个试验组要回答的问题);如果是类似流感的年度加强接种,新版是否更有效(即第二试验组要回答的问题);新版疫苗能否直接取代原始版(即第三试验组要回答的问题)。
这种复杂的设计也对应了现实中疫苗换代的复杂性:如果真要对疫苗更新换代,对于未接种和已接种的不同人群,是否都适合直接接种新版疫苗,而且确实比原始疫苗更好。
目前辉瑞/BioNTech还未能公布结果,且在2月份BioNTech首席执行官曾表示由于数据收集比预期要慢,变种疫苗研发进程需要推迟数周 [6]。
从目前已发表的奥密克戎版疫苗的动物实验结果看,突变株疫苗能否通过临床试验证明其有效性仍然存疑。
其中,Moderna奥密克戎版mRNA疫苗的恒河猴实验 [7](2022年2月初上传预印版,4月28日正式发表在《细胞》杂志)显示,在接种过两针原始版疫苗的恒河猴中,接种奥密克戎版增强针诱导的免疫反应没有比接种原始版疫苗增强针更好——不仅奥密克戎,德尔塔、贝塔等多种各种病毒株中和抗体诱导都不如原版疫苗高:
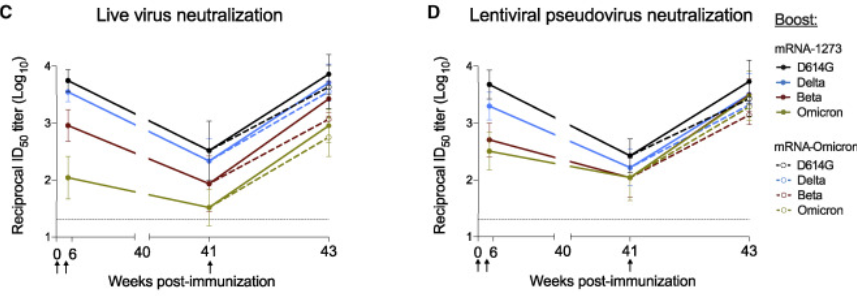 图4 恒河猴接种原始版(实线)与奥密克戎版(虚线)增强针的中和抗体滴度比较 | 图源[7]
图4 恒河猴接种原始版(实线)与奥密克戎版(虚线)增强针的中和抗体滴度比较 | 图源[7]
该实验结果一经公布,不少人开始担心新冠是否无法研发出有效的突变株疫苗,比如是否存在抗原原罪——即接触过一个抗原后,以后激发的免疫反应都会以针对这种抗原为主,很难扩展出更广谱的反应。
抗原原罪当然需要警惕,但对于上述恒河猴实验,一个更重要的发现不应该忽略:是无论用奥密克戎版还是原始版增强针,都诱导出了很高的免疫反应,而且在攻毒实验里起到了保护作用。
如果再细究这个实验打完两种增强针后的免疫反应,还可以发现,无论接种新老版本增强针,都出现了大量能同时识别原始病毒株与奥密克戎突变株的广谱记忆B细胞。记忆B细胞再度遇到抗原,会迅速扩增分化为产生特异性抗体的B细胞,这是人体免疫记忆的重要组成部分。
两个不同的增强针都产生广谱记忆B细胞,显示了人体免疫系统的 “灵活性”。也就是说,在与新冠相关抗原多次接触的过程中,人体免疫系统不断优化了免疫反应,不仅有提升免疫反应的强度,还在完善免疫识别的广度。
当然我们仍希望新版疫苗能在临床试验里证明可以提供更好的防护。虽然只有中和抗体数据,但从这一角度看Moderna的恒河猴实验显然不理想。不过也不需要一棒打死,要知道该实验毕竟只用了8只恒河猴,规模很小,而且恒河猴接种疫苗产生的抗体滴度也一直远超人体,所以不能代表新版疫苗在实际人群中的表现。
尽管奥密克戎疫苗是首个进入临床试验的突变株疫苗,但其实在此之前一些疫苗企业已经在验证更早一些突变株疫苗的可行性。其中引起最多关注的是贝塔株,这个最早在南非发现的病毒株是奥密克戎出现前免疫逃逸最严重的突变株之一,自然成了换代疫苗的测试首选。
近期(2022年4月15日),莫德纳公布了该公司基于贝塔株与原始病毒株的二价疫苗增强针结果,结果显示采用这种二价设计的增强针,对包括奥密克戎在内的多个病毒株都有更好的免疫反应 [8]:
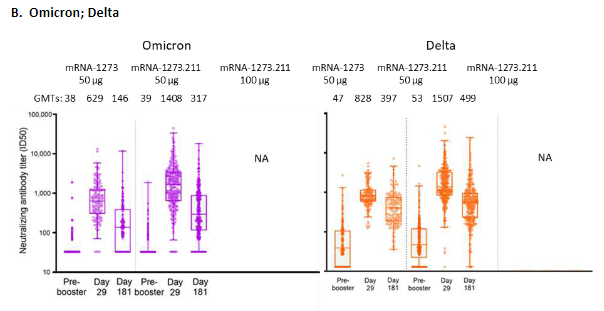 图5 Moderna贝塔与原始株的二价疫苗(mRNA-1273.211)增强针相比原版疫苗诱导了更多针对奥密克戎与德尔塔的中和抗体 | 图源[8]
图5 Moderna贝塔与原始株的二价疫苗(mRNA-1273.211)增强针相比原版疫苗诱导了更多针对奥密克戎与德尔塔的中和抗体 | 图源[8]
这一正向结果指向突变株疫苗以及多价疫苗或许是可行的。不过更有可能推入实践的原始株加奥密克戎的二价疫苗临床试验仍处于进行中 [9]。只有相关临床试验数据公布,才能有更准确的判断。
疫苗换代并不简单
由于奥密克戎突变株严重的免疫逃逸,现有疫苗防感染的有效性大幅下降,越来越多的突破性感染也让很多人期望奥密克戎疫苗等次世代疫苗能早日面世。
但疫苗换代绝不仅仅是简单的研发和生产的问题。2022年4月6日,美国食品药品监督管理局(FDA)举行了一个公开的专家会议,从多个角度分析次世代疫苗需要考虑的问题以及目前的难点 [10]。
第一个是疫苗的组成,理论上疫苗设计越接近投入使用时的主流突变株,有效性可能越好。但问题是如果今后新冠疫苗也跟流感疫苗一样,即每年秋冬季为接种时间段,那么从大规模生产的角度,在每年的5、6月份就需要确认疫苗针对的病毒株。这意味着科学家要做的是预测几个月后可能的主流突变株,而不是简单看现在流行的是哪个突变株。
这种预测在流感疫苗上相对成熟(也有预测失败的情况),但对新冠来说有很强的不确定性。流感有明显的季节性,科学家会根据南北半球的季节差来推测下一个流感季更有可能是哪几个流感病毒株占主导。而新冠到目前为止并不是季节主导,而是突变株主导。一个传播力更强的突变株出现后迅速扩散至全球,取代其它突变株——包括上一个主流突变株。而且,下一个主流突变株并非一定从上一个主流突变株进化的情况,比如奥密克戎就属于独立起源,并非由德尔塔进化而来。这些无疑增加了预测主流突变株的难度,也让疫苗换代时的设计更为困难。
比如2021年夏天,德尔塔变种席卷全球时也有讨论是否要更改疫苗设计生产新疫苗。如果当时匆忙换一个德尔塔版疫苗,等到几个月后规模生产完成开始在去年秋冬季接种时,奥密克戎已经取代德尔塔的流行株地位了。
解决突变株更迭以及时间差问题,其中一个办法是采用多价疫苗的设计。对于mRNA疫苗来说,目前试验的二价疫苗相当于一针疫苗里一半是针对一个突变株的mRNA疫苗,另一半是针对另一个突变株的mRNA疫苗。由于mRNA疫苗只要对mRNA序列稍作调整就能做出针对不同突变株的疫苗,所以二价的组合也非常灵活。比如,美国国立卫生研究院就联合Moderna在做一个多种二价疫苗的比较试验——COVAIL临床试验 [10]:
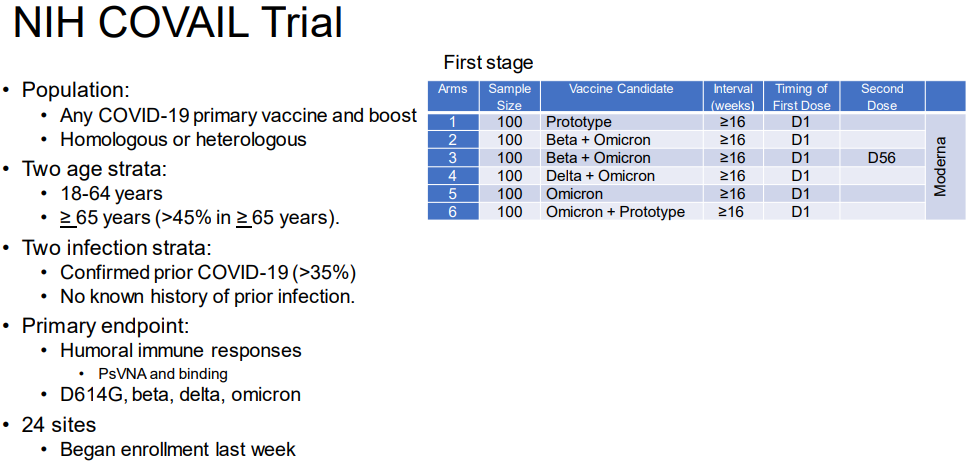 图6 NIH与Moderna的多种多价疫苗比较试验
图6 NIH与Moderna的多种多价疫苗比较试验
在该试验中,会有贝塔+奥密克戎,德尔塔+奥米克戎版还有原始病毒株+奥密克戎三个不同形式的二价疫苗。
这类多价疫苗的研究还能帮助我们从新冠抗原识别位点的角度更合理优化疫苗,应对今后可能出现的突变株。比如通过分析现在已知的新冠突变株,科学家可以根据免疫系统对各突变株的抗原识别位点差异建模 [10]:
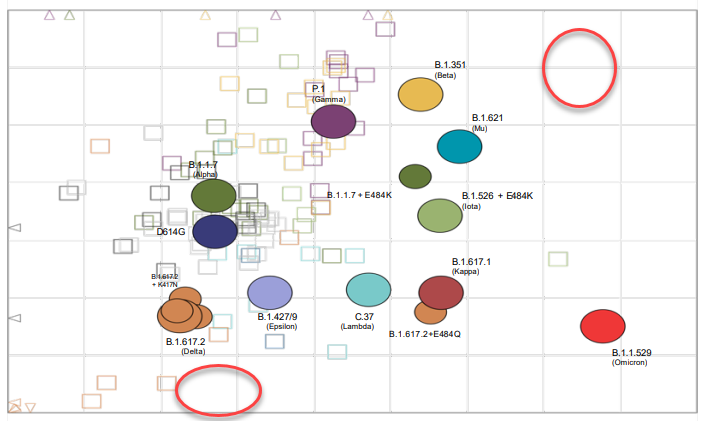 图7 不同突变株的抗原 “位置”
图7 不同突变株的抗原 “位置”
可以看到奥密克戎(B.1.1.529)在占据的抗原识别位置上与其它突变株离得比较远,这也是为什么奥密克戎出现严重免疫逃逸的分子基础。但从不同突变株的抗原 “位置” 看,我们还能看到在贝塔(B.1.351)或德尔塔(B.1.617.2)之外都有空余的抗原位置(红色空圈位置)。这些空位意味着潜在的新突变株可利用的免疫逃逸机会。理想的下一代疫苗需要能帮助我们把这些空位给补上。
即便由于新冠进化的不可确定性,下一个主流突变株跑到了我们未认识到的位置,科学家也希望能通过将其迅速定位到类似的抗原位置图,可以找到与新突变株更相近的过往突变株,协助选择更合理的疫苗设计。
此外,谁来掌握疫苗换代的决策也是一个难点。首先,疫苗厂商对独自更改疫苗组成肯定会犹豫:如果我换了,别的厂没换,或是大家用了不同的设计,竞争上是否会反而因换代处于劣势。从FDA上述会议来看,新冠疫苗选用的病毒株今后会由FDA参考世界卫生组织(WHO)的意见来决定 [10]。即在更新疫苗前,FDA以及WHO会确认用什么突变株,然后告知厂家。这样对不同厂家来说,更换疫苗的基本蓝图是一样的,也消除了一个很大的不确定性。
上述会议还提及,为了进一步防止混乱,一旦确认新的疫苗病毒株选择,新疫苗将取代原有疫苗——即新疫苗上市后不会有人再接种原始疫苗。虽然不流通完全不同病毒株的疫苗可以防止混乱,但这也意味着换代疫苗的临床试验要考虑初次接种与加强针等多种情况。
目前来看,下一代新冠疫苗的设计有可能在6月得到确认。除了辉瑞/BioNTech与莫德纳两家最早进入奥密克戎疫苗研发的药企可能会公布阶段性临床试验结果,FDA也计划在6月28日再度召开专家会议,研究决定下一代疫苗是否更改病毒株,以及选择什么病毒株。如果进展顺利,计划将在今年秋冬季上市新版疫苗 [11]。
国内读者更为关注的灭活疫苗奥密克戎版,也在近期有了一些进展。4月26日,科兴和国药同时获得国家药监局奥密克戎突变株临床批件。对于临床前研究结果 [12],国药表示 “结果显示奥株新冠灭活疫苗可以针对奥株及多种变异株产生高滴度中和抗体,” 科兴则表示 “科兴奥密克戎变异株灭活疫苗在动物体内安全有效”,但我们仍然期待有公开发表的研究结果。
需要指出的是,对换代后的疫苗公众也应该有合理的预期。与流行病毒株更切合的抗原设计只是疫苗有效性的影响因素之一,不同技术平台,甚至同一技术平台采用不同的抗原优化设计、佐剂等,都会大幅影响疫苗最终的有效性。
实际上现有疫苗都是根据原始病毒株设计,抗原是类似的。但mRNA疫苗在有效性上显著高于腺病毒疫苗与灭活疫苗。这种差异大概率也不会因为换成奥密克戎版疫苗就消失。
对于灭活疫苗,过往的临床试验、真实世界跟踪已经反复显示因技术平台限制,免疫原性较弱,对应产生较低的有效性,这在老年人中尤为突出。这种局限性大概率不会因换成奥密克戎版就不复存在。
甚至是更高效的mRNA疫苗,以上述提及提及的莫德纳贝塔株二价疫苗临床试验 [8] 为例,虽然观察到了更多的中和抗体,但这是否代表会在临床试验有效性上带来翻天覆地的变化?
更长远一点看,想要结束新冠大流行,我们更需要的是一个能够防感染的疫苗,而不仅仅是一个防重症的疫苗。而更换病毒株设计所带来的的抗体滴度的提升是否足以让疫苗防感染的有效性大幅提高,以至于可以通过疫苗接种来彻底阻断传播?这仍然是可疑的。
临床上发现,奥密克戎感染表现为集中攻击上呼吸道,因此防感染有效性提高可能需要在呼吸道黏膜维持极高的中和抗体滴度,这未必是换个抗原设计就能做到的。
总的来说,今年秋冬,从全球范围来看,即便会有一个次世代新冠疫苗面世,也大概率仍会是一个防护重症非常有效,但阻断感染力不从心的疫苗。
从实践角度,有效性提升的新版疫苗仍会是非常有必要的尝试,但从个人角度,显然不应为了等次世代疫苗而推迟接种,及时接种现有疫苗才是获得保护的最快手段。
从科研角度,我们需要有更大胆的创新,尝试研发更广谱、甚至能彻底阻断感染与传播的疫苗,而不仅仅局限于在病毒株选择上的小改动。
从疫情发展看,新冠病毒的进化、突变株的迭代有一定的不可预测性。当药企研发奥密克戎疫苗时还是BA.1亚株占主流,现在已是BA.2为主,而BA.2.12.1、BA.4与BA.5等逐渐上升,换代奥密克戎疫苗的实际效果也需要跟踪确认。
《知识分子》专栏作者,周叶斌
阿拉巴马大学伯明翰分校博士,现就职于药企从事新药研发工作,业余写写科普,微信公众号:一个生物狗的科普小园。
参考文献:1.https://://://://:// ://://://://://
0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 