
图源:Pixabay
撰文丨杨振纲
“人何以为人?”既是一个哲学命题,又是当代自然科学的一个重大科学问题。
现代神经生物学经历了150年的发展,科学家们认识到,人类之所以如此特殊,其根本原因在于,人类拥有一个高度发达的大脑皮质[1]。大脑皮质虽然在神经系统演化史上最晚出现,但功能上却是最为高阶。这一结构掌管着语言、意念、逻辑、抽象思维、决策和情感等高级功能,这也是人类区别于其它动物的显著特征。
进一步分析显示,与地球所有陆生动物相比,人类大脑皮质内包含了数量最多的神经元,这是人类智力的物质基础。比如,人类大脑皮质中有160亿个神经元,非洲大象的大脑比人脑重三倍,其大脑皮质体积是人类的两倍,但皮质神经元的数量却只有人脑皮质的三分之一,大约56亿个,这个数目多于猕猴的17亿,少于猩猩的80亿[2、3],而我们最常用的模式动物小鼠的大脑皮质,只有1400万个神经元,不足人类的千分之一。雪貂的大脑皮质具有折叠和沟回的特征,有4000万个神经元。人们形象地将哺乳动物的大脑皮质比喻成计算机的CPU(中央处理器),而神经元就类似于CPU的基本单元。换句话说,神经元数量越多,动物就越聪明。因此,“人之所以为人”,最根本的前提就是人类大脑皮质拥有160亿个神经元。
那么,人类这160亿个大脑皮质神经元是如何发育生长出来的呢?这里有两个主要因素:第一,在我们人类大脑皮质发育过程中,拥有数量最多的神经干细胞(又叫放射胶质细胞)。神经干细胞的数量越多,就可以产生更多的子代细胞-神经元,大脑的体积也越大。这个理论又称Radial Unit Hypothesis (RUH,放射胶质单元假说),是由美国耶鲁大学Pasko Rakic教授率先提出的 [1,4,5](图一)。第二,就是人类大脑皮质神经干细胞产生神经元的时间最长。比如,小鼠大脑皮质的神经干细胞产生神经元的时间只有7天,而人类达到了130天之久[6-9]。正是这两个主要因素,确保了我们人类能够生长出陆生动物中数量最多的大脑皮质神经元。
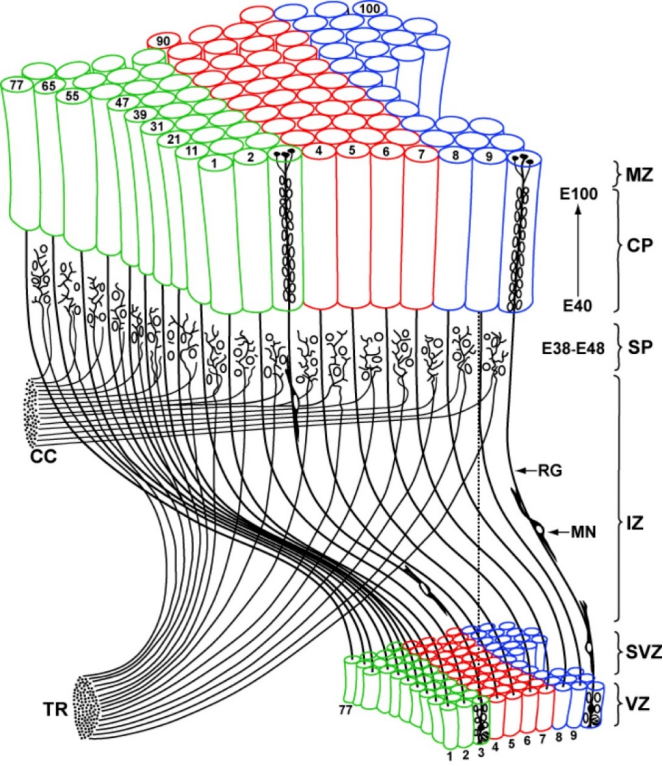
图一:Radial Unit Hypothesis (RUH,放射胶质单元假说) 示意图。在大脑皮质发育过程中,神经干细胞在脑室生发层(VZ)的位置和数量,在很大程度上就决定了大脑皮质表面积的大小和神经元的数量 [1,4,5]。人类大脑皮质的表面积是小鼠的1000倍之多。
从最古老的生命形式到人类,生命在地球上的进化已经绵延了40亿年。最早的哺乳动物大约在2亿年前出现,而灵长类和小鼠的共同祖先,则出现在1亿年前。那么,哺乳动物在进化过程中,大脑皮质神经元的数量,从小鼠,到雪貂、猕猴、猩猩乃至人类,是如何逐渐一点点增加的?主导这一过程的基本规律和原理,及其背后的分子机制是什么,却不清楚。我们的科技蒸蒸日上、日新月异;以至于我们人类几乎是上天入地,无所不能,这都是因为我们拥有一个非凡的大脑。可是人类的大脑却不了解自己是如何进化出来的,这个问题长期困扰着科学家。但是,在我们艰难探索的过程中,有一点是可以肯定的,就是驱动大脑进化的规律,是一定存在的,而且非常符合基本逻辑,也不会太复杂,因为2亿年前就出现了哺乳动物,这个规律在那时,甚至在更早的时期,就已经开始发挥作用了;当然,这个规律也不会很简单,因为几代科学家们历经了100多年,也还没有发现这个规律。
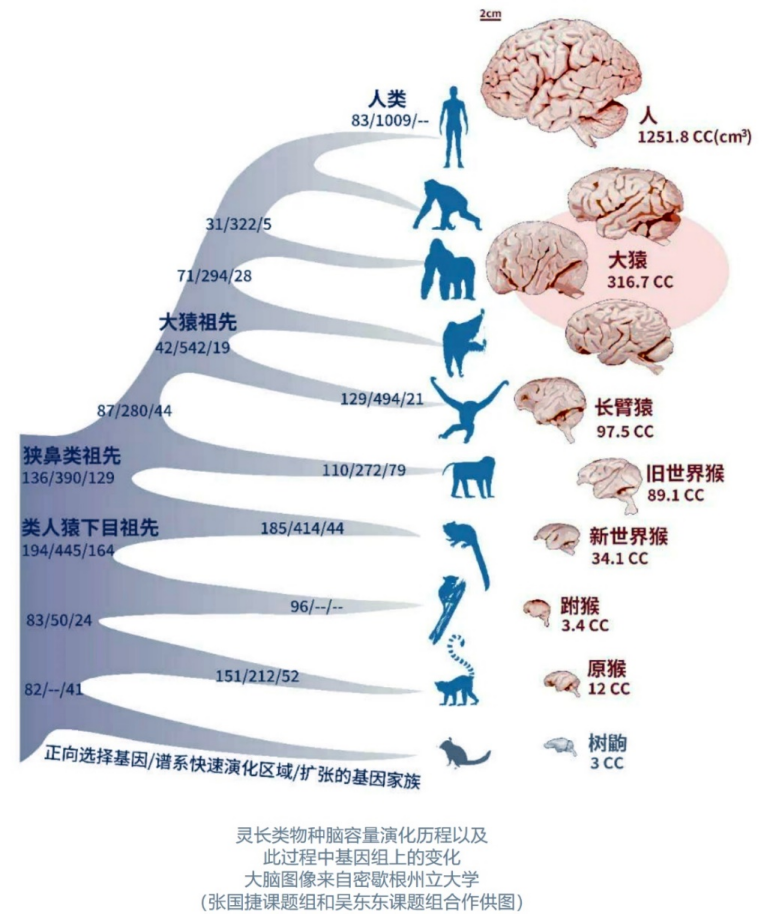
图二:灵长类脑容量逐渐增大的演化路线清晰明了[10],同时也预示着一定有一个最基本的规律和原理主导了这一进程。
综上所述,要回答“人何以为人”或者说“人类大脑是如何进化出来的”这个重大科学问题,实际上就是要找出哺乳动物大脑在进化过程中所遵循的基本原理和规律,及其背后的细胞和分子生物学机制。正是这个机制,驱动哺乳动物在漫长的进化过程中,大脑皮质的神经干细胞数量越来越多,其产生神经元的时间也越来越长,并最终进化出了具有高级功能的人类的大脑。
令人惊喜的是,最近,我们的科研团队可能发现了这个规律。
哺乳动物大脑进化的核心机制
我们的故事主要从1亿年前开始。那个时候,地球上生活着现在小鼠、雪貂和灵长类(包括我们人类)的共同祖先(图三)。它们大脑新皮质的结构和现在哺乳动物大脑新皮质的结构非常类似,都具有六层结构。本文所讲述的内容,主要是我们团队自己的科学发现。有兴趣读者,可以参阅本文附录的一个科研汇报视频和五篇科研论文,尤其是2024年正式发表的两篇论文 [11,12](图四和图五)。
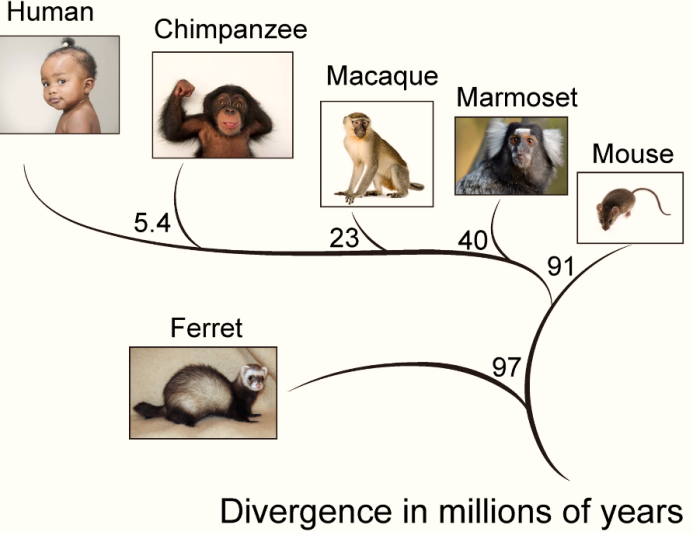
图三:从进化树上看,小鼠、雪貂和灵长类在一亿年前,具有共同的祖先。雪貂的种属分支早于小鼠。
在哺乳动物发育过程中,以小鼠为模型,在刚刚出现神经组织和大脑雏形的时候,在胚胎的最前端有一个临时结构,叫Anterior Neural Ridge (ANR,前端神经脊),随后ANR发育成为Rostral Patterning Center(RPC,前脑前端发育调控中心),这个结构表达FGF8/17/18(成纤维细胞生长因子8/17/18)。FGF和它们的受体FGFR结合之后的一个主要下游信号通路是FGF-细胞外信号调节激酶 (FGF-ERK)。FGF-ERK信号通路的功能非常强大,包括调控神经干细胞及其子代细胞的自我更新、增殖、存活、生长、代谢以及细胞命运决定和细胞分化等。RPC还决定了大脑前端体积的大小,也可以简单理解为额叶皮质的大小。额叶皮质通常被称为脑部的命令和控制中心,决策和自控等较高层次思考就在这里进行。
DNA双螺旋结构的发现者之一,诺贝尔奖获得者Francis Crick说过:“我断定,发育的关键特性在于梯度效应(gradients)”。哺乳动物大脑的RPC正是通过FGF-ERK前端浓度高,后端浓度低这个梯度效应(图四),参与了对早期发育阶段大脑不同区域的划分,这也部分决定了成年后大脑额叶、顶叶、颞叶和枕叶的位置。解剖学和组织胚胎学的专家们发现,不论是小鼠、雪貂还是人类,在大脑刚刚开始发育时,它们的大小都是一样的。因此,所有哺乳动物早期大脑皮质发育和大脑分区所遵循的基本规律和所受到的信号调控,基本上都是一致的 [13-15]。
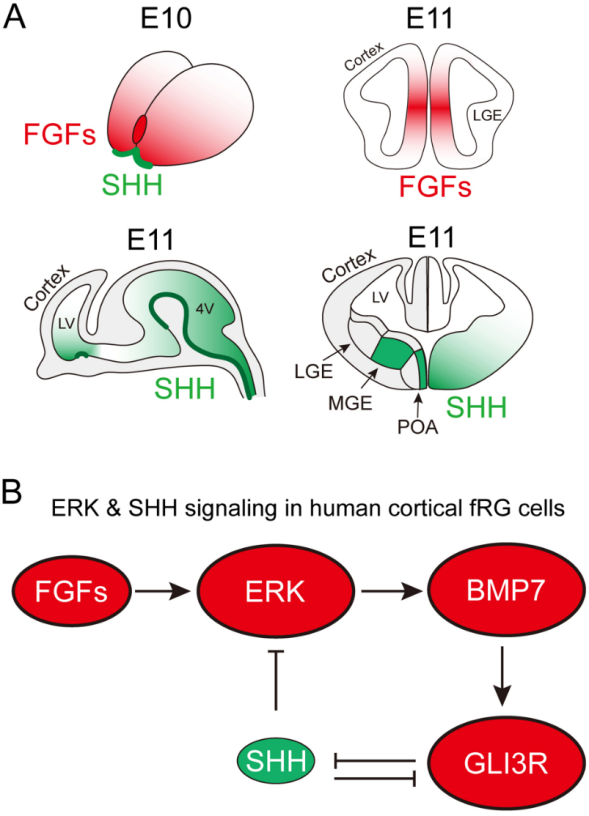
图四:FGF-ERK信号通路和SHH信号通路在大脑皮质神经干细胞中相互抑制[11]。
(A)在大脑刚刚开始发育的时候,以小鼠为例,端脑前端的RPC表达FGF8/17/18,FGF从前向后扩散,形成了一个梯度。另一个分子SHH主要在端脑的腹侧表达,从腹侧向背侧扩散,也形成了一个梯度。(B)以人类大脑皮质发育为例,FGF-ERK信号通路诱导BMP7基因表达,BMP7促进GLI3R的形成,GLI3R抑制SHH通路,而SHH通路抑制ERK。ERK越强,导致BMP7和GLI3R就越强,从而导致SHH通路就越弱,SHH对ERK的抑制就越弱,这样ERK-BMP7-GLI3R-SHH就形成了一个正反馈(正向循环)。
随着发育的进行,灵长类大脑皮质的神经干细胞数量迅速增多,很快便与小鼠拉开了差距。那么,驱动大脑皮质神经干细胞增多的机制是什么呢?原来还是FGF-ERK信号通路起了主导作用,因为这一通路可以使神经干细胞不断地自我更新,从而使神经干细胞的数量逐渐增多,而不分化。关键问题是,从小鼠、雪貂、猕猴、猩猩到人类,随着进化,不同物种的大脑皮质的神经干细胞是如何一点点逐渐增加的?
我们的第一个重要发现是,通过基因敲除或者基因过表达的实验方法,我们发现FGF-ERK信号通路越强,神经干细胞数量就越多,大脑皮质就越大(这符合Rakic的放射胶质单元假说,RUH);FGF-ERK信号通路还诱导BMP7基因表达,BMP7促进GLI3R的形成,GLI3R抑制SHH通路 [16,17],而SHH通路在大脑皮质神经干细胞中是抑制ERK通路的。因此,ERK越强,导致BMP7和GLI3R就越强,从而导致SHH通路就越弱,进而SHH对ERK的抑制就越弱,这样ERK-BMP7-GLI3R就形成了一个正反馈(正向循环)(图四)[11]。进一步讲,大脑皮质越大, SHH信号在大脑皮质中就越弱,从而导致ERK-BMP7-GLI3R信号通路就越来越强。这样,大脑皮质中FGF-ERK-BMP7-GLI3R信号通路随着大脑皮质的不断增大而逐渐增强,呈现一个正反馈的形式(正向循环)(图四)[9]。这个发现很好地解释了,从小鼠、雪貂、猕猴、猩猩到人类,随着进化,不同物种的大脑皮质的神经干细胞为什么会越来越多。
我们的第二个重要发现是,BMP7基因具有很强大的功能[11,12]。在个体发育和种系演化过程中,由于FGF-ERK通路在大脑皮质神经干细胞中随着进化越来越强,这导致哺乳动物大脑皮质的神经干细胞越来越多地表达BMP7基因。BMP7的功能是加强神经干细胞自我更新和显著延长神经元产生的时间,并抑制神经胶质细胞的产生。最终在种系演化过程中,人类大脑皮质神经干细胞获得了高表达BMP7基因的能力,因此也就具有了长时间产生神经元的能力,从而在漫长的自然选择过程中获胜,可谓是得BMP7基因者,得天下(图五)。临床病例报道显示,BMP7基因杂合子突变的儿童普遍都有小头畸形和智力低下的征状[18]。
另外,在人类大脑皮质发育过程中,主要出现了三种放射胶质细胞,它们是位于脑室层(VZ)全长跨度的放射胶质细胞(fRG),位于脑室层的截短型放射胶质细胞(tRG)和位于外侧脑室下层(OSVZ)的外侧放射胶质细胞(oRG)(图六)[9,19-21]。人类大脑皮质放射胶质细胞(即神经干细胞)的谱系演化过程,大致如下:在大约孕期GW7-8周,神经上皮干细胞直接转化为全长放射胶质细胞,即fRG。fRG经过对称性分裂维持自我更新和增加数量,另一方面通过非对称性分裂维持自我更新, 并且产生大脑皮质深层的锥体神经元,这一过程持续10周左右。到GW16周,fRG一般直接产生tRG和oRG。tRG和oRG可以继续非对称性分裂并自我更新[19,20]。tRG开始表达EGFR,并产生具有多分化潜能的神经前体细胞(bMIPC)。这些bMIPC表达EGFR, ASCL1, OLIG1和OLIG2,可以多次分裂,随后分化成星形胶质细胞、少突胶质细胞和迁往嗅球的中间神经元 [9,22](图六)。而位于人脑皮质的OSVZ中的oRG,则继续产生皮质浅层的锥体神经元且一直维持到GW26周。因此,人类大脑皮质的发育是由VZ和OSVZ两个生发中心驱动,使得神经发生的时间长达130天,而VZ的胶质发生可同时进行而不受影响,这是人类大脑皮质神经元大规模增多的关键原因和细胞生物学机制。更重要的是,oRG维持长时间自我更新和产生神经元的分子机制,同样是受到了FGF-ERK-BMP7-GLI3R信号通路正反馈的调控[11,12]。
图五:在哺乳动物大脑皮质发育和进化的过程中,神经干细胞增强BMP7基因的表达,从而加强神经干细胞自我更新的能力,延长神经干细胞产生神经元的时间。这一过程受到了FGF-ERK信号通路的调控。最终,超过95%的人类大脑皮质的神经干细胞表达了BMP7基因(相比之下,小鼠大脑皮质的神经干细胞只有10%左右表达BMP7基因),这使得在陆生哺乳动物王国中,人类大脑皮质产生神经元的时间最长。因此,我们人类大脑皮质的神经元数目最多,功能最强大。可谓是“得BMP7基因者,得天下”。
因此,我们上述的发现可能部分回答了“人类大脑是如何进化出来的”这个重大科学问题。正因为是ERK-BMP7-GLI3R-SHH所形成的正反馈,而不是什么基因突变,使得哺乳动物王国在漫长的进化过程中,大脑皮质的神经干细胞数量越来越多,其产生神经元的时间也越来越长,并最终进化出了具有高级功能的人类大脑(图六、七)。
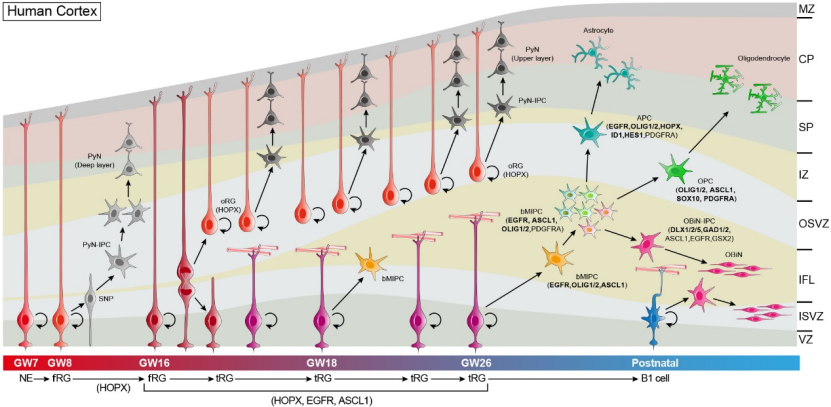
图六:人类大脑皮质发育过程简图[9]。大约在孕期GW7-8周,fRG 细胞(ventricular full span radial glial cells)通过非对称性分裂,一方面维持自我更新,另一方面产生皮质深层的兴奋性锥体神经元(PyN),这一过程可持续到GW16周。fRG在GW16左右开始生成tRG细胞(truncated radial glia)和oRG细胞(outer radial glia)。tRG细胞主要产生多潜能胶质前体细胞(bMIPC),bMIPC进而分化成星形胶质细胞、少突胶质细胞和迁往嗅球的中间神经元,而oRG细胞则继续产生皮质浅层的锥体神经元,并且这一过程至少持续到GW26周。因此,人脑皮质通过两个生发中心的驱动,使得其神经发生的时间长达20周,同时也不影响脑室区的胶质发生。这是人脑神经元数目巨大的主要原因,也是人类大脑皮质扩张的原因。oRG可以长时间自我更新和产生神经元,这仍然是通过ERK-BMP7-GLI3R所形成的正反馈,驱动了这一过程。
再次从进化的角度审视这个发现
如上所述,我们提出了人脑进化的新理论,或将揭开了人脑扩张和进化的奥秘。当然,这个发现和理论必须被国际同行验证是正确的,而且要经得起时间的检验,才或可称之为“重大原始创新”。我们做科学研究,就是要“不怕冷板凳,十年磨一剑”,就是要瞄准国际前沿,解决重大问题。
基因表达调控理论的发现者之一,诺贝尔奖获得者Francois Jacob说过:“进化是一个修补匠,它使用和拼凑手边的可用材料,不断加以改造和修订,而不是像工程师那样,有先入为主的计划,并按照预先设计的图纸而开展工作”。换句话说,我们所看到的自然生命过程中的各种现象或称之为“表型”,都是进化来的,而不是人为设计出来或者人为编造出来的。
因此,从进化角度上再次审视这个发现是非常必要的。FGF-ERK通路是一个非常古老的信号通路,从发育到衰老,参与生命的整个过程。前面讲过,在小鼠胚胎刚刚出现神经组织和大脑雏形的时候,有一个结构:前端神经脊(ANR),且表达FGF8/17/18和BMP7 [23]。随后ANR发育成为前脑前端发育调控中心。前端神经脊这个结构的存在,至少可以回溯到5亿年前的寒武纪半索动物门(柱头虫)和头索动物门(文昌鱼)[24](图七)。因此,这个发现再次验证了进化是一个修补匠:驱动大脑发育、扩张和进化的基本结构的雏形和分子,早在5亿年前的文昌鱼就开始发挥作用了。
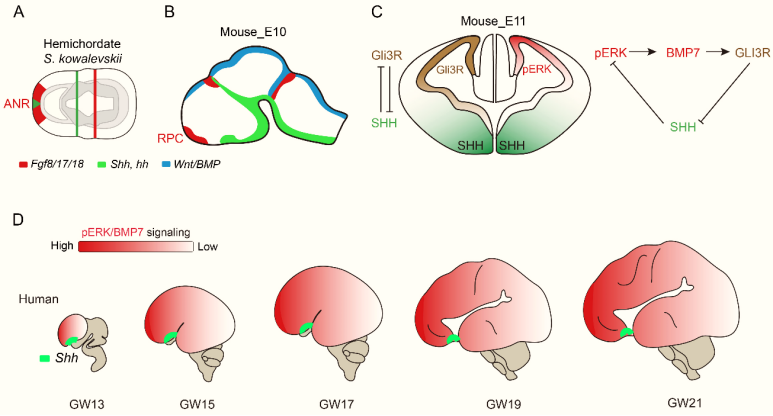
图七:大脑皮质进化机制的模式图[11]。(A)早在5亿年前的半索动物门(柱头虫)和头索动物门(文昌鱼)[24],就有了前端神经脊 (ANR),并且表达FGF8/17/18,发挥着神经诱导的功能。(B)最初的多种信号通路对端脑发育和分区的作用,在小鼠、雪貂、猕猴和人类的胚胎中,是保守的,功能也是一致的[13,14],因为这个时候胚胎的大小基本相同 [15]。(C, D)ERK-BMP7-GLI3R-SHH所形成的正反馈,驱动哺乳动物大脑皮质神经干细胞的数量越来越多,其产生神经元的时间也越来越长,因而最终进化出了具有高级功能的人类大脑,这个大脑有着陆生动物中,数量最多的大脑皮质神经元。
我们的ERK-BMP7-GLI3R-SHH正反馈机制的论文于2024年3月18日正式在《PNAS,美国国家科学院院刊》发表了[11],但是在2023年8月8日,我们就把论文的初稿放在了BioRxiv(生物预印本网站),是希望更早一点给大家介绍我们的新理论,供大家参阅和批评,或许还有可能起到了启发思路和开拓视野的作用。
值得高兴的是,2024年9月在欧洲,有一个高水平的国际会议,主要聚焦大脑皮质发育和进化,美国和欧洲的很多顶尖科学家都将参加,我有幸受邀做大会报告。
每每想起这可能是一个非常重要的发现,总是令我热血沸腾。当然,我们自己是非常确信我们发现了主导哺乳动物大脑皮质进化的基本原理和核心机制(图四、五、六、七)[11]。但是,任何理论都可能有不完善的地方,因此希望国内外同行,严厉批评和审视这个发现,给我们提出好的建议,以进一步完善这个理论,甚至包括各种细节等方面。
附录:与本文相关的一个学术演讲视频和五篇论文
学术报告视频:我们的大脑是如何进化的?
论文 1-ERK-BMP7:
论文2-BMP7:
论文3-Human Glia:
论文 4-Mouse Glia:
论文 5-SHH Function:
参考文献:
1Rakic, P. A century of progress in corticoneurogenesis: from silver impregnation to genetic engineering. Cereb Cortex 16 Suppl 1, i3-17, doi:10.1093/cercor/bhk036 (2006).
2Herculano-Houzel, S. et al. The elephant brain in numbers. Front Neuroanat 8, 46, doi:10.3389/fnana.2014.00046 (2014).
3Sousa, A. M. M., Meyer, K. A., Santpere, G., Gulden, F. O. & Sestan, N. Evolution of the Human Nervous System Function, Structure, and Development. Cell 170, 226-247, doi:10.1016/j.cell.2017.06.036 (2017).
4Rakic, P. Specification of cerebral cortical areas. Science 241, 170-176, doi:10.1126/science.3291116 (1988).
5Rakic, P. A small step for the cell, a giant leap for mankind: a hypothesis of neocortical expansion during evolution. Trends Neurosci 18, 383-388, doi:10.1016/0166-2236(95)93934-p (1995).
6Stepien, B. K., Vaid, S. & Huttner, W. B. Length of the Neurogenic Period-A Key Determinant for the Generation of Upper-Layer Neurons During Neocortex Development and Evolution. Front Cell Dev Biol 9, 676911, doi:10.3389/fcell.2021.676911 (2021).
7Lewitus, E., Kelava, I., Kalinka, A. T., Tomancak, P. & Huttner, W. B. An adaptive threshold in mammalian neocortical evolution. PLoS Biol 12, e1002000, doi:10.1371/journal.pbio.1002000 (2014).
8Picco, N., Garcia-Moreno, F., Maini, P. K., Woolley, T. E. & Molnar, Z. Mathematical Modeling of Cortical Neurogenesis Reveals that the Founder Population does not Necessarily Scale with Neurogenic Output. Cereb Cortex 28, 2540-2550, doi:10.1093/cercor/bhy068 (2018).
9Yang, L., Li, Z., Liu, G., Li, X. & Yang, Z. Developmental Origins of Human Cortical Oligodendrocytes and Astrocytes. Neurosci Bull 38, 47-68, doi:10.1007/s12264-021-00759-9 (2022).
10Shao, Y. et al. Phylogenomic analyses provide insights into primate evolution. Science 380, 913-924, doi:10.1126/science.abn6919 (2023).
11Sun, M. et al. ERK signaling expands mammalian cortical radial glial cells and extends the neurogenic period. PNAS (2024).
12Li, Z. et al. BMP7 expression in mammalian cortical radial glial cells increases the length of the neurogenic period. Protein Cell 15, 21-35, doi:10.1093/procel/pwad036 (2024).
13Micali, N. et al. Molecular programs of regional specification and neural stem cell fate progression in macaque telencephalon. Science 382, eadf3786, doi:10.1126/science.adf3786 (2023).
14Braun, E. et al. Comprehensive cell atlas of the first-trimester developing human brain. Science 382, eadf1226, doi:10.1126/science.adf1226 (2023).
15Jones, W. D., Guadiana, S. M. & Grove, E. A. A model of neocortical area patterning in the lissencephalic mouse may hold for larger gyrencephalic brains. J Comp Neurol 527, 1461-1477, doi:10.1002/cne.24643 (2019).
16Zhang, Y. et al. Cortical Neural Stem Cell Lineage Progression Is Regulated by Extrinsic Signaling Molecule Sonic Hedgehog. Cell Rep 30, 4490-4504 e4494, doi:10.1016/j.celrep.2020.03.027 (2020).
17Hebert, J. M. & Fishell, G. The genetics of early telencephalon patterning: some assembly required. Nat Rev Neurosci 9, 678-685, doi:10.1038/nrn2463 (2008).
18Wyatt, A. W., Osborne, R. J., Stewart, H. & Ragge, N. K. Bone morphogenetic protein 7 (BMP7) mutations are associated with variable ocular, brain, ear, palate, and skeletal anomalies. Hum Mutat 31, 781-787, doi:10.1002/humu.21280 (2010).
19Nowakowski, T. J., Pollen, A. A., Sandoval-Espinosa, C. & Kriegstein, A. R. Transformation of the Radial Glia Scaffold Demarcates Two Stages of Human Cerebral Cortex Development. Neuron 91, 1219-1227, doi:10.1016/j.neuron.2016.09.005 (2016).
20LaMonica, B. E., Lui, J. H., Hansen, D. V. & Kriegstein, A. R. Mitotic spindle orientation predicts outer radial glial cell generation in human neocortex. Nat Commun 4, 1665, doi:10.1038/ncomms2647 (2013).
21Baburamani, A. A. et al. Assessment of radial glia in the frontal lobe of fetuses with Down syndrome. Acta Neuropathol Commun 8, 141, doi:10.1186/s40478-020-01015-3 (2020).
22Li, X. et al. Decoding Cortical Glial Cell Development. Neurosci Bull 37, 440-460, doi:10.1007/s12264-021-00640-9 (2021).
23Shimamura, K. & Rubenstein, J. L. Inductive interactions direct early regionalization of the mouse forebrain. Development 124, 2709-2718, doi:10.1242/dev.124.14.2709 (1997).
24Pani, A. M. et al. Ancient deuterostome origins of vertebrate brain signalling centres. Nature 483, 289-294, doi:10.1038/nature10838 (2012).
0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 