基因编辑技术不断发展,到现在已发展到第三代基因编辑技术。第三代基因技术CRISPR/Cas克服了传统基因操作的周期长、效率低、应用窄等缺点。作为一种最新涌现的基因组编辑工具,CRISPR/Cas能够完成RNA导向的DNA识别以及编辑。通过一段序列特异性向导RNA分子(sequence- specific guide RNA)引导核酸内切酶到靶序列处,从而完成基因组的精确编辑,因其操作简单、成本低、高效率,近几年成为炙手可热的基因编辑手段,目前已广泛用于模式生物研究,医疗,植物作物,农业畜牧等领域。

CRISPR/Cas9的出现给了科研人员无限想象的可能,基于CRISPR/Cas9的技术很快就被广泛应用于全世界各个实验室中,这里我们将主要介绍最常用的几种应用。
早期,科研人员通过同源重组(HR)介导的基因打靶技术来实现基因编辑,但因效率太低,极大地限制了其应用。为了克服这一难题,一系列通过核酸内切酶介导的基因编辑技术被开发出来,通过这些核酸内切酶切割特定的基因组序列,借助细胞自身修复体系如非同源末端连接或同源重组修复方式,并由此达到改变基因组序列的目的,锌指核酸内切酶(ZFNs)、类转录激活因子效应物核酸酶(TALENs)以及sgRNA介导的Cas9核酸内切酶正是基于此原理工作的。
锌指核酸内切酶(ZFNs)和类转录激活因子效应物核酸酶(TALENs)均可通过蛋白-DNA相互作用识别基因组上的特定DNA序列并完成特定位点的切割,但是它们因效率低下、可选潜在位点少、成本高等原因极大地限制了它们的应用,直到CRISPR/Cas9系统的出现,科研人员才找到了一种成本低、效率高、简单易用的基因编辑工具。
CRISPR/Cas9出现之后,科研人员最先想到的便是将其运用到基因编辑上了,根据目标基因的外显子序列设计single guide RNA(sgRNA)并与含有Cas9编码序列的质粒一起转入细胞,sgRNA通过碱基互补配对的原则引导Cas9蛋白靶向目标DNA序列,Cas9蛋白会在该位点切割DNA,引发DNA双链断裂(DSB),此时细胞通过非同源末端连接修复(NHEJ)完成DNA的自身修复,因修复过程中常常发生碱基的添加和丢失,而最终导致基因的移码突变从而达到基因敲除的目的,或者针对目的基因的上下游序列各设计一个sgRNA,从而引发该基因上下游同时发生DSB,再通过DNA损伤修复机制将断裂的上下游两端的DNA连接在一起,引发DNA片段缺失,从而达到基因敲除的目的。如果在此基础上为细胞引入一个修复的模板质粒,细胞就会以此模板进行同源重组修复,如果引入的修复模板是一个想要插入的基因,便可在特定的位置进行基因敲入了。
随着人们对Cas9研究的不断深入,Cas9发挥功能的结构基础也渐渐明确,在Cas9发挥切割DNA的功能时,它的两个结构域发挥着重要作用,分别是RuvC和HNH,其中HNH结构负责sgRNA互补链的切割,切割的位点位于PAM的5'端的第三个碱基外侧,RuvC结构域负责非互补链的切割,切割位点是在PAM上游的3-8碱基之间,当将这二者同时突变失活,便产生了失去DNA切割活性的Cas9蛋白了(dCas9),dCas9虽然失去了对DNA的切割能力,但依旧可以在sgRNA的引导下到达指定的DNA序列处,这是基于sgRNA–dCas9复合体的这一特征,若在dCas9上融合不同功能的结构域,便可在特定的DNA区域完成不同的修饰了,这便形成了基于CRISPR/dCas9的工具包了。
脑洞大开的科学家利用dCas9蛋白,开发出各种用途的工具,可谓是把CRISPR/dCas9利用得淋漓尽致,这里我们举几个简单的例子如研究人员针对目标基因的启动子序列设计sgRNA,使得sgRNA–dCas9复合体靶向结合到目标基因的启动子上,因dCas9蛋白带来的空间位阻可干扰转录因子的结合,从而引发在转录水平上的干扰基因表达的效果,而在此基础上为了达到更佳的干扰效果,一些能够引发基因转录阻遏的结构域也被融合到dCas9蛋白上,如KRAB(Krüppel-associated box)等。
既然可以通过CRISPR/dCas9实现基因表达的干扰,那是不是也可以通过CRISPR/dCas9实现激活基因表达呢?答案是肯定的。科研人员通过向dCas9上融合vp64(四个串联的vp16)、p65AD(p65 activation domain)等促进促进基因转录的结构域,实现基因的内源性激活,在经过各种优化之后,比如由vp64、p65AD和VPR(Epstein-Barr病毒R反式激活因子Rta47)组成的三联结构域(dCas9–VPR)就可以实现很高水平的内源性激活基因表达的效果了。
通过基于CRISPR/dCas9的基因表达干扰和内源性激活工具的建立,使得科研人员在进行诸如基因功能研究的工作时有了更为简单、高效且低成本的研究工具。这很大程度上为科研人员节约了时间和成本。
表观遗传研究是近些年来非常火热的领域,DNA甲基化、组蛋白乙酰化等都在生物体中发挥着重要的生物学功能,而CRISPR/dCas9在表观遗传的研究中也成为了十分强大的工具。比如CRISPR/dCas9介导的靶向DNA甲基化修饰,我们知道在DNA甲基化过程中DNA甲基转移酶(DNA methytransferases,DNMTs)起着关键的催化作用,而且大部分DNA甲基化都发生在CpG岛,因此研究人员尝试着将DNMTs的催化结构域融合到dCas9上形成dCas9-Dnmt3a3L,并通过sgRNA的引导靶向目标DNA序列的CpG附近催化其甲基化,以实现DNA甲基化的定点编辑。相似地,研究人员将在DNA去甲基化过程中起关键催化作用的TET1蛋白的催化结构域融合到dCas9上形成dCas9-TET1,同样的通过sgRNA的引导靶向目标DNA序列的CpG附近,可以实现去甲基化修饰。
再如CRISPR/dCas9介导的靶向组蛋白修饰,与靶向DNA甲基化修饰相似,一些和组蛋白修饰相关的酶包括组蛋白去甲基化酶(LSD1/KDM1A)、组蛋白乙酰转移酶以及组蛋白甲基转移酶等也被融合到dCas9蛋白上,以实现靶向组蛋白修饰。
除以上的应用外,CRISPR/dCas9还被用于其他多个领域,比如将EGFP融合到dCas9上,通过sgRNA靶向特定DNA序列实现基因组成像。此外,还有研究人员开发出基于CRISPR/dCas9的enChIP技术,以来探测特定基因组区域上的DNA-蛋白质相互作用,通过sgRNA靶向特定基因组基因座的标记dCas9的抗体免疫沉淀,之后通过蛋白质谱(enChIP-MS),鉴定与之特异性相互作用的蛋白质。这些工具的开发都极大地帮助了科研人员,使得之前无法实现的操作成为可能,推动了生命科学的快速发展。
以往基于ZFN或TALENs的基因组编辑技术,需要针对DNA靶序列设计蛋白质,而CRISPR技术仅需要根据不同的靶序列合成相应的80nt左右的sgRNA来引导Cas9蛋白对序列进行修饰,这就实现了基因编辑技术的高通量应用。
CRISPR全基因组筛选技术可用于必需基因及药物靶标基因鉴定。多伦多大学Jason Moffa研究组建立了覆盖全基因组gRNA库并在5个细胞系中逐个敲除了1.8万个基因,最后鉴定出在不同细胞系间保守的1580个必需基因构成的“core fitness genes”。同样,美国达纳-法伯癌症研究所W. Nick Haining研究组通过CRISPR/Cas9系统性地敲除了黑色素瘤细胞的2368个基因,发现ptpn2基因缺失会使这些癌细胞对PD-1阻断更加敏感。华盛顿大学医学院Michael Diamond研究组利用CRISPR/Cas9鉴定在宿主细胞中坚定了黄病毒感染所绝对必需的9个基因,其中spcs1基因缺失时,不仅降低黄病毒感染率,而且对细胞也不产生副作用,这将是一个潜在的黄病毒药物靶标。
CRISPR/Cas9作为新一代基因编辑技术,同样可被应用于建立疾病模型及培育供体器官。基因治疗可实现在患者自身细胞中纠正遗传缺陷,并结合其他生物学技术在体外培育出组织特异性的“类器官”,对于疾病建模、药物筛查及临床治疗等方面研究有极大意义。CRISPR介导的基因组编辑技术可以直接应用于非人类哺乳动物的疾病模型建立,将更有利于疾病致病机理和治愈研究。
此外,CRISPR技术还可应用于大型动物的基因编辑以研究免疫排斥及跨物种的疾病传染,从而解决异种移植器官来源的瓶颈,猪被认为是人体异种器官来源的首选动物,而目前猪器官用于人类的主要障碍为免疫排斥反应,及猪内源性逆转录病毒(Porcine endogenous retroviruses, PERVs)带来的医疗风险问题。eGenesis公司杨璐菡博士与哈佛大学George Church教授利用CRISPR进行基因改造一步让62个PERV pol 基因关闭,因而将来自PERV的传染风险降低了三个数量级,成功培育出不含PERVs的猪品系,作为安全有效的异种移植器官来源,这些研究让猪成为病人的器官来源更有前景。
基因编辑技术可以准确地改造人类基因,达到基因治疗效果。中国科学院生物化学与细胞生物学研究所李劲松研究组通过在小鼠胚胎中注射CRISPR/Cas9纠正白内障小鼠模型中的遗传缺陷,所产生的后代是可育的并能将修正后的等位基因传递给它们的后代。杜氏肌营养不良(DMD)是一种罕见的肌肉萎缩症,也是最常见的致命性遗传病之一,是由肌营养不良蛋白dystrophin基因突变引起。杜克大学Charles Gersbach研究组应用CRISPR/Cas9在DMD小鼠中将dystrophin基因突变的23外显子剪切,而合成了一个截短的但功能很强的抗肌萎缩蛋白,这是生物学家“首次成功地利用CRISPR基因编辑技术治愈了一只成年活体哺乳动物的遗传疾病”。
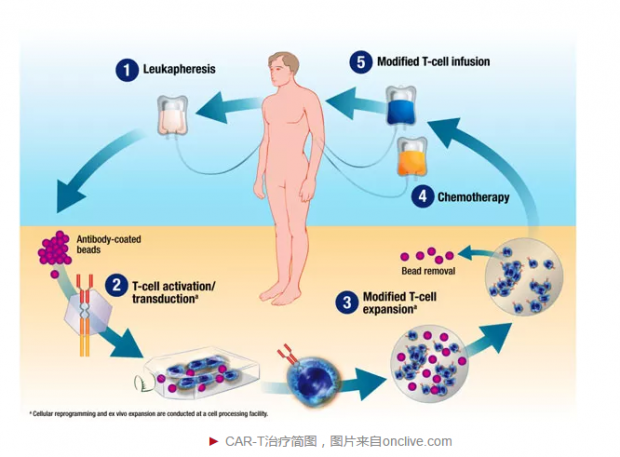
基因编辑技术联合免疫疗法在肿瘤及HIV/AIDS治疗具有广泛的应用前景。嵌合抗原受体T细胞(Chimeric Antigen Receptor T cell,CAR-T)细胞治疗是非常有前景的肿瘤治疗方法。CAR-T细胞疗法在B细胞恶性血液肿瘤治疗中已经取得硕果。中科院动物研究所王皓毅研究组利用CRISPR/Cas9技术在CAR-T细胞中进行双基因(TCRα subunit constant 和beta-2 microglobulin)或三基因(TRAC,B2M及programmed death-1)敲除。美国斯隆凯特林癌症纪念中心Michel Sadelain研究组发现CRISPR/Cas9技术将CAR基因特异性靶向插入到细胞的TRAC基因座位点,极大增强了T细胞效力,编辑的细胞大大优于传统在急性淋巴细胞白血病小鼠模型中产生CAR-T细胞。
继诺华的Kymriah以及Gilead (kite Pharma)的Yescarta接连上市,CRISPR Therapeutics公司也在应用CRISPR/Cas9基因编辑技术开发同种异体CAR-T候选产品。2016年10月,四川大学华西医院的肿瘤医生卢铀领导的一个团队首次在人体中开展CRISPR试验,从晚期非小细胞肺癌患者体内提取出免疫细胞,再利用CRISPR/Cas9技术剔除细胞中的PD-1基因更有助于激活T细胞去攻击肿瘤细胞,最后将基因编辑过的细胞重新注入患者体内。
微生物种群与人体医学,自然环境息息相关。北卡罗来纳大学Rodolphe Barrangou与Chase L. Beisel合作通过使用基因组靶向CRISPR/Cas9系统可靶向并区分高度密切相关的微生物,并程序性去除细菌菌株,意味着CRISPR/Cas9系统可开发成精细微生物治疗体系来剔除有害致病菌,人类将有可能精确控制微生物群体的组成。以色列特拉维夫大学Udi Qimron将CRISPR系统导入温和噬菌体中在侵染具有抗生素抗性的细菌以消灭此类细菌,CRISPR系统已具有成为新一类抗生素的潜力。Locus BioSciences公司也在开发在噬菌体中开发CRISPR系统以达消灭难辨梭菌的目的。
弗吉尼亚理工大学Zhijian Tu研究组在雄蚊子中进行M因子基因编辑,可以导致雌雄蚊之间的转化或雌蚊的杀戮,从而实现有效的性别分离和有效减少蚊子的数量,也将减少寨卡病毒及疟疾等传播。
基于CRISPR治疗不仅可以应用于根除共生菌或有益菌群的病原体,也可应用于靶向人类病毒,包括HIV-1,疱疹病毒,乳头瘤病毒及乙型肝炎病毒等。具有纯合的32-bp缺失(Δ32)的CC趋化因子受体5型(CCR5)基因的患者对HIV感染具有抗性。因此加利福尼亚大学Yuet Wai Kan在诱导多能干细胞iPSC中利用CRISPR系统引入纯合CCR5Δ32突变后,诱导分化后的单核细胞和巨噬细胞对HIV感染具有抗性。天普大学Kamel Khalili 课题组应用CRISPR/Cas9系统在宿主细胞基因组中精确编辑HIV-1 LTR U3区,从而在将艾滋病病毒从基因组中剔除。
Cas12a (Cpf1)属于CRISPR家族另一核酸内切酶,它也可被gRNA引导并剪切DNA。但是,它不仅可以切割相结合的单链或双链DNA,也剪切其他的DNA。近日,加州大学伯克利分校Jennifer Doudna研究组开发了基于CRISPR的一项新技能——基因侦探(DNA Endonuclease Targeted CRISPR Trans Reporter (DETECTR))。利用单链DNA将荧光分子和淬灭分子连接构建成一个报告系统,当CRISPR-Cas12a在gRNA引导下结合到目标DNA并发挥剪切作用时,报告系统中的DNA也被剪切,荧光分子将被解除抑制。此系统在致癌性HPV的人的DNA样品检测HPV16和HPV18变现极佳。
布罗德研究所Feng Zhang研究组开发的基于CRISPR的2代SHERLOCK (Specific High Sensitivity Enzymatic Reporter UnLOCKing),原理是利用Cas13a被激活后,可以切割除靶序列外其他的RNA的特征,引入了解除荧光分子的抑制。此工具可实现一次性多重核酸检测,可同时检测4种靶标分子,额外添加的Csm6使得这种工具比它的前身具有更高的灵敏度,并将它开发成微型试纸条检测方法,简单明了易操作,已被研究人员成功应用于RNA病毒,如登革热病毒和寨卡病毒,及人体液样本检测。
Broad研究所David R. Liu研究组利用CRISPR/Cas9开发了一种被称为CAMERA(CRISPR-mediated analog multi-event recording apparatus)的记录细胞事件的“黑匣子”他们利用这个系统开发出两种细胞记录系统,在第一种被称为“CAMERA 1”的细胞记录系统中,研究人员利用细菌中质粒的自我复制但又严格控制其自身数量的特征,将两种彼此之间略有不同的质粒以稳定的比例转化到细菌中,随后在接触到外来药物刺激时,利用CRISPR/Cas9对这两种质粒中的一种进行切割,通过对质粒进行测序并记录两种质粒比例的变化来记录细菌接触外来刺激的时间。另一种细胞记录系统被称为“CAMERA 2”,它利用基于CRISPR/Cas9的碱基编辑系统实现在细胞内特定信号发生时改变遗传序列中的单个碱基,以此实现对诸如感染病毒、接触营养物等刺激的记录。这套技术的出现将很大程度的帮助人们进一步了解细胞的各类生命活动的发生发展规律。
2015 年 4 月,中山大学的黄军利用CRISPR/Cas9介导的基因编辑技术,同源重组修复了胚胎中一个引发地中海贫血β-globin gene (HBB)的突变。
2016年,广州医科大学的范勇团队在三原核受精卵中,应用基因编辑技术CRISPR受精卵中的基因CCR5进行编辑引入CCR5Δ32纯合突变由于当时脱靶效率问题突出,产生了镶嵌式的受精卵。
2017年8月2日,俄勒冈健康与科学大学胚胎细胞和基因治疗中心Shoukhrat Mitalipov研究组公布了其应用CRISPR在人类胚胎中进行DNA编辑的结果,纠正了突变的MYBPC3基因,其突变会引起心肌肥厚并将年轻运动员猝死。

0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 