 艺术化呈现的生物钟起源模型(由徐占聪设计完成);这个ATP酶驱动的沙漏隐喻了极慢的水解酶动力学决定了振荡的速度,促成了24小时的昼夜节律。背景中组成六聚体的RUVBL2是真菌、果蝇、植物和小鼠生物钟系统中的共同起源分子。图源:清华大学生物医学交叉研究院官网
艺术化呈现的生物钟起源模型(由徐占聪设计完成);这个ATP酶驱动的沙漏隐喻了极慢的水解酶动力学决定了振荡的速度,促成了24小时的昼夜节律。背景中组成六聚体的RUVBL2是真菌、果蝇、植物和小鼠生物钟系统中的共同起源分子。图源:清华大学生物医学交叉研究院官网
撰文 | 严胜男
● ● ●
晨曦中向日葵逐日绽放,暮色里招潮蟹候月出穴,子夜里萤火虫点星闪烁……这些生物活动的规律,正是体内精密的时间机制在调控,让生命节奏与昼夜更替、季节变化保持同步。
然而,几十年来,当科学家们试图解码这精密的生物钟机制时,却始终被时间的周期困住。
生物钟的转录-翻译负反馈环路(TTFL)模型已于 2017 年获得诺贝尔生理学或医学奖,它揭示了一条基因表达的负反馈调控通路:时钟基因转录后产生mRNA,翻译形成时钟蛋白,时钟蛋白积累到一定水平后抑制自身基因的转录,随着时钟蛋白的降解,抑制作用减弱,基因转录重新开始——这一轮循环,在体内,或者说细胞内,周期刚好是24小时左右;但当我们在体外试图重构与转录-翻译负反馈相关的循环,最多只能清晰地刻画出大约6小时的周期变化。消失的时间去了哪里?究竟是什么“拖慢”了时间的脚步?在诺奖中我们不能找到这个问题的答案。那么,是否还存在着其他未知的通路?
2025年3月,一项突破性发现为其提供了关键线索。
北京生命科学研究所高级研究员张二荃研究团队在《自然》杂志上揭示了一种名为RUVBL2的P-环NTP酶在生物钟调控中的核心作用(《The P-loop NTPase RUVBL2 is a conserved clock component across eukaryotes》)。这种 “异常缓慢”的ATP水解酶,每天仅处理约13个ATP分子。

图源略
要理解这种缓慢的程度,不妨考虑一些“普通”ATP酶的运转速度:肌球蛋白,这种在肌肉收缩中至关重要的马达蛋白,每秒可以水解约10个ATP分子;线粒体中的F1-ATP酶这台能量转换工厂每秒处理近100个ATP;而最为高效的酶如碳酸酐酶,每秒能催化多达100万次反应。
张二荃团队通过突变RUVBL2基因,获得了酶活性更高或更低的突变体,发现可精确将其昼夜周期调控到22小时到30小时。正是这种“缓慢”的特质,让它能够精确地度量时间,调节生物体内的昼夜节律周期。
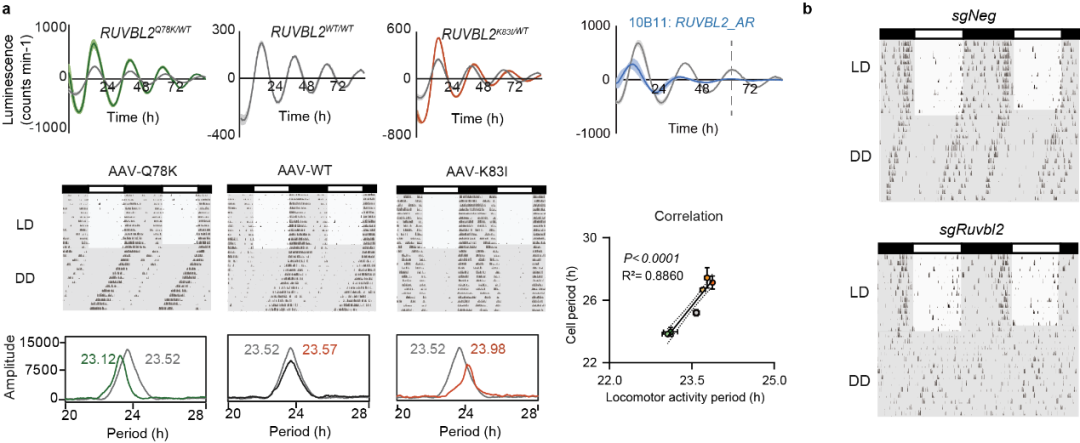
图1 RUVBL2是生物钟的核心组成成分(改编自原文)
(a) 在细胞中敲入突变会导致长周期、短周期或无节律的表型,而在小鼠SCN过表达RUVBL2突变体可重现长周期和短周期的节律变化。此外,细胞与小鼠的周期表型呈线性相关。(b) 在小鼠SCN中敲除Ruvbl2会导致其在恒定黑暗条件下丧失活动节律。图源:清华大学生物医学交叉研究院官网
这样的机制并非首次被发现。早在2005年,日本科学家近藤孝男(Takao Kondo)实验室就在蓝藻中发现了KaiC蛋白及其“伙伴”KaiA和KaiB。只要在试管中加入ATP,这三个纯蛋白就能自发形成24小时周期。KaiC通过缓慢的磷酸化和去磷酸化过程,在KaiA的促进和KaiB的抑制下,精确地维持着昼夜节律。
这曾让科学界兴奋不已,以为即将解开生物钟周期之谜,但随后20年里,科学家们却始终未能在其他生物中找到类似的机制。渐渐地,人们开始认为KaiC系统可能只是进化长河中的一个偶然。“这套系统实在过于精妙,出现一个就很了不起,怎么可能有这么多?”,并提出“生物钟是多中心多起源,协同进化”。真核生物的生物钟似乎完全依赖于基因表达的转录-翻译反馈环路(TTFL)。
但张二荃认为这套说法并不能让人信服,“生物都接受着同样的光照,感受着相同的地球脉搏,怎么会是多中心起源呢?”
直到2014年,他们在一次偶然的改变生物钟的化合物筛选计划中迎来了转机,他们发现一种核苷化合物虫草素(cordycepin),能导致时钟基因表达相位完全逆转。顺着这条线索,他们找到了关键靶点蛋白RUVBL2。让人惊喜的是,这个AAA+家族的ATP酶与KaiC惊人地相似:都具有极其缓慢的ATP水解速率,抑制它们都能产生精确的时间延迟。
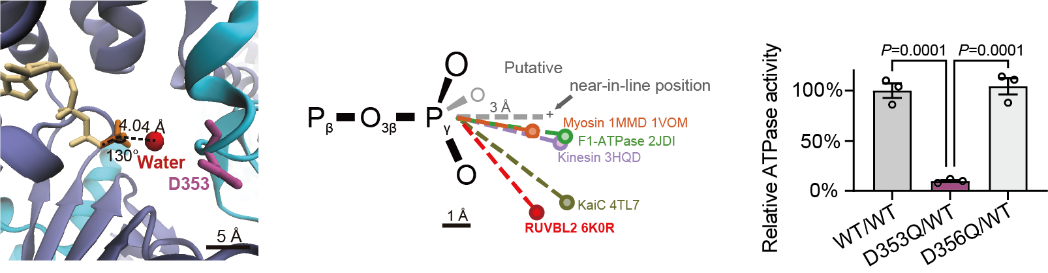
图2 在人源RUVBL1/RUVBL2复合物的ATP结合口袋中,水分子的位置与蓝藻KaiC相似,都处在一种非优化的进攻ATP γ-磷酸基团的状态,因而决定了它们是一类极慢速的ATP水解酶。图源:清华大学生物医学研究院官网
与原核生物中的KaiC不同的是,RUVBL2在真核生物的生物钟调控中具有跨物种保守性,从人类到果蝇,再到脉孢菌,张二荃都在其身上找到了同源蛋白并完成了验证。
这是一条完全独立于传统TTFL机制的通路,张二荃团队设计了一系列实验证实了这一点。他们聚焦于TTFL模型中两个关键的时钟基因CRY1和CRY2。这对基因在生物钟调控中扮演着相反的角色:降低CRY1会缩短周期,而降低CRY2则会延长周期。研究人员发现,无论是在具有高ATP酶活性(周期缩短)的RUVBL2突变体中,还是在低活性(周期延长)的突变体中,CRY1和CRY2的这种调控效应都完整保留。更重要的是,RUVBL2的效应与CRY的效应呈简单叠加关系,而非相互影响。
缓慢震荡的ATP酶,保管着35亿年进化史中最宝贵的节奏。从蓝藻的海洋微光到真核细胞的诞生,从恐龙时代的哺乳动物到直立行走的露西,RUVBL2始终以每天大约13次ATP水解的节奏,在基因组中刻下时间密码。
时钟振荡器里,六个RUVBL2分子首尾相连,形成一个环状结构。通过缓慢但持续的构象变化来丈量时间。每当一个ATP分子被水解,就会引发六聚体中的一处构象改变。由于每天只水解13个ATP,平均每两小时才完成一次构象转换。随着时间推移,这些微小的构象变化逐渐累积。到12小时时,六聚体已经发生了显著的结构重排,就像一个金属环被逐渐扭转变形。24小时后,六聚体完成一个完整的构象循环,回到初始状态,准备开始下一轮周期。
在寻找这些“消失时间”的过程中,RUVBL2的故事为这个崇尚效率的时代,提供了一个反直觉的教训:生命选择了缓慢作为其计时策略,不是因为它无法更快,而是因为它不需要更快。当我们试图用咖啡因、人工照明和不规律的作息来打破这个古老系统时,我们实际上是在与进化精心设计的、以“缓慢”为基础的生物节律作对抗。
01
从应用到基础的一次翻越
张二荃开启这项化合物筛选计划时怎么也没有想到,自己会找到生物钟进化中的核心分子RUVBL2,他当时只是朴素地以为,生物钟调控目前缺乏药物。
周期、振幅和相位是描述生物钟振荡的三大参数。他刻意避开了基础科学中最重要的问题——周期,反而瞄准了不那么受关注的相位和振幅。它们只能解决实用性的问题,诸如帮助旅行者快速适应新时区,帮助轮班工作者调整作息,缓解季节性情绪障碍,改善老年人的睡眠等等。
这样的选择也为他研究的命运埋下了伏笔,它注定不是一个“受欢迎”的研究。
从近万种候选化合物中,他们发现虫草素能完全逆转生物钟的节律,造成12小时的相位偏移。更重要的是,这种效果强烈依赖给药时间,呈现“0型重置”特征——就像时钟指针突然跳转,而不是缓慢调整。在动物实验中,注射虫草素的小鼠只需4天就能适应8小时的时差,比正常情况快了一倍。而在特定的时间,还能发挥提高振幅的效果。
这条代表着生物钟的正弦曲线有了虫草素的参与变得更加强劲、相位转变更加迅速,这让它赢得了中国、日本等多国的专利,提上了商业化的日程。
但是寻找虫草素的靶点一直是作为科学家的张二荃的使命。他猜了很久,希望闪光的运气能够降临,每一次晚饭后散步、开会间隙偶然地遐想都会把他带到一个分子上,学生们再花上几天甚至几周的时间去实验却一无所获,一来二去大失所望。
不像其他分子生物学实验,生物钟实验无法在24小时内快速试错、迭代假设。每个time course实验都需要96小时的持续监测,一个完整的数据集往往要等待两到三个完整周期才能显现规律,而时间早溜走一星期。
凌晨的实验室,荧光素酶记录仪发出微弱的绿光,疲惫的学生仍在记录新一轮的数据。尽管实验室配备了自动化设备,但生物钟的研究依然考验着每个人的耐心与毅力。“决战96小时”成了实验室的标配,而这种不规律的作息却讽刺地打乱了研究生物钟的人自己的生理节律。
猜了两年,学生终于熬不住了,找他申诉,“我马上就要毕业了,不能再一直这样做下去”。做“恐龙级”课题的同行告诉他,“没有用,快点去做筛选吧”。他深知,在分子生物学领域,高通量筛选是标准方法论。但他另一方面又认为,科学不应该只是机械地筛选万千分子,真正的科学突破往往源于敏锐的直觉和深刻的思考。
他坦言,那段时间最有压力的不是自己,老板们忙于各种各样的课题,“东方不亮西方亮”,对时间的流逝没有太多的感知,研究机构也有很好的支持,反倒是学生承担了繁琐的重复劳动和时间压力。
最终,张二荃还是不得不放弃执念,选择了高通量筛选,通过功能筛选和物理相互作用筛选相结合的方式找到了RUVBL2。而在RUVBL2的发现让实验室沸腾之际,张二荃却收到了《科学》杂志的拒稿信。“这不够基础”,审稿人如此评价。六年的心血,最终只能发表在一本转化医学期刊上。这个结果让整个实验室都感到些许失落。
但张二荃并未因此止步。在研究虫草素的过程中,他们意外发现,当使用脱氨酶抑制剂时,虫草素半衰期不仅得到延长,还能显著影响生物钟周期。这个发现让他重新燃起了希望,也许RUVBL2还是打开生物钟周期调控之门的钥匙。
这篇关于虫草素的研究发表后,实验室迎来了新一批充满热情的学生。2023年起,张二荃带领他们开展了一项新的计划:利用CRISPR-Cas9技术对RUVBL2进行定向基因突变筛选。
22个短周期突变体,302个长周期突变体,55个完全失去节律的突变体。这种双向性的周期改变,在生物钟研究史上极为罕见,此前只在果蝇period等少数核心生物钟基因中观察到过。“这证实了RUVBL2确实是一个真正的生物钟基因”,张二荃说道。
更令人兴奋的是,当他们对这些突变体进行测序时,发现许多关键突变都集中在Walker A结构域周围,这个区域正是负责ATP酶活性的关键位点。
两篇文章明显“头重脚轻”,一篇工作耗时更久,打下了基础但鲜少被人注意,第二篇工作花费时间短,但引人瞩目,这是否会让作者感到不平衡?张二荃笑着说道,“还好,我们都‘内部消化’了。第二篇文章的第一作者刚好是第一篇文章作者的太太”。
02
统一了矛盾
在那场寻找KaiC系统失败的旅程后,生物钟领域被一种二元分化的思想所主导。
多数研究者认为蓝藻中那套神奇的KaiABC系统是原始生物特有的孤例,一种进化的“死胡同”,与真核生物复杂的转录-翻译反馈环路毫无关联。在这种主流观点之外,另有少数学者坚持寻找共同机制,但他们的焦点几乎全部集中在KaiC的自发磷酸化/去磷酸化循环上,视之为可能的共同祖先机制。
张二荃团队的发现彻底打破了这一范式。他们证明了生物钟的核心机制既不是KaiABC系统的特有属性,也不是磷酸化/去磷酸化循环,而是一种此前被忽视的特性,极其缓慢的ATP水解酶活性,也是过去二十年科学界寻找Kai C系统功亏一篑的原因。
当张二荃比较两个分子的结构发现,两者在氨基酸序列上存在很大差异,相似度不到 10%,但它们在ATPase结构域的氨基末端(约 80 个)却表现出极为相似的二级结构。因为 KaiC 和 RUVBL2 都属于一个称为 P 环NTPases的超家族。
为何如此之慢?答案隐藏在分子结构的精妙细节中。
在高分辨率晶体结构中,研究人员观察到了RUVBL蛋白的活性位点有一个特殊的构型:负责水解ATP的水分子,所谓的“裂解水”,被刻意放置在一个“尴尬”的位置。就像一位投手被迫以不自然的角度投球,这个水分子必须从一个不利的角度和距离发动对ATP γ-磷酸的进攻。
这种结构上的“不便”并非缺陷,而是功能。
在高效ATP酶中,这个关键的裂解水通常与ATP的γ-磷酸保持约3.0-3.5埃的理想距离,并且接近180度的直线攻击角,这种几何构型能够确保水分子对磷酸键发起高效的亲核攻击。然而,在RUVBL2中,这个水分子被推离了至少5.5埃的距离,且攻击角度偏离了最佳值约50度。这种看似微小的结构差异,对反应速率产生了指数级的影响。
早在五年前,张二荃就得到了RUVBL2分子的结构图,但是起初并不知道该如何理解。直到一次大会上和KaiC发现者交流,两人同时拿出两张结构图,水分子的位置迅速成了他们关注的焦点。有了这次“点拨”,他们开始修改RUVBL1中的关键天冬氨酸残基(D353),这台缓慢的分子马达几乎完全停止了运转;而修改附近的对照残基(D356)则对酶活性毫无影响。
通过修改特定氨基酸来调整生物钟的周期,这不乏让人浮想联翩。人的身体里不光存在着24小时的生物钟,还有别的时针级、分针级、秒针级的时间感应,甚至非节律的生物钟。如果我们能挖掘操控周期的奥秘,这对于应对神经性疾病至关重要,例如双相情感障碍、季节性情感障碍等。了解人体的时钟如何运作也能带来新的想法,比如在一天中对身体影响最大的时间服用药物。在这个方向,张二荃实验室已布局多年,通过和神经生物学家合作各取所需,一个关注脑区和神经元编码,一个关注分子。
而接下来,张二荃认为最为紧迫的事是找到RUVBL2的两个兄弟,就像KaiC之于KaiA和KaiB,有了它们的辅助,在体外重建完整的24小时周期的振荡。到那个时候,教科书将得以真正的改写:RUVBL系统是生物钟的起源。
采访的最后,张二荃提到了他科研路上的英雄楷模——KaiC领域的开拓者近藤先生。在近藤先生的科研生涯中,他的研究对象从早期的衣藻转移到大肠杆菌、酵母等,最终才锁定到KaiABC系统的主角蓝藻身上。虽然近藤先生在此领域从无到有地建立了KaiABC系统节律的检测方法,并阐明了其精妙的分子机制,为该领域的后续研究奠定了坚实的基础,但他始终低调做事,专注于科学问题本身,不去追求各种名利光环:他一生只获得过为数不多几项大奖,比如2007年的日本政府紫绶勋章(排在他之前的是因发现诱导多功能干细胞而获诺贝尔奖的中山伸弥)、2014年的日本学士院奖(排在他之后的是因睡眠机制研究而被公认将会获诺奖的柳泽正史)。在近藤先生之后,有多达十几篇关于KaiABC的文章爆发性地发表在《自然》、《细胞》、《科学》这三大期刊上,而他本人作为领域的开拓者,并没有被所谓的影响因子冲昏头脑,而是继续坚持自己小而美的研究,踏实地做着精细但并不轰动的工作——直至走到生命的尽头。
0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 