我们需要特别关注特殊人群中的疫苗接种率,需要让高危人群通过接种疫苗降低重症风险 | 图源:
按
疫苗接种与新冠死亡风险的关系随着奥密克戎疫情的发展已经逐渐清晰。然而,作为特殊人群,如老年人、基础疾病患者、患有癌症等严重疾病人群、孕妇、孩童等,因担心接种疫苗安全性问题等疫苗犹豫(注:指个体 “尽管可以接种疫苗,但仍延迟或拒绝接受疫苗” 的行为或心理)而迟迟未能接种,甚至一些医护人员也因对最新研究不够了解而不敢推荐,导致新冠感染高风险人群疫苗接种率低于健康人群,重症和死亡风险增大。
这篇文章详细介绍了国外mRNA如何在循证医学基础上不断向特殊人群扩展,希望能为一些读者答疑解惑。
撰文 | 周叶斌
责编 | 刘楚
越来越多的研究表明,新冠在老年人、有基础疾病的人群中危险性更大 [1]。但截至目前,中国老年人群的疫苗接种率却落后于其他人群和欧美和亚洲一些同样老龄化的国家。
对于这些特殊人群,新冠疫苗安全吗?会有效吗?国外一些疫苗是如何确认能在各个特殊人群里使用的?它们的推广有哪些经验启示?
1、临床试验中专门加入的特殊人群
全球普遍共识是,在一个疫苗上市之前药企需要通过临床试验来确定它的安全性、有效性。其中,三期临床试验招募人数最多,也能获得最充分的有效性、安全性数据。因此疫苗上市时的适用人群需要尽量与三期临床试验中的人群类似,或者说在设计与执行疫苗的三期临床试验时就要考虑招募志愿者能否代表现实世界中人群不同健康状况的多样性,特别是能否涵盖一些关键受众。
针对新冠来说,我们已经知道老年人的重症、死亡风险都远远高于年轻人,是明确的高危人群。因此从保护高危人群的角度,老年人显然是新冠疫苗非常关键的目标人群。此外,很多老年人同时也患有基础疾病,能否作为常见基础疾病患者群体的一部分。因此,国外一些新冠疫苗在临床试验阶段就考虑到了老年人与常见基础疾病患者这两大人群的招募问题。
以目前全世界使用国家最多的辉瑞/BioNTech新冠mRNA疫苗BNT162b2为例,三期临床试验共招募43548人,在获得欧美紧急使用授权时,疫苗生产商提供的安全性数据包括了接种第二针疫苗后跟踪时间超过2个月的37706人,这其中,55岁以上人群占比42% [2]。
由于在招募时就考虑到了老年人群,BNT162b2在三期临床试验里不仅收集到了充足的老年群体安全性数据,还可以利用亚组分析研究该疫苗在老年人中的有效性数据。
表1中,BNT162b2三期临床试验中期分析时65岁以上老人疫苗组有3848人,75岁以上有774人,相比安慰剂组,疫苗降低新冠疾病的风险都与其他年龄段类似,可以证明该疫苗在65岁及以上老年人群以及75岁及以上高龄老人中安全有效。
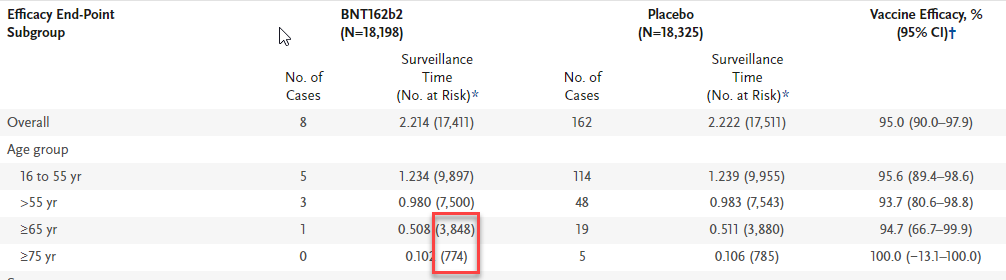
表1 不同年龄段BNT162b2在中期分析时的疫苗有效性[2]
该疫苗临床试验招募也同样考虑到了基础疾病因素,在BNT162b2的三期临床试验中,志愿者中BMI(Body Mass Index,身体质量指数)超过30的肥胖患者约占35%;此外,慢性肺病、心血管疾病、糖尿病等常见基础疾病在所有志愿者中占比达到20%;同时也有少数癌症患者、HIV感染者等被招募入组 [2]。
正是由于在三期临床试验中有完善的老年人、常见基础疾病患者数据,BNT162b2等疫苗在国外获批紧急使用授权时才能安心地把这些高危人群安排在与医护人员一样的优先接种顺位上,通过尽早接种疫苗来获得免疫保护,降低新冠感染风险。
2、允许迟到但不允许偷工的未成年人疫苗
疫苗接种的另一个特殊群体是未成年人,一直以来药企和监管部门对于这个人群的新药研发都是非常谨慎的。
不同的是,未成年人并不是新冠感染的高危人群,反倒是感染后重症风险最低的一个群体 [3]。因此,针对未成年人的新冠疫苗研发也走在了后面,甚至在成年人新冠疫苗的临床试验成功之后才逐步上马。
对于未成年人来说,一个很关键的问题是该用什么剂量,是否需要和成年人接种相同剂量和针次的新冠疫苗。辉瑞在BNT162b2的三期临床试验时动了点小心思,在原本计划招募18岁以上受试者基础上,向美国食品药品监管局(FDA)提出了一个补充招募16-18岁青少年人群的提议。理由是这个年龄段的未成年人与成年人在各项生理特征上类似,可以考虑使用同一个剂量接种。FDA也同意了辉瑞的提议。
因此,当BNT162b2在美国申请紧急使用授权时,凭借的是一个受试者是16岁以上的三期临床试验数据,也因此先一步进入了未成年人群的疫苗施打计划。
但FDA最后也仅将授权接种疫苗人群的年龄开放降低到16岁,对于更小的孩子,FDA明确要求药厂重新确立合理剂量,单独进行临床试验。
这些剂量最初都是在少数受试者中尝试确立的,并在正式获批前经过了更大规模的临床试验来检验有效性和安全性。
未成年人新冠疫苗研发与成人不同,这个年龄段感染新冠后很多是轻症甚至是无症状 [3],要在三期临床试验里通过观察疫苗组与安慰剂组的感染病例差异计算有效性极为困难,需要招募更大规模的受试者,大幅延长试验时间,并不现实。
为此,目前欧美已上市的几款新冠疫苗未成年人群的三期临床试验大多采用了免疫桥接的设计——即在已知该疫苗在成年人高度有效的情况下,在未成年人群中,只需要验证疫苗诱发的免疫反应与成年人相似就能推断出疫苗也有效。
这种设计大幅降低了原本验证有效性的入组人数要求,但为了明确疫苗安全性,最终试验所要招募的受试者人数也不少。
以BNT162b2发起的5-11岁儿童临床试验为例,药厂在2021年10月递交FDA申请该人群的紧急使用授权,提供数据的三期临床试验总共入组超过4500名儿童,其中疫苗组3109人 [4]。
这是什么概念?对于全新的新冠疫苗,FDA的要求是三期临床试验里至少提供3000名疫苗接种者的安全性数据。也就是说,虽然BNT162b2已经做了4万人的成年人三期临床试验,并且在之后几个月在全球陆续有上亿人次接种,而对于这样一个针对儿童人群的免疫桥接和安全性验证试验,临床试验数据达到了一个全新疫苗的标准要求。
凭借多重数据,BNT162b2最终获得了5-11岁儿童组的上市许可。同时,欧美在未成年人疫苗上市后也与成人一样持续跟踪疫苗在真实世界里的有效性、安全性数据。
真实世界数据的研究十分重要,例如mRNA疫苗罕见的不良反应心肌炎,就是在上市后跟踪确认的。从目前跟踪数据看,这一不良反应在18-25岁年轻男性接种完第二针后风险最高,但也不超过五千分之一,随着年龄减少也有所下降,5-11岁男童第二针后心肌炎风险低于十万分之一 [5]。此外,病例跟踪显示此类心肌炎都较为轻微,大部分病例都确认完全康复,风险收益看,已上市的两个mRNA疫苗的收益都远大于风险。
目前欧美在未成年人中使用的主要是BNT162b2疫苗,施打剂量在16岁及以上成年人中是30微克一针,而在12-15岁未成年人也继续采用30微克,但在5-11岁儿童群体里则降低到10微克一针。
3、临床试验中刻意回避的孕妇
如果说未成年人群的三期临床试验只是被推迟了,那么另一个特殊人群则是被临床试验刻意回避排除了,那就是孕妇群体。
这种排除也是有原因的。在临床试验阶段的药物,研究者对其安全性的了解是有限的,每个参与临床试验的志愿者都需要签署协议承担一定的风险。从伦理角度看,研究者不会把孕妇这样的特殊人群加入到最初的三期临床试验中,而是需要在一般人群中获得足够的安全性数据后,再考虑是否要在孕妇群体中开展新的临床试验。
因此,包括BNT162b2在内的新冠疫苗研究者,在设计三期临床试验入组标准时都把孕妇群体排除在外。但由于两个mRNA疫苗三期临床试验招募的人群规模非常大,有少数受试者在进入试验后发现怀孕,这些少数孕妇在试验的跟踪过程中发现没有任何意外情况,成为mRNA疫苗在该特殊人群中最早期的安全性数据 [6]。
但这种极有限的数据量显然无法作为在孕妇中大规模推广疫苗的支持证据。为此,在最初的三期临床试验成功后,辉瑞、Moderna都宣布会招募孕妇受试者做独立的三期临床试验,提供更充分的安全性、有效性数据 [7]。
事实上,当新冠疫苗在欧美上市之初,医护人员都被推荐作为第一优先接种顺位,而该人群中就有处于孕期的女性。考虑到一线的女性医护工作者有较高感染新冠的风险,孕妇又是新冠高危人群,因此当时欧美各个卫生部门的做法是持 “中立态度” ——既不像其他人群一样明确推荐接种,但也允许她们自愿接种。
在推荐指南中不明确表态并不代表 “不作为”,包括美国疾控中心(CDC)在内的欧美各国公共卫生部门专门开展了针对接种新冠疫苗的孕妇群体的安全性追踪研究。
美国CDC专门为新冠疫苗建立了一个名为 “v-safe” 的安全性跟踪系统,疫苗接种者可以直接上报各种身体不适状况。两款mRNA疫苗在欧美上市后仅几个月后,研究人员就通过分析v-safe等疫苗安全性跟踪系统中孕妇的足量数据,发现接种疫苗的孕妇没有出现异于常人的不良反应,在妊娠、分娩等各方面的数据也无异常 [8]。
这类现实世界中的及时跟踪研究,大大增进了我们对孕妇群体接种疫苗的安全性认知,也成为美国CDC、美国妇产科学会等在后续明确推荐孕妇接种新冠疫苗的决策依据 [9]。
如今看来,在自愿接种基础上获得的孕妇群体真实世界数据极为关键。由于参与三期临床试验存在成为安慰剂组的风险,辉瑞等药企招募孕妇做三期临床试验异常困难,入组速度远低于预期 [10]。因此,如果没有上述真实世界这些完善的疫苗安全性跟踪研究,我们可能会长期缺乏新冠疫苗在孕妇中的安全性数据。
后来更多的跟踪研究陆续表明,孕妇接种疫苗不仅是安全的,还大幅降低了感染新冠后重症的风险 [11],最近还有研究数据指向,孕期接种疫苗后新生儿也能因抗体通过胎盘的转运获得一定程度的保护 [12]。
令人遗憾的是,即便是在公共卫生部门大力鼓励孕妇接种新冠疫苗的欧美国家,相较普通人群,孕妇群体的疫苗接种率显著偏低:苏格兰的一项研究表明,2021年10月分娩的妇女中仅有32.3%接种了两剂疫苗,不足所有女性疫苗接种率的一半 [11]。疫苗犹豫让很多准妈妈面临着极高的新冠重症威胁。
4、为脆弱人群提供更好的保护
除了老年人、常见基础疾病患者、未成年人与孕妇,另一个疫苗犹豫严重的群体是患有一些严重疾病的人,例如癌症患者普遍担心能不能接种新冠疫苗。
很多患有这类严重疾病的患者及家属,往往会问对于他们这个群体疫苗是否安全,甚至希望通过检索找到专门针对他们这个具体疾病的人群三期临床试验数据,才能确认疫苗安全。
需要指出的是,这种常见误解没有注意到临床试验很难面面俱到,但很多情况是可以让特殊人群参考借鉴。
由于三期临床试验的招募人数毕是有限的,达到每种疾病都能单独分析的程度并不现实。而且一些临床试验涉及很多繁琐的安全性、有效性跟踪,需要记录大量数据,志愿者的配合度要求非常高。这也意味着,一些身患重病,如正在接受高强度癌症治疗的人是不适合参与新冠疫苗的三期临床试验的,因此研究人员也尽量排除受试者同时接受其他治疗的可能性,防止对试验有效性、安全性数据的干扰。
但这并不意味着疫苗对这些脆弱人群不安全。有两点可以考虑:第一,辉瑞和Moderna的两个mRNA疫苗临床试验都不只招募了健康人群参与试验,受试者本身有很多是有基础疾病的,虽然这些人未必和某个犹豫能否接种的人患的是一模一样的疾病,但显然可以说明疫苗不是只在健康人群中安全;第二,现在辉瑞/BioNTech的mRNA疫苗等新冠疫苗在全世界接种人数已经达到数亿规模,全球各地的安全性跟踪研究都没有显示某个疾病的患者出现安全性问题,如此大规模已接种人群中,我们能想得到的大多数病种大概率都有了安全接种的记录。
所以,包括癌症患者、血透患者等特殊脆弱人群,并不需要担心疫苗的安全性问题。目前在欧美,上述人群也都排在是公卫部门推荐接种新冠疫苗的优先顺位。
相比安全性问题,上述人群真正需要担心的是由于免疫抑制(immunosuppression,指对于免疫应答的抑制作用),疫苗可能在他们身上效果不够好。
因此,欧美很多公卫工作人员、疫苗接种计划制定者、医务人员与科研人员,更为专注的研究问题是如何提高这些脆弱人群的疫苗有效性。
例如,美国CDC在2021年8月发表的一项研究,总结了60多项免疫抑制人群中mRNA疫苗的免疫反应,发现这些人群的抗体转阳率与抗体滴度明显低于对照组的健康人 [13]。而这些脆弱人群一旦感染新冠,重症风险又很大。为此,欧美目前普遍采取的措施是让免疫抑制人群在接种完第二针mRNA疫苗一个月后再次接种第三针来提高保护。在完成三针全程接种之后,在再与其他人群一样,3-6个月之后再次接种增强针。
甚至,欧美一些发达国家最近开始为部分人群接种第二剂增强针,其中除了老年人群,就有包括癌症患者、血透病人、器官移植人员、自身免疫疾病患者等免疫抑制人群。
5、中国如何借鉴
总结一下,目前欧美各国在疫苗接种指南上,除了重症风险低的低龄孩童,其他特殊人群如老年人、基础疾病患者、患有严重疾病如癌症的脆弱群体、孕妇、5岁以上孩童等,都是强烈推荐接种并优先提供接种机会。
在中国面对传染性极强的奥米克戎BA.2突变株挑战的今天,我们需要特别关注特殊人群中的疫苗接种率,需要让高危人群通过接种疫苗降低重症风险。
我国老年人新冠疫苗接种率偏低,截至2022年3月17日,60-69岁老人完成全程基础免疫的比例是86.6%,完成加强免疫的比例是56.4%。70-79岁老人的数据是81.7%和48.4%。80岁以上高龄老人则更低,仅有50.7%和19.7% [14]。
这其中,很多患有基础疾病人群存在疫苗犹豫以及因各种原因无法接种的情况,导致他们在面对新冠疫情时风险极高。参考国外在各种特殊人群中推广疫苗的经验,我们能得到什么启示?
第一,也是最重要的一点是尊重数据。疫苗的推广,包括在某个人群做出什么程度的推荐,是强烈建议还是中立允许抑或是暂缓,都要基于真实的数据。这个数据可以有各种来源,可以是临床试验,也可以是在现实世界里的跟踪,或者是二者结合。
像老年人与有基础疾病的人群,欧美一些疫苗在三期临床试验里就收集到了足够的安全性有效性数据,一开始就强烈推荐接种。未成年人不是高危人群,就等到相关临床试验数据充分的情况下再推荐。孕妇临床试验数据缺乏,但通过真实世界跟踪,数据收集够了,也从中立转为强烈推荐。只有足够的数据,推荐时才能有理有据;没有足够的数据,空口推荐接种是无法服众的。
第二,疫苗的数据是不断积累的,推广疫苗接种时也要跟上脚步。例如BNT162b2在三期临床试验总共招募入组4.4万人,这在所有新冠疫苗三期临床试验里是最多的,受试者多样性程度也很高。但即便如此,这个疫苗的数据收集并不止步于一个三期临床试验,获得紧急授权接种后,药企与监管机构一直在现实世界里开展跟踪接种者的安全性、有效性研究。在成年人群获得授权后,为了推广到未成年人,药企也是在与监管机构高效沟通的基础上,确立完善的试验计划,在不影响数据质量的前提下尽快验证疫苗的有效性、安全性。
我国很多老年人、基础疾病人群接种疫苗非常犹豫,其中一个担忧就是疫苗没有在类似人群里做临床试验,无法确认其安全性。这其实是一种误解。
国内施打最多的新冠灭活疫苗,最初的三期临床试验确实以招募医务人员为主,缺少高危人群数据。但随着在海外多个国家如巴西、智利、土耳其大规模人群接种应用,也因此收集到了大量高危人群中的数据。例如,2021年9月发表的一项研究已经显示新冠灭活疫苗在老年人与有基础疾病的人群中是安全有效性的 [15]。
除了接种疫苗的人群自身,相关医务人员在推广疫苗接种时需要跟上这些数据的更新。有些情况下,老年人、有基础疾病的人自己想接种,反而是负责接种的医务人员由于没有获得最新的灭活疫苗真实世界研究数据更新,不愿担责因此不敢打。
上述这些情况都是非常令人遗憾的,公共卫生部门需要把疫苗的最新数据及时更新公示出来,及时向医务人员、普通大众科普,才能有效提高疫苗接种的效率,降低高危人群感染风险。
第三,没有一个疫苗是完美的。在不断研究、跟踪疫苗的有效性、安全性时,不可能每个结果都符合我们预期。
比如说在免疫抑制人群里,被认为免疫原性非常好的mRNA疫苗,也会出现激发的免疫反应不足,出现接种防止感染、重症、死亡的效果不好的情况。但这些数据同样是非常重要的发现,只有看到这种“糟糕”的结果,公卫部门才能调整接种方案,通过增加疫苗接种,以及使用其他防护措施,让免疫抑制的高危人群获得足够的保护。
同样的,mRNA疫苗在现实世界的跟踪里也发现了极罕见的心肌炎不良反应,腺病毒疫苗也有极罕见的血栓风险。任何一个疫苗都无法完全排除有罕见的严重不良反应风险,但只有坚持不断跟踪疫苗的安全性,才能把这些问题找出来,做真正的收益风险分析,给出更为有利于人群健康的接种建议。
最后,良好的信息沟通渠道非常重要。从欧美的经验来看,老年人与基础疾病人群中疫苗接种率已经较高,但孕妇和未成年人群则表现较差。这种差异很可能与公众沟通的效果有关。在老年人与基础疾病患者中,欧美公卫部门在阐述新冠的风险上做得更为到位,制定接种计划时也有很多倾斜扶持,例如会采取外派医生到养老院就地提供接种等积极措施。
而在孕妇与未成年人中,一些反疫苗组织的阴谋论却占据了不少社交媒体空间。如何应对关于疫苗副作用的各种谣言以及破解疫苗犹豫,今后将是各国公卫部门都要正视的危机。
同样的,中文社交媒体上也有很多反疫苗的谣言,国产疫苗在一些特殊人群如孕妇、癌症患者中的安全性有效性数据也较少被宣传。这些因素都合并导致上述特殊人群的疫苗接种率更低。
面对各地新冠奥密克戎疫情的危机,我们需要提醒高危人群,接种疫苗来获得保护刻不容缓。而这篇文章,希望能给决策者一些参考,我们需要用一个疫苗最全面、最真实的数据来说服那些存在疫苗犹豫、还不确定自己能否接种疫苗的人。
《知识分子》专栏作者
阿拉巴马大学伯明翰分校博士,现就职于药企从事新药研发工作,业余写写科普,微信公众号:一个生物狗的科普小园。

周叶斌
参考文献:
[1]Vaccine effectiveness of two and three doses of BNT162b2 and CoronaVac against COVID-19 in Hong Kong Martina E. McMenamin, Joshua Nealon, Yun Lin, Jessica Y. Wong, Justin K. Cheung, Eric H. Y. Lau, Peng Wu, Gabriel M. Leung, Benjamin J. Cowling medRxiv 2022.03.22.22272769
[2]
[3]
[4]
[5]
[6]
[7]
[8]
[9]:covid%20vaccine%20for%20pregnant:sem.ga:p:RG:GM:gen:PTN:FY21
[10]
[11]
[12]
[13]
[14]
[15]
0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 