撰文 | 商 周
责编 | 王雨丹
最近,印度暴发了第二波新冠疫情,单日新增确诊病例创下了超40万的世界记录。
这次印度新冠疫情大暴发,一个值得关注的现象是在S蛋白上同时带有L452R和E484Q 突变的B.1.617新冠病毒支系的流行 [1]。这两个位点都被证明和新冠病毒的免疫逃逸有关, 能够部分避开人通过感染或接种疫苗所建立起的对新冠病毒的免疫反应 [2,3]。
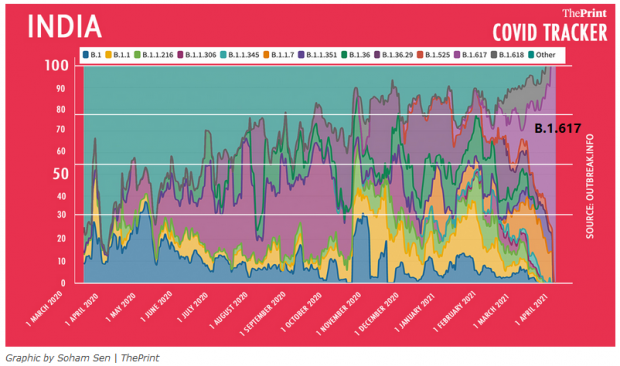
印度过去一年里各新冠病毒突变体的分布情况(图源:参考链接1)
根据来自印度的新冠病毒样本的测序结果来看(上图),B.1.617 支系在过去的两个月迅速成为了当地主要流行的新冠病毒支系 [1]。不仅如此,存在 “双重突变” 的B.1.617 已经部分流散到了世界各地。这一新冠病毒支系究竟是怎么回事?疫情持续恶化的印度,又会不会进一步成为新冠病毒继续突变的温床?
要回答这些问题,得先了解病毒突变是如何发生的,免疫逃逸突变又是什么?
基因突变,新冠病毒的利器
作为一种简单的生命,病毒不能自己独立生存,它们需要寄生在宿主细胞里才能完成自身的繁衍。为了更好地在宿主细胞里生存下去,病毒进化出了各种各样的策略,其中之一就是抗原性漂移(Antigenic drift),也就是通过积累基因突变的方式产生抗原层面的变化,最终逃避宿主免疫系统的 “围剿”,然后在原本有了免疫力的宿主体内里继续生存、繁衍。
根据基因存在的形式,病毒可以分为两大类:DNA病毒和RNA病毒。在病毒复制的过程中,基因密码偶尔会出现错误,DNA病毒能够利用宿主细胞的修复系统对错误进行纠正,但RNA病毒却不能。因为这种差异,RNA病毒基因突变的速度要远远高于DNA病毒(通常是几百甚至几千倍)[4]。
复制出现错误不能修复,这对生命来说本来不是好事,因为不利于维持生命自身的稳定。但RNA病毒充分利用了这一点,把高突变率当成了自己进化的利器。新冠病毒就是RNA病毒,它也可能利用基因突变来让自己产生抗原漂移,从而让自己更好地在宿主间传播。
那么,一个突变从产生到流行,这一过程是如何发生的呢?
前面提到,在病毒复制过程中,基因密码偶尔会出现错误,事实上这种复制错误是随机的,所以基因突变可以发生在整个病毒的基因组上:既可能发生在无关紧要的地方,不会导致蛋白水平上的变化;也可能发生在致命之处,让病毒本身失活,不再适合生存;还可能发生在某些关键的部位,导致病毒的适应能力提高。
这些突变首先只是在极少数病毒个体上发生,那么这些拷贝数极少的突变是否会保留下来、甚至被放大和流传,从而达到 “星星之火,可以燎原” 的效果呢?
这就取决于自然选择的力量,这股力量把更适合生存的突变挑选了出来。好比一堆沙子里出现了一小块金属,用一块磁铁就能把它选出来。
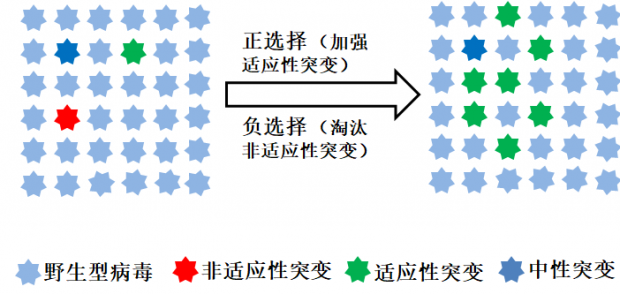
病毒突变和选择简单示意图 (绘图:商周)
如上图所示,突变的病毒会面临两种选择。一方面,不利于病毒生存的突变(比如导致病毒死亡的、导致病毒无法感染宿主细胞的突变)将会被淘汰,这就是负选择。另一方面,能够帮助病毒更好生存的突变不仅能够保留下来,而且会慢慢成为主流,这就是正选择。而那些无关痛痒的中性突变,则一般不会受到上面两种选择的影响。
现在回到新冠病毒身上来,基因突变主要会影响病毒的三个方面:传染性、致病性(导致疾病的严重程度)、免疫逃逸能力(对宿主已经建立的特异免疫反应的躲避能力)。
从理论上来说,能够增加病毒传染性的突变是适应性突变,会在疫情中扩散和流传,这一点在疫情初期,人群对病毒都没有免疫力的时候尤其适用;而导致致病性增强的突变反而对病毒的扩散不利,因为病情严重的人会被隔离,或者死亡;而增强免疫逃逸能力的突变也会在疫情中流传,尤其是在疫情后期,人群中已经有不少人对病毒有一定免疫力的情况下。
以上就是新冠病毒突变的基本原理,现在我们回到B.1.617突变上来,它的影响究竟有多大,会导致全球疫情再度失控吗?
B.1.617突变,免疫逃逸能力几何?
为了更好地讨论B.1.617突变的影响,我们把它和其他的新冠病毒突变支系做一个比较。
新冠病毒在全球流行了一年多的时间后,已经产生了多个能帮助它在人群中蔓延的突变支系,其中几个还展开了广泛的研究:
1、2020年2月,意大利出现了S蛋白上带有D614G突变的新冠病毒,这一突变被认为明显增高了病毒的传染性。这个带D614G突变的B.1大支系,从意大利扩散到了全世界,成为了全球正在流行的众多新冠病毒支系的源头 [5,6,9]。
2、2020年6月,美国出现了在S蛋白上携带有L452R突变的B.1.427和B.1.429支系,它们不仅有着稍微增强的传染性和致病性,还有着较强的免疫逃逸能力 [2,6]。
3、2020年10月,英国出现B.1.1.7突变支系,它在S蛋白上携带有N501Y,P681H,69-70del等多个突变,这些突变让B.1.1.7 支系有更强的传染性和致病性,还有轻微的免疫逃逸能力 [6,7,9]。
4、2020年10月,南非出现B.1.135突变支系,它在S蛋白上携带有N501Y, K417N, E484K等突变,有着较强的免疫逃逸能力,同时传染性和致病性也有所增强 [3,6,8,9]。
5、2020年12月,巴西出现了在S蛋白上携带有N501Y, E484K和K417T突变的P.1支系 ,它不仅有着增强了的传染性和致病性,也有着部分免疫逃逸的能力 [3,9]。
那么,印度出现的B.1.617突变支系呢?
最近,一个来自印度的团队对B.1.617的免疫逃逸能力进行了研究 ,结果以预印本的形式先发表了出来 [6]。
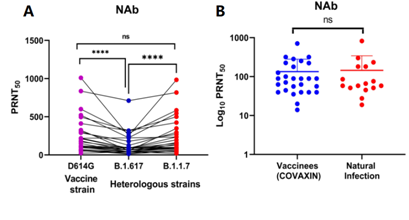
B.1.167突变的免疫逃逸能力的评估(图源:参考链接10)。A: COVAXIN疫苗接种者的血清对野生型新冠病毒(带有D614G突变,用来研发疫苗的支系)、B.1.167、B.1.1.7 的中和情况。B: 新冠自然感染患者的血清以及COVAXIN疫苗接种者血清对B.1.167支系的中和情况。
如上图所示, 相对于野生型的新冠病毒对照,B.1.16支系只有轻微的免疫逃逸能力(让中和抗体的效率下降2倍左右)。而且,新冠病毒感染康复者和新冠疫苗接种者(印度开发的灭活疫苗COVAXIN)的血清都能够中和B.1.617 [10]。
这一发现如果得到确认,那么B.1.617突变支系的免疫逃逸能力并不算强,因为南非的B.1.135突变支系能让中和抗体的效率下降近10倍。
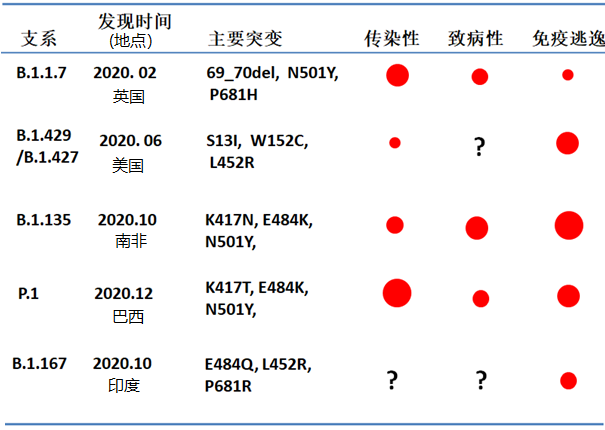
常见的突变新冠病毒支系所带来的效应(作图:商周,信息来源:参考链接2,3,5-10)。红色代表增强,圆圈大小代表增加的强度 (相对带有D614G的B.1支系)。
现在我们可以把几个常见的新冠病毒突变支系放在一起比较一下。在免疫逃逸能力上,最强的是南非发现的B.1.135支系,其次是巴西发现的P.1支系和美国发现的B.1.429/B.1.427支系,再次才是印度发现的B.1.617支系,以及最弱的是出现在英国的B.1.1.7支系。
所以,单从免疫逃逸方面来看,B.1.617的危害相对来说并不大。当然,这不是说我们不需要重视B.1.167的防疫,它之所以能够在短时期内席卷印度,除了因为其有着部分免疫逃逸能力外,另外一个可能的原因是它的传染性较强。当然,这一猜测有待研究确认,它的致病性也需要研究。
所以,我们需要加强对这个新冠突变支系的防护,但没有必要恐慌。
印度是新冠病毒免疫逃逸突变的温床吗?
随着疫情的发展,被新冠病毒感染的人群比例越来越高,再加上疫苗接种的普及,对新冠病毒有免疫力的人会越来越多。所以,具有免疫逃逸能力的突变将会是左右未来新冠疫情的重要危险因素,也是疫情控制的一个关键,因为新冠病毒一旦拥有了(较强的)免疫逃逸能力,人类对它建立起来的免疫力(通过感染或接种疫苗)就可能部分甚至全部失效。
这一点,从这些新冠病毒突变出现的时间顺序上也能体现出来:在疫情前期,出现和流行的是偏向增强传染性的突变(比如D614G, N501Y)。
而随着疫情的发展,一些新冠病毒感染人数较多的地区(比如巴西、美国、印度、南非)则出现了具有免疫逃逸能力的突变(比如E484K和E484Q)。
随着印度疫情的失控,不少人在担心,这个医疗卫生资源有限的人口大国,会成为新冠病毒免疫逃逸突变的温床吗?
要回答这个问题,我们需要了解一下免疫逃逸突变的温床是什么。
就像上面提到的的那样,病毒突变的产生是随机的,且以一定的速度进行。
和其他任何突变一样,带有免疫逃逸能力的突变产生的多少取决于两个因素:
一是时间,时间越长越可能产生。这个时间包括两个层面:第一是病毒在宿主个体里停留的时间,久病不愈的感染者体内出现突变的概率会比正常感染者要高得多;第二是病毒在人群中流行的时间,越长越容易发生突变。
二是病毒数量,越多越容易产生突变。这个数量也包括两个层面:第一是病毒在宿主个体里的数量,第二是被感染宿主的数量。
突变以后的新冠病毒是否会流行,则取决于另外一个重要的因素:自然选择。就像上面比喻的那样,一堆沙子里出现了一小块金属,需要磁铁把它选出来。对于具有免疫逃逸能力的突变来说,它的选择力量就是免疫压力,具体而言就是人体对新冠病毒的特异免疫力。
那么,如何理解免疫压力的选择力量?
免疫逃逸突变发生与免疫压力的关系 (图源:参考链接11)
就像上图里显示的那样,免疫逃逸突变的产生和流传,和宿主的免疫压力相关。这个免疫压力来自两个层面:个体和群体,个体层面的免疫压力帮助突变在宿主个体内里增殖,群体层面的免疫压力则帮助病毒在宿主间传播。
当免疫压力不存在的时候,比如疫情开始阶段,所有人都没有对新冠病毒的特异免疫力,病毒能够大量增殖并随机产生免疫逃逸突变。但这样的免疫逃逸突变发生了,因为缺乏免疫压力这一自然选择因素,也难以扩大和流行。
当免疫压力太大,比如针对新冠病毒的特异免疫力很强的时候,病毒会被迅速消灭,这种情况下也难以产生免疫逃逸突变。
而当免疫压力处于中间位置时,即处于不完全免疫状态,病毒能够部分增殖,从而随机产生免疫逃逸的突变。而并不强的免疫压力又可以作为一种选择力量让这种突变扩散开来。所以,从理论上来说,这种不完全免疫的状态就是免疫逃逸突变的自然选择力量,在免疫逃逸突变发生和流行的过程中发挥了至关重要的作用。
不完全免疫状态(针对病毒的免疫力弱)下的免疫压力能够催生免疫逃逸突变,不只是停留在理论层面,在实践层面也得到了证明。
比如,最近在Science 上发表的一项体外研究显示,在细胞培养实验里如果只加入一种针对新冠病毒S蛋白的抗体,那么S蛋白就容易产生逃避这种抗体的突变;而如果在细胞培养实验里同时加入两种不同的针对新冠病毒S蛋白的抗体,那么S蛋白就很难产生能逃避抗体的突变 [12]。
这个研究所揭示的 “不完全免疫状态能够催生免疫逃逸突变” 现象,在现实世界里同样适用,一个最好的例子就是流感病毒。
流感病毒也是RNA病毒,有着很高的基因突变频率。被感染的人群里有部分只会产生较弱的针对流感病毒的免疫反应,因而处于一个不完全免疫的状态。当具有高突变能力的流感病毒感染了处于不完全免疫状态的个体后,免疫逃逸的突变就能够产生并被选择出来,然后再传递给他人。因此,流感病毒会不断产生具有免疫逃逸能力的突变,在时间的长河里形成一波又一波的流感疫情 [11]。
那么我们所关心的新冠病毒呢?
新冠病毒也是RNA病毒,基因突变的速度只有流感病毒的二分之一到三分之一,但这依然是一个让人担心的速度。更重要的是,在被新冠病毒感染过的人群里,有部分人不能产生强而有效的免疫力,比如无症状患者的免疫力要明显低于有症状患者 [13]。这些被新冠病毒感染后产生不完全免疫力的人,从理论上来说就有可能帮助新冠病毒免疫逃逸突变的发生。
从实际情况来看,新冠病毒也的确发生了多个具有免疫逃逸的突变,尤其是巴西P.1, 南非B.1.135和 美国B.1.429/427支系,它们有着相对较强的免疫逃逸能力,能够将中和新冠病毒抗体的有效率降低几倍甚至十几倍 [2,3]。
以上关于免疫逃逸突变和免疫压力的论述,能帮助我们了解什么是新冠病毒免疫逃逸突变的 “温床”:
1. 长时间的感染和流行,为病毒突变提供了时间。
2. 大量的病毒增殖和感染病例,在数量上为病毒突变提供了基础。
3.对新冠病毒有不完全免疫力的人群,为病毒突变提供了自然选择力量。
那么,如今的印度,算是新冠病毒免疫逃逸突变的温床吗?
答案是肯定的,但问题的关键不仅仅是印度,只要是符合上面三个条件的国家或地区,都可以说是新冠病毒免疫逃逸突变的温床。这也是为什么在疫情严重的英国、美国、南非和巴西也出现了带有免疫逃逸能力的突变的原因。
那么,面对能产生免疫逃逸的新冠病毒,我们能做什么呢?
疫苗:人民的希望
新冠病毒发生免疫逃逸突变需要几个条件,这正是疫情防控的关键。
首先,我们需要尽量不给病毒突变提供时间。
一方面,对久病不愈的新冠感染者,需要给予特殊护理(比如隔离治疗,缩短病程),这样能防止他们成为病毒免疫逃逸突变的源泉。
另一方面,尽早控制疫情,不给病毒突变时间。
其次,新冠病毒突变需要以大量的病毒增殖为前提(包括个人体内病毒数量和群体里的感染病例数),所以采取相应的防控措施,减少感染的病例数,也将减少免疫逃逸突变的发生。
最后,新冠病毒免疫逃逸突变需要一个外在的选择力量,即宿主对病毒的不完全免疫力。在自然感染的条件下,新冠病毒能发生免疫逃逸突变,主要原因是部分被感染者体内产生的针对新冠病毒的免疫力比较弱、不完全。
而人对新冠病毒的免疫力,既可以从自然感染里来,也可以通过接种疫苗的方式获得。虽然自然感染很难让所有人都获得强免疫力,但疫苗的发明带来了希望,因为好的疫苗能够让人产生高效的免疫力。而且,如果进行多次接种,还能让这种高效的免疫力变得持久。
所以,当接种的疫苗能够让人获得针对新冠病毒的高效、持久的免疫力时,新冠病毒的免疫逃逸突变就会被抑制,从而让新冠疫情被控制下来。
当然,如果疫苗的效果不好,接种后产生的免疫力较弱,那么不仅不能保护个体被感染,无法实现群体免疫屏障的建立,还可能成为新冠病毒发生免疫逃逸突变的温床。所以,监测新冠病毒是否会在接种疫苗的人群里突变也是一件重要的事情。
幸运的是,大多数现有的新冠疫苗都能让人体产生与有症状新冠病毒感染者相当、甚至更高的免疫力。所以,尽快实现有效疫苗的全民接种,是遏制新冠疫情、真正建立起群体免疫屏障的最好方法。
参考资料:(可上下滑动浏览)
1.
2. Deng et al. Transmission, infectivity, and neutralization of a spike L452R SARS-CoV-2 variant. Cell in press.
3. Dejnirattisai et al. Antibody evasion by the P.1 strain of SARS-CoV-2 Cell 2021. 184, 1–16
4.
5.
6. Korber et al., Tracking Changes in SARS-CoV-2 Spike: Evidencethat D614G Increases Infectivity of the COVID-19 Virus2020, Cell 182, 812–827
7.
8.
9. Houriiyah Tegally et al. Detection of a SARS-CoV-2 variant of concern in South Africa. Nature 2021 592, 438–443
10.
11.
12. Grenfell et al. Unifying the epidemiological and evolutionary dynamics of pathogens. Science. 2004 Jan 16;303(5656):327-32.
13. Starr et al., Prospective mapping of viral mutations that escape antibodies used to treat COVID-19. Science 371, 850–854 (2021)
14. He, et al,. Seroprevalence and humoral immune durability of anti-SARS-CoV-2 antibodies in Wuhan, China: a longitudinal, population-level, cross-sectional study. Lancet 2021; 397: 1075-84.
制版编辑 | 卢卡斯
0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 